UPLC-MS/MS測定阿莫西林脈沖片在犬體內的藥動學和生物等效性
秦璐,皮佳鑫,祁東利,張謙,黃瑞,韓潤萍,劉志東
(天津市現代中藥重點試驗室制劑室-省部共建國家重點試驗室培育基地,天津現代中藥發現與制劑技術教育部工程研究中心,天津中醫藥大學,天津300193)
論著
UPLC-MS/MS測定阿莫西林脈沖片在犬體內的藥動學和生物等效性
秦璐,皮佳鑫,祁東利,張謙,黃瑞,韓潤萍,劉志東
(天津市現代中藥重點試驗室制劑室-省部共建國家重點試驗室培育基地,天津現代中藥發現與制劑技術教育部工程研究中心,天津中醫藥大學,天津300193)
目的:建立UPLC-MS/MS測定犬血漿中阿莫西林的方法并測定阿莫西林脈沖片的生物等效性。方法:以卡馬西平為內標,血漿樣品用高氯酸沉淀,并用UPLC-MS/MS測定血漿中阿莫西林含量。動物實驗采用隨機雙交叉自身對照實驗法,6只比格犬口服單劑量阿莫西林脈沖片參比制劑、受試制劑后測定其血藥濃度,計算藥動學參數,評價兩制劑的等效性。結果:自制阿莫西林脈沖片單劑量給藥其Ke為(0.50±0.16)h-1,t1/2為(1.53±0.57)h,AUC0-12h為(113.21±30.63)μg/(mL·h),Cmax為(31.53±7.37)μg/mL,Tmax為(1.83±0.41)h;市售阿莫西林脈沖片單劑量給藥其Ke為(0.44±0.16)h-1,t1/2為(1.78±0.76)h,AUC0-12h為(122.11±28.65)μg/(mL·h),Cmax為(31.01±7.63)μg/mL,Tmax為(2.08±0.58)h,相對生物利用度為(92.09±9.95)%。結論:以AUC0-12h,Cmax和Tmax為評價指標,自制的阿莫西林脈沖釋放片與市售的參比制劑在比格犬體內生物等效。
阿莫西林;脈沖片;生物等效;比格犬
阿莫西林屬于青霉素類抗生素,抗菌譜廣,殺菌力強,作用迅速,廣泛用于尿道、呼吸道及皮膚的敏感菌感染[1-3]。因為羥基和氨基的引入,阿莫西林具有很好的耐酸性,比一般青霉素更適合口服且抗菌譜更廣[4-5]。阿莫西林長效多脈沖片劑由美國MiddleBrook公司開發,于2008年1月獲FDA批準上市,商品名為MOXATAG,尚未在國內上市。該片劑主要用于治療成人及12歲以上兒童化膿鏈球菌引起的咽炎和(或)扁桃體炎,其劑量為775 mg/片,每日1片,減少了服藥次數,增加了患者的順應性[6-8]。有試驗證明[9]在對鏈球菌咽炎的治療中,阿莫西林混懸劑750 mg每日1次,療程10 d的方案與青霉素V混懸劑250 mg每日3次,療程10 d的方案同樣有效。筆者自制了阿莫西林脈沖片,采用液質聯用(UPLC-MS/MS)法作為檢測方法[10-11],對阿莫西林脈沖片在犬體內的藥動學特征及與市售的MOXATAG脈沖片的生物等效性進行了研究,為其臨床研究提供參考。
1 材料與方法
1.1儀器與材料
1.1.1儀器UPLC/MS/MS(Agilent 1690型);質譜儀:Agilent Technologies 6460 Triple Quad LC/MS型三重四極桿串聯質譜儀;XP205電子天平(瑞士METTLER TOLEDO公司);離心機(ThermoFisher Sorvall ST 16R);電子天平(德國ACCULAB公司ALC-110.4)等。
1.1.2藥品和試劑自制阿莫西林脈沖片,北京匯誠瑞祥醫藥技術有限公司提供,每片含阿莫西林775 mg,批號為20141230。陽性藥物為市售阿莫西林脈沖片,由Victory Pharma公司生產,每片含阿莫西林775 mg,批號為11019-6486。阿莫西林對照品:中國藥品生物制品鑒定所,含量為85.8%,批號為130409-201011。卡馬西平對照品:中國食品藥品檢定研究院,含量為99.7%,批號為100142-201004。甲酸:東京化成工業株式會社,含量>98.0%,批號為071206。甲醇:Fisher Scientific,色譜純,批號為145629。乙腈:Fisher Scientific,色譜純,批號為150788。
1.1.3實驗動物6條健康Beagle犬,雄性,體質量11~13 kg,北京沙河通利實驗動物養殖場提供,動物合格證:SCXK(京)2013-0007。
1.2方法
1.2.1給藥與采血實驗前,將6只Beagle犬隨機分成兩組,然后將自制阿莫西林脈沖片和市售阿莫西林脈沖片(775 mg)以完整片劑分別塞入Beagle犬的口腔會厭部,使Beagle犬自動吞咽并注入20 mL清水送下,給藥后0、0.5、1、1.5、2、2.5、3、4、5、6、8、10、12 h共13個時間點,使用涂有肝素的真空采血針取前肢靜脈血2 mL,5 000 r/min離心10 min,分離血漿,然后置-80℃冰箱保存待用。間隔1周后交叉服藥,同樣程序喂藥,采血。
1.2.2色譜與質譜條件色譜柱為Agilent EclipsePlusC1(82.1 mm×50 mm,1.8μm),柱溫為30℃,進樣量5μL,采用內標法定量。流動相條件見表1。
質譜條件:電噴霧離子源(ESI),正離子模式,多級反應監測(MRM),霧化氣流速13.0 L/min,霧化氣溫度350℃,其中阿莫西林和卡馬西平碎裂電壓分別為82 V和140 V,碰撞能分別為4 eV和14 eV,阿莫西林檢測離子對為m/z 366.11→348.7,卡馬西平檢測離子對為m/z 237.1→193.8。
1.2.3對照品溶液配制阿莫西林儲備液:精密稱定阿莫西林對照品29.17 mg,置于25 mL量瓶中,用水溶解并定容,濃度為1.00 mg/mL。卡馬西平工作對照液:精密稱定卡馬西平對照品2.90 mg,置于25 mL量瓶中,用乙腈溶解并定容,得到濃度為115.65 μg/mL的對照溶液,再精密吸取上述卡馬西平對照溶液2 mL放入100 mL量瓶中用乙腈定容,得濃度為2.31 μg/mL的內標工作液。
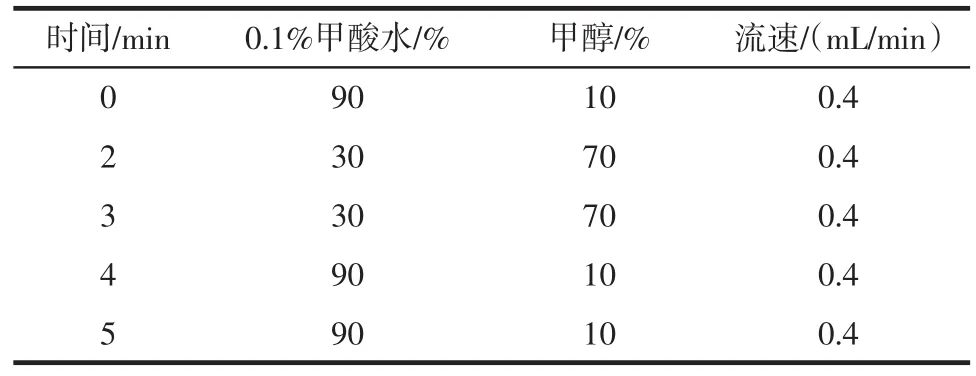
表1 流動相梯度Tab 1 M obile phase gradient
1.2.4血漿處理方法取200μL待測血漿置1.5 mL離心管中,加入500 μL高氯酸溶液(0.5 mol/L)和10 μL內標卡馬西平對照溶液,渦旋1 min,12 000 r/min離心5 min,取上清液500 μL加入碳酸鉀溶液(1 mol/L)100 μL,渦旋30 s,12 000 r/min離心5 min,取上清液進樣,進樣體積5 μL。
1.2.5方法學考察[12]
1.2.5.1特異性:分別用空白血漿經生物樣品預處理后進樣;阿莫西林和卡馬西平的對照溶液加入空白血漿中,經生物樣品預處理后進樣,確定兩者本色譜條件下的保留時間。
1.2.5.2線性:取空白血漿180 μL 8份,分別加入阿莫西林對照溶液20 μL,使其終濃度分別為0.10、0.25、0.50、2.50、5.00、25.03、50.05、100.11 μg/mL,再加入500 μL高氯酸溶液(0.5 mol/L)和10 μL卡馬西平內標工作液。按生物樣品預處理方法處理,取5 μL進樣,作液質分析。以藥物和內標的色譜峰面積比AVL/IS對血漿中藥物濃度C作標準曲線。
1.2.5.3靈敏度:阿莫西林的工作液稀釋成不同濃度,加入空白血漿中,按照生物樣品預處理方法處理后,進樣作質譜分析,找出最低檢測限。
1.2.5.4精密度:制備低、中、高3種濃度的含藥血漿,使其阿莫西林血漿濃度分別為0.25、25.03、80.09 μg/mL(n=5),加入內標工作液10 μL,按生物樣品預處理方法處理,進樣5 μL,作液質分析以測定該分析方法的日內精密度。使用同一方法分3 d測定3批樣品,計算該分析方法的日間精密度。
1.2.5.5提取回收率:制備低、中、高3種濃度的含藥血漿,使其阿莫西林血漿濃度分別為0.25、25.03、80.09 μg/mL(n=6),按上述方法作生物樣品處理,進樣5 μL,用液質測定阿莫西林的峰面積;將相同濃度的阿莫西林對照溶液直接進樣,測定其峰面積。以兩者的峰面積比計算回收率。
1.2.5.6基質效應:取200 μL空白血漿于1.5 mL離心管中,按上述方法作生物樣品處理。分別用處理后的上清液和水稀釋阿莫西林對照溶液,使兩者終濃度分別為0.25、25.03、80.09 μg/mL,進樣5 μL,用液質測定阿莫西林的峰面積。以上清液稀釋的阿莫西林的峰面積比上直接進樣等量阿莫西林對照品的峰面積作為基質效應。
1.2.5.7穩定性:直接將阿莫西林的對照儲備液進行質譜分析,測定其峰面積。之后放于冰箱中4℃冷藏24 h,取出進行質譜分析,測定其峰面積。考察阿莫西林儲備液在儲存過程中的穩定性。制備3批低、中、高3種濃度的含藥血漿,使其阿莫西林血漿濃度分別為0.25、25.03、80.09 μg/mL。將第一批直接按上述方法作生物樣品處理,進行液質分析,另一批重復凍融3次,處理后,進行液質分析;第三批置于-80℃冰箱中冷凍7 d,再進行樣品處理和液質分析,考察血漿中阿莫西林在凍存過程中的穩定性。另制備兩批低、中、高3種濃度的含藥血漿,使其阿莫西林血漿濃度分別為0.25、25.03、80.09 μg/mL。第一批在處理后0 h和24 h進行樣品分析,另一批在室溫放置6 h后進行樣品處理和液質分析,考察樣品在處理和進樣過程中的穩定性。
1.3數據處理采用Phoenix WinNonLin 6.4軟件對測定結果進行數據分析,求得藥動學參數并對相關的藥動參數進行統計分析。
2 結果
2.1特異性該方法血漿內源物質無干擾,阿莫西林和卡馬西平的保留時間為1.2 min和2.8 min,結果見圖1。
2.2線性與靈敏度標準曲線為AVL/IS=0.513 993× C+0.532 129,相關系數r=0.999 7,表明血藥濃度在0.10~100.11 μg/mL范圍內線性良好。最低檢測限(信噪比為3時)血藥濃度約為0.63 ng/mL。
2.3精密度低、中、高濃度的日內RSD分別為2.50%、4.46%和2.77%,日間RSD分別為5.14%、4.03%和4.63%。結果表明日內日間精密度均符合要求。
2.4提取回收率與基質效應低、中、高3種濃度的回收率分別為(69.18±2.86)%、(73.08±6.01)%、(69.84±6.26)%,基質效應分別為(64.87±0.80)%、(78.13±1.32)%、(68.58±2.68)%,結果表明回收率穩定,且無明顯的離子抑制。
2.5穩定性儲備液冷藏24 h前后峰面積比為101.10%;低、中、高3種濃度進樣室放置24 h前后濃度比為(102.76±3.54)%、(99.41±3.81)%和(99.33±2.07)%;血漿室溫放置6 h后峰面積比(91.62±2.34)%、(89.10±1.03)%和(96.75±2.70)%;凍融3次峰面積比(89.88±8.77)%、(93.56±4.34)%和(97.62±3.94)%;長期凍存7 d峰面積比(103.56± 6.47)%、(98.01±2.55)%和(97.87±3.46)%,結果表明在儲存及處理測定過程中樣品穩定。
2.6藥動學參數使用UPLC-MS/MS測定血藥濃度,并使用Phoenix WinNonLin 6.4軟件對測定結果進行數據分析,求得生物學參數。血藥濃度-時間曲線詳見圖2,生物學參數見表2。
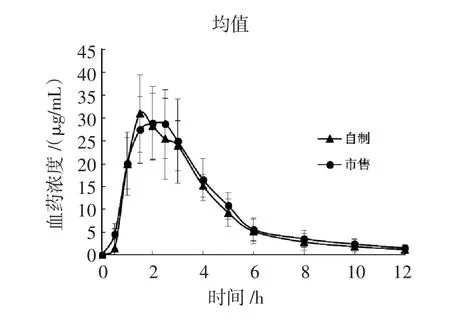
圖2 交叉給自制和市售阿莫西林脈沖片后比格犬血漿中阿莫西林的濃度隨時間的變化曲線圖(n=6)Fig 2 The concentration-time curves of amoxicillin in beagle dog plasm a after taking developed and comm ercial amoxicillin pulsatile-release tablets(n=6)
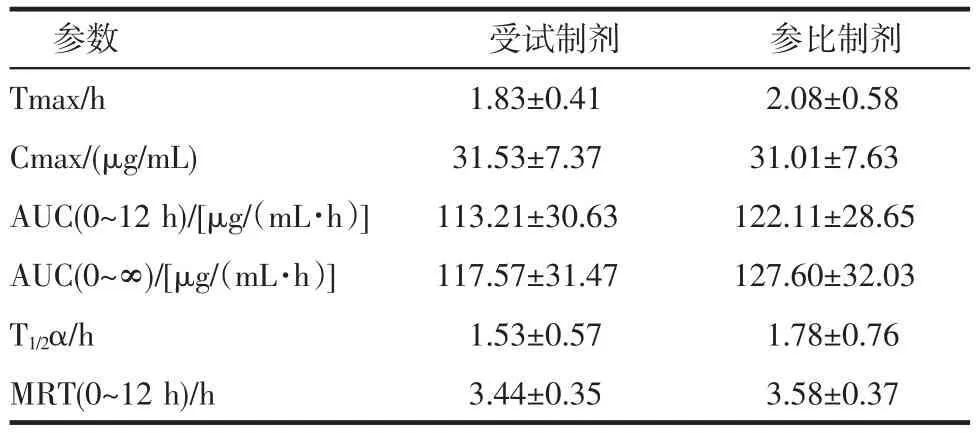
表2 比格犬交叉給藥后藥動學參數(n=6)Tab 2 The pharm acokinetic parameters
2.7生物等效分析單劑量給藥后自制和市售的阿莫西林脈沖片的LnAUC制劑間、周期間沒有差異,LnAUC的90%置信區間在82.53%~101.72%的范圍內,落在80%~125%的范圍內,表明自制和市售的阿莫西林脈沖片的AUC生物等效。兩者LnCmax的90%置信區間在89.08%~116.23%的范圍內,落在75%~133%的范圍內,制劑間、周期間沒有差異,表明自制和市售的阿莫西林脈沖片的Cmax生物等效。對兩者的Tmax進行秩和檢驗,結果P>0.05,無統計意義,表明自制和市售的阿莫西林脈沖片的Tmax生物等效。另外由單劑量試驗計算受試制劑的相對生物利用度為:F相對=[(AUC受試)/(AUC參比)]×100%=92.09±9.95%。兩者在比格犬體內生物等效。
3討論
本試驗采用一步沉淀法處理血漿樣品,樣品預處理時間短[13],先使用高氯酸進行血漿蛋白沉淀,之后用碳酸鉀中和酸性并沉淀高氯酸根,起到了保護色譜柱和提高回收率的作用[14-16]。除使用高氯酸沉淀外本次試驗還嘗試使用了甲醇、乙腈和甲醇乙腈等比例混合液作為沉淀劑[10],雖然也可使血漿中的蛋白沉淀,但處理后的樣品進樣后均會峰形異常甚至出現裂峰,猜測可能是因為阿莫西林極性較大,使用有機溶劑沉淀后上清液直接進樣可能會出現溶劑效應。
脈沖釋藥系統具有提高療效、降低毒副作用和晝夜節律性的特點[17-19]。本品采用的脈沖釋藥技術可在短時間內多次脈沖釋藥,快速殺傷細菌,減少細菌芽孢形成,增強了抗生素的抗菌效力,實驗證明該方法殺菌效果優于傳統治療方案[9,20],為其他抗生素的脈沖給藥提供了參考。
本次通過對受試制劑(自制)和參比制劑(市售)生物學參數的比較可知兩者在比格犬體內生物學等效,為進一步的臨床試驗提供了參考。
[1]劉小平,蘇登科,王雙云.西藥阿莫西林在臨床上的應用研究[J].齊齊哈爾醫學院學報,2013,34(3):385
[2]王艷秋.西藥阿莫西林的臨床應用探究[J].中國衛生產業,2012, 9(16):67
[3]高貴平.淺析西藥阿莫西林在臨床上的應用[J].中國實用醫藥,2010,5(24):150
[4]楊淑玲.阿莫西林的化學性質以及在臨床中的應用[J].中國傷殘醫學,2013,21(9):90
[5]王虹.阿莫西林的理化特性及臨床應用[J].中國民族民間醫藥,2012,21(14):60
[6]黃勝炎.最近上市的口服擇時控釋制劑[J].上海醫藥,2009,30(7):331
[7]王芳,鄭琴,伍振峰,等.應答式釋藥系統構建方法的研究進展[J].中國中藥雜志,2013,38(22):17
[8]孟建強,任麒,劉麗媛.時辰藥理學與多次脈沖給藥的應用[J].中國新藥與臨床雜志,2010,29(8):576
[9]Feder H M,Gerber M A,Randolph M F,et al.Once-daily therapy for streptococcal pharyngitis with amoxicillin[J].Pediatrics,1999,103(1):47
[10]林楠.LC/MS/MS法測定血漿中氨溴索、克侖特羅和阿莫西林[D].沈陽藥科大學:2007
[11]陳蘇寧,文愛東,丁莉坤,等.LC-MS/MS同時測定人血漿中阿莫西林-氨溴索濃度及其藥動學研究[J].中國藥學雜志,2009,44(14):1092
[12]國家藥典委員會.中華人民共和國藥典:2010年版二部[S].北京:中國醫藥科技出版社,附錄XIX B:2010:195-199
[13]袁文博,丁永娟,徐靜靜.直接蛋白沉淀-超高效液相色譜法測定氟尿嘧啶血藥濃度[J].中國藥科大學學報,2015,46(1):81
[14]賈萌萌,李杰,丁何曉夢,等.液相-質譜聯用法同時測定人血漿中阿莫西林及克拉維酸鉀的濃度[J].中國醫院藥學雜志,2014,34(9):715
[15]Matsui Y J,Nakamura S,Kondou N,et al.Liquid chromatographyelectrospray ionization-tandem mass spectrometry for simultaneous analysis of chlorogenic acids and their metabolites in human plasma[J]. Chromatography B,2007,858(1/2):96
[16]孫麗榮,嚴華成,曹雄,等.不同血漿樣品制備方法對芍藥苷血液藥物濃度測定的影響[J].中國藥物與臨床,2008,8(11):846
[17]馮航,李迎,梅興國.脈沖釋藥微丸的研究進展[J].國際藥學研究雜志.2015,42(4):483
[18]Kumar S,Siddiqua A,Thanusha G,et al.Comprehensive review on pulsatile drug delivery system[J].JDDT,2013,1(4):15
[19]Patil N D,Bari M M,Barhate S D.A review on novel approach pulsatile drug delivery system[J].IJPSRR,2013,21(1):209
[20]Saigal N,Baboota S,Ahuja A,et al.Multiple-pulse drug delivery systems:setting a new paradigm for infectious disease therapy[J]. Expert Opin Drug Deliv,2009,6(4):441
(2016-01-07收稿)
Study on pharmacokinetics and bioequivalence of amoxicillin pulsatile-release tablets by UPLC-MS/MS in beagle dogs
QIN Lu,PI Jia-xin,QI Dong-li,ZHANG Qian,HUANG Rui,HAN Run-ping,LIU Zhi-dong
(Tianjin Modern Chinese Medicine Key Laboratory-Province and Ministry Co-established State Key Laboratory Cultivation Base,Engineering Research Center of Modern Chinese Medicine Discovery and Preparation Technique,Ministry of Education,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
Objective:To establish a UPLC-MS/MS method for determination of amoxicillin pulsatile-release tablets in dog plasma,and evaluate the pharmacokinetics and bioequivalence of amoxicillin pulsatile-release tablets after single oral dose administration.Methods:Carbamazepine was used as an internal standard,and the protein of plasma samples were precipitated by perchloric acid.According to randomized two-period self crossover study,six dogs were given single oral doses of the test preparation and reference preparation,then the concentration of amoxicillin in plasma were determined,and the pharmacokinetic parameters were calculated and the bioequivalence of the two preparations were evaluated.Results:The pharmacokinetics of developed amoxicillin pulsatile-release tablets were as follows:Ke(0.50±0.16)h-1,t1/2(1.53±0.57)h,AUC0-12h(113.21±30.63)μg/(mL·h),Cmax(31.53±7.37)μg/mL,Tmax(1.83±0.41)h;the pharmacokinetics of commercial amoxicillin pulsatile-release tablets were as follows:Ke(0.44±0.16)h-1,t1/2(1.78±0.76)h,AUC0-12h(122.11±28.65)μg/(mL·h),Cmax(31.01±7.63)μg/mL,Tmax(2.08±0.58)h.The relative bioavailability of the test tablet was(92.09±9.95)%.Conclusion:The developed amoxicillin pulsatile-release tablets may be bioequivalent to the commercial amoxicillin pulsatile-release tablets.
amoxicillin;pulsatile-release tablets;bioequivalent;beagle dogs
R9
A
1006-8147(2016)05-0448-04
秦璐(1990-),男,碩士在讀, 研究方向:藥物制劑;通信作者:劉志東,E- mail: lonerliuzd@163.com。

