1-磷酸鞘氨醇促進胰島素分泌及可能機制研究
趙艷麗, 丁亞琴, 王 慧, 章 毅, 楊 靜, 劉云峰
(山西醫科大學 1. 第一臨床醫學院、2.藥理學教研室、3.第一醫院內分泌科,山西 太原 030001)
?
1-磷酸鞘氨醇促進胰島素分泌及可能機制研究
趙艷麗1,3, 丁亞琴2, 王 慧2, 章 毅2, 楊 靜1,3, 劉云峰1,3
(山西醫科大學 1. 第一臨床醫學院、2.藥理學教研室、3.第一醫院內分泌科,山西 太原 030001)
目的 研究1-磷酸鞘氨醇(sphingosine-1-phosphate, S1P)促進葡萄糖刺激的胰島素分泌效應及其分子機制,探索糖尿病治療藥物的作用靶點。方法 使用膠原酶P消化SD大鼠胰腺,Histopaque 1077梯度離心獲得胰島,Dispase II消化得到胰島細胞。不同濃度S1P(0~20 μmol·L-1)干預,觀察低糖(2.8 mmol·L-1)和高糖(16.7 mmol·L-1)條件下胰島素分泌的變化。膜片鉗技術記錄β細胞電壓依賴性鉀通道電流(Kv電流),觀察S1P干預后Kv電流的變化。鈣成像技術記錄β細胞內Ca2+濃度,觀察不同濃度S1P(0~20 μmol·L-1)干預后細胞內的Ca2+濃度變化。結果 與低糖組相比,高糖組明顯刺激了胰島素的分泌(P<0.01)。低糖條件下,S1P沒有改變胰島素分泌量(P>0.05)。高糖條件下,S1P濃度依賴性增加了胰島素分泌量(P<0.01)。與對照組相比,S1P明顯抑制了β細胞Kv電流(P<0.01)。高糖條件下,S1P濃度依賴性升高了胰島細胞內Ca2+濃度(P<0.01)。結論 S1P可能通過抑制β細胞Kv電流、升高細胞內Ca2+濃度,最終促進葡萄糖刺激的胰島素分泌。
1-磷酸鞘氨醇;Ca2+;胰島素分泌;電壓依賴性鉀通道;SD大鼠;β細胞
國際糖尿病聯盟調查顯示,截至2013年,全球約有4億糖尿病患者,預計2040年將達到6.42億,而糖尿病每年的死亡人數已經高達500萬[1]。可見糖尿病已經嚴重威脅到全球公民的健康。糖尿病常常伴有血糖的升高,而胰島素的分泌增加是對血糖升高的直接反應,同時,血液中其他營養物質也可以增加葡萄糖刺激的胰島素分泌,例如氨基酸、脂肪酸等[2]。當血液中葡萄糖濃度升高時,三羧酸循環活動加強,ATP生成增多,ATP/ADP比值升高,ATP敏感性鉀通道(KATP)關閉,進而細胞膜去極化,電壓依賴性鈣通道開放,鈣內流導致細胞Ca2+濃度增加,促進胰島素囊泡的胞吐作用[3-4]。研究證實[5],1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)可以刺激葡萄糖依賴性的胰島素分泌(glucose-stimulated insulin secretion,GSIS),但其作用機制目前并不清楚。本研究通過分離SD大鼠胰島和細胞,驗證S1P是否通過抑制Kv電流和升高細胞內Ca2+濃度,從而促進葡萄糖刺激的胰島素分泌。
1 材料與方法
1.1 材料
1.1.1 實驗動物 8~10周齡的♂ SD大鼠,體質量250 g~280 g,由山西醫科大學實驗動物中心提供。生產許可證號:SCXK(晉)2015-0001。
1.1.2 試劑 S1P(美國Cayman,批號:0467600-11);膠原酶P(瑞士Roche,批號:11104222); D-葡萄糖(北京索萊寶,批號:405A0918);BSA(北京索萊寶,批號:831O0513);HEPES(北京索萊寶,批號:710B048);青鏈霉素(北京索萊寶,批號:20150909);Histopaque 1077(美國Sigma,批號:RNBF1783);胎牛血清(上海生工,批號:B326FA0092);RPMI 1640培養基(上海生工,批號:C518FA0002);Dispase II(美國Amresco,批號:10888700);胰島素檢測試劑盒(北京北方生物技術研究所,批號:20160320)。
1.1.3 儀器 電子天平(上海精密,型號:GB/T26497);體式顯微鏡(上海中恒,型號:SM262);倒置顯微鏡(日本OLYMPUS,型號:AE-2000);臺式離心機(長沙湘儀,型號:SC-3610);細胞培養箱(北京博奧恒信生物科技,型號:HF100);MODEL電極拉制儀(日本Narishige,型號:PP-830);MIRO FORGE拋光儀(日本Narishige,型號:MF-200);EPC10全自動膜片鉗(德國HEKA,型號:MP-285);鈣成像(北京MDE,型號:LAMBDA 10-B)。
1.2 方法
1.2.1 胰島及細胞的分離和培養 ① 使用斷頭法處死大鼠,1 g·L-1膠原酶P溶液(不含血清的RPMI 1640培養基溶解)消化胰腺,37℃水浴消化、Histopaque 1077梯度離心后,在體顯微鏡下手工挑取胰島,將挑好的胰島加入培養液后,放入37℃恒溫孵箱中培養[3]。② 5 g·L-1Dispase II溶液(PBS溶解)消化狀態良好的胰島為單個細胞,離心后,均勻滴在預先滴過細胞黏附劑的玻片上,加入培養液后,放至37℃恒溫孵箱中培養[3]。
1.2.2 胰島素分泌實驗 KRBH緩沖液成分(mmol·L-1):644.0 NaCl、24.0 KCl、6.0 KH2PO4、6.0 MgSO4、12.5 CaCl2·2H2O、50 HEPES,此外,每100 mL KRBH緩沖液中再加入0.042 g NaHCO3、2 g BSA。酸乙醇成分(mL·100mL-1):75無水乙醇、23.5蒸餾水、1.5濃鹽酸。實驗共4組,每組7個管,每管挑入大小均一,狀態良好的5個胰島。① 每組在低糖(2.8 mmol·L-1,LG)KRBH孵育液中孵育1 h,棄上清。② 分別在含S1P 0、5、10、20 μmol·L-1的低糖KRBH孵育液中孵育30 min,收集上清液待測。③ 分別在含S1P 0、5、10、20 μmol·L-1的高糖(16.7 mmol·L-1,HG)KRBH孵育液中孵育30 min,收集上清液待測。④ 每管加入500 μL的酸乙醇,超聲粉碎儀粉碎胰島組織,稀釋80 000倍后留取待測。待測樣本均使用放射免疫方法測胰島素含量。
1.2.3 膜片鉗技術記錄Kv電流 細胞外液成分(mmol·L-1):141.9 NaCl、5.6 KCl、1.2 MgCl2、5.0 HEPES、11.1葡萄糖,pH=7.40。細胞內液成分(mmol·L-1):140.0 KCl、1.0 MgCl2、0.05 EGTA、10.0 NaCl和10.0 HEPES ,pH=7.30。① 細胞膜電容>7pF的為β細胞,在-70 mV的鉗制電壓下給予-70~80 mV電壓刺激400 ms,每次遞增10 mV,檢測Kv電流。② 細胞外液中加入S1P(10 μmol·L-1),方法同上,觀察Kv電流變化情況。
1.2.4 鈣成像技術檢測細胞內Ca2+濃度 使用含有2 μmol·L-1Fura-2AM的低糖(2.8 mmol·L-1)染液孵育胰島細胞后,置于高糖(16.7 mmol·L-1)溶液中,在510 nm發射波長、380 nm和340 nm激發波長下,可得到F340/F380的比值。在高糖條件下,觀察不同濃度S1P(0、5、10、20 μmol·L-1)干預前后的F340/F380的變化。
2 結果
2.1 分離的SD大鼠胰島及細胞 如Fig 1所示,分離的大鼠胰島質地均一,狀態良好,邊緣圓潤,胰島細胞狀態良好,包膜完整。

Fig 1 Rat pancreatic islets and cells
A:Isolated rat pancreatic islets digested by collagenase P(×10); B: Isolated rat pancreatic islet cells digested by Dispase II(×40)
2.2 S1P干預對GSIS的影響 每組7個管(每管5個胰島),在低糖和高糖下,不同濃度S1P(0、5、10、20 μmol·L-1)干預,觀察胰島素分泌的變化,所測胰島素以2.8 mmol·L-1葡萄糖為標準,標化后結果見Tab 1。與低糖比較,高糖明顯刺激了胰島素分泌(P<0.01)。低糖條件下,S1P干預后,胰島素含量沒有明顯變化(P>0.05)。高糖條件下,S1P濃度依賴性刺激了胰島素的分泌(P<0.01)。
2.3 S1P干預的Kv電流變化 在-70 mV的鉗制電壓下給予-70~80 mV電壓刺激400 ms,每次遞增10 mV,檢測Kv電流。與對照組相比,S1P(10 μmol·L-1)明顯抑制了Kv電流[對照組(110.714 6±4.811 3) pA/pF,n=8;S1P組(68.094 3±2.927 1) pA/pF,n=8;P<0.01](Fig 2)。
2.4 S1P干預的細胞內Ca2+變化 使用含2 μmol·L-1Fura-2 AM低糖染液孵育細胞后,置于高糖溶液中,在510 nm發射波長、380 nm和340 nm激發光下,測得F340/F380。不同濃度S1P(0、5、10、20 μmol·L-1)干預,可以看到S1P濃度依賴性增加了細胞內Ca2+濃度,以S1P(0 μmol·L-1)為標準標化,結果如下: 0 μmol·L-1,1.000 0±0.039 3,n=5;5 μmol·L-1, 1.152 8±0.049 3,n=5;10 μmol·L-1, 1.382 8±0.063 4,n=5;20 μmol·L-1, 1.718 8±0.031 2,n=5。見Fig 3。
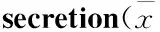
Tab 1 S1P promotes glucose-stimulated insulin ±s,n=7)
LG: low glucose(2.8 mmol·L-1) , HG: high glucose (16.7 mmol·L-1).##P<0.01vsLG group(S1P 0 μmol·L-1);*P<0.05,**P<0.01vsHG group(S1P 0 μmol·L-1)
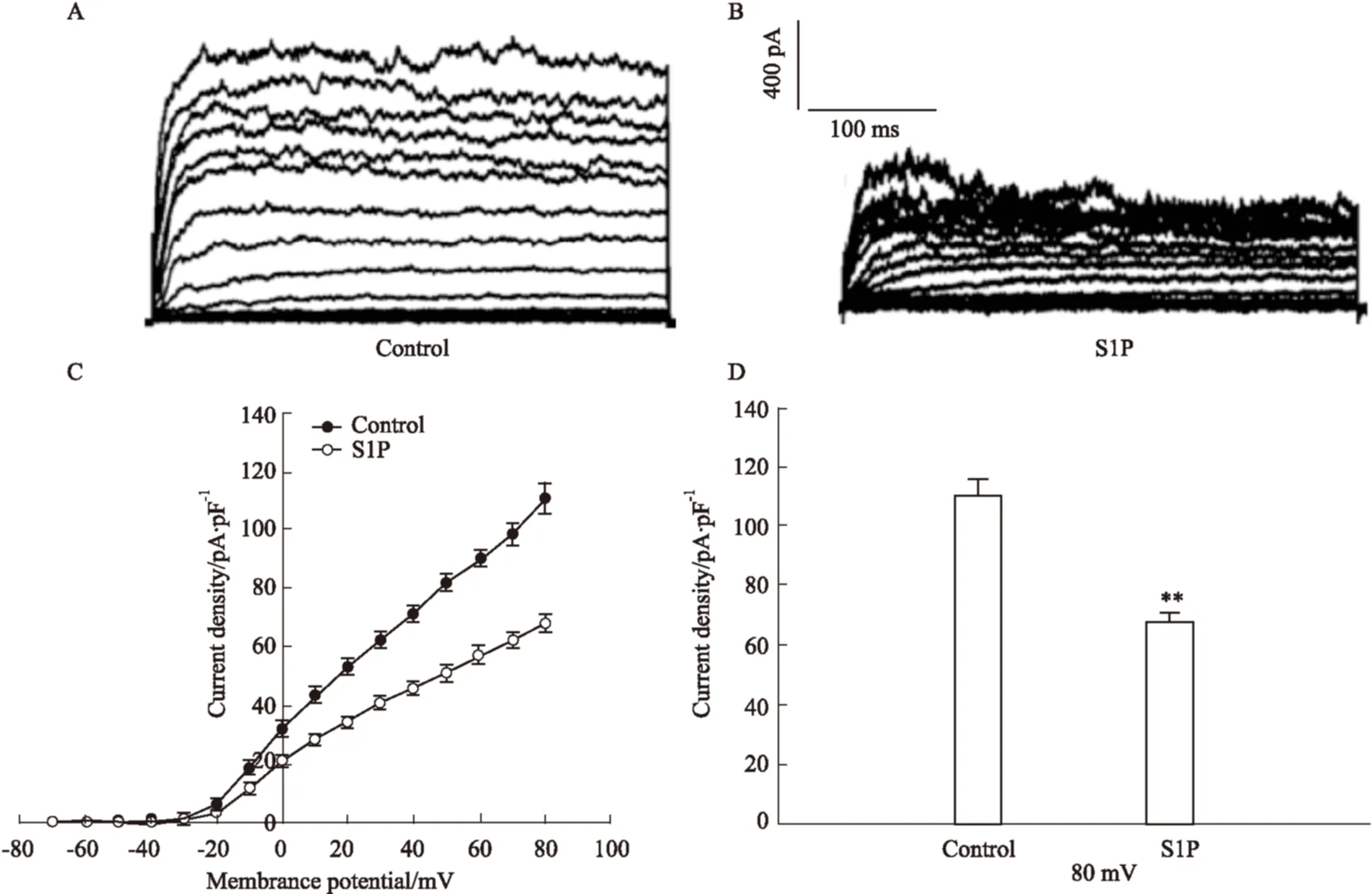
Fig 2 S1P inhibits Kv currents of pancreatic beta cells
A,B:Representive current traces recorded under control and S1P treatment conditions from rat beta cells; C: Current-voltage curves of Kv channels under control and S1P treatments conditions; D: Summary of the mean current density of Kv channels recorded at 80 mV depolarization.**P<0.01vscontrol group.
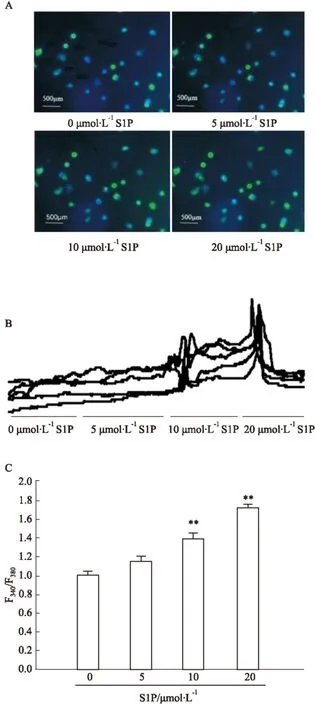
Fig 3 S1P increases the level of intracellular
A: The changes of fluorescence intensity after S1P treatments from beta cells; B: Traces show the changes of intracellular Ca2+level after S1P treatments under high glucose condition; C: The ratio of fluorescence intensity (F340/F380) after S1P treatments, five cells were tested.**P<0.01vscontrol.
3 討論
糖尿病的發病率逐年上升,已成為繼心腦血管疾病、腫瘤之后第3位嚴重危害人民健康的重要慢性非傳染性疾病[6]。1型糖尿病發病機制主要是胰島素絕對缺乏,2型糖尿病則主要是胰島素抵抗伴有胰島素分泌不足,但兩者共同的核心病理環節都是β細胞功能的衰退[7]。鞘脂類代謝產物S1P是一種有活性的脂質分子,在細胞內外均發揮重要作用,已經證實,在腫瘤、心血管疾病、骨代謝及糖尿病方面均有明顯作用[8-10]。本實驗中,與低糖相比,高糖明顯刺激了胰島素分泌。S1P干預后,低糖條件下并沒有影響胰島素分泌,而在高糖條件下,濃度依賴性促進了胰島素分泌。在Hasan等[11]研究中發現,S1P可以促進β細胞的生存和生長,抑制其凋亡,促進GSIS。在研究中發現,高糖可以激活鞘氨醇激酶2(SphK2),增加S1P的生成,促進GSIS[5]。本實驗中,在高糖條件下,S1P明顯抑制了β細胞的Kv電流,減少鉀外流。研究已經證明Kv通道參與動作電位的形成,抑制Kv電流可以延長動作電位時程、升高細胞內鈣濃度,從而促進胰島素分泌[3]。細胞內的S1P可以調節鈣動員,升高細胞內的Ca2+水平,促進β細胞生長,抑制其凋亡[11-12]。本實驗證實高糖條件下,S1P干預后,濃度依賴性增加了細胞內的Ca2+水平,而Ca2+作為細胞內的第二信使,可以調節眾多過程,其中包括增加胰島素分泌。我們推測,S1P可能通過抑制Kv電流,延遲了動作電位時程,進而增加鈣離子內流,導致細胞內鈣增加,從而促進了胰島素分泌。
綜上,本實驗通過分離和培養SD大鼠原代胰島、細胞,證實了S1P可能通過抑制細胞Kv電流、升高胰島細胞內Ca2+濃度,最終促進了葡萄糖刺激的胰島素分泌。此結果對于胰島素促泌劑的研發提供了實驗依據,為糖尿病的治療提供了新的治療方向。但關于S1P促進葡萄糖刺激的胰島素分泌的下游信號通路仍待進一步研究。
(致謝:本文實驗在山西醫科大學藥理教研室章毅老師實驗室完成,在此對參與實驗的人員表示感謝。)
[1] Felton A M, Lasalle J, Mcgill M. Treatment urgency: the importance of getting people with type 2 diabetes to target promptly[J].DiabetesResClinPract,2016,16(4):1-26.
[2] Fu Z, Gilbert E R, Liu D. Regulation of insulin synthesis and secretion and pancreatic beta-cell dysfunction in diabetes[J].CurrDiabetesRev,2013, 9(1): 25-53.
[3] Zhang Y, Guo Q, Li X. P2Y purinergic receptor-regulated insulin secretion is mediated by a cAMP/Epac/Kv channel pathway[J].BiochemBiophysResCommun, 2015, 460(3): 850-6.
[4] Rocheleau J V, Walker G M, Head W S. Microfluidic glucose stimulation reveals limited coordination of intracellular Ca2+activity oscillations in pancreatic islets[J].ProcNatlAcadSci, 2004, 101(35): 12899-903.
[5] Cantrell S J, Morris A J, Sunkara M. Sphingosine 1-phosphate (S1P) regulates glucose-stimulated insulin secretion in pancreatic beta cells[J].JBiolChem, 2012, 287(16): 13457-64.
[6] 中華醫學會糖尿病學分會. 中國2型糖尿病防治指南(2013年版)[J]. 中國糖尿病雜志,2014,22(8): 2-42.
[6] Diabetes Association of the Chinese Medical Association. Guidelines for the prevention and treatment of type 2 diabetes mellitus in China (2013 Edition)[J].ChinJDiabetes, 2014, 22(8):2-42.
[7] Imasawa T, Koike K, Ishii I. Blockade of sphingosine 1-phosphate receptor 2 signaling attenuates streptozotocin-induced apoptosis of pancreatic beta-cells[J].BiochemBiophysResCommun, 2010, 392(2): 207-11.
[8] Maceyka M, Harikumar K B, Milstien S. Sphingosine-1-phosphate signaling and its role in disease[J].TrendsCellBiol, 2012, 22(1): 50-60.
[9] Brinkmann V. Sphingosine 1-phosphate receptors in health and disease: mechanistic insights from gene deletion studies and reverse pharmacology[J].PharmacolTher, 2007, 115(1): 84-105.
[10] 賀 苗,趙 杰,蘇 健. 1-磷酸鞘氨醇后適應對大鼠心肌缺血/再灌注損傷的保護作用[J]. 中國藥理學通報, 2013, 29(10):1369-73.
[10] He M, Zhao J, Su J. Protective effect of sphingosine 1-phosphate postconditioning on myocardial ischemia /reperfusion injury in rats[J].ChinPharmacolBull,2013,29( 10):1369-73.
[11] Hasan N M, Longacre M J, Stoker S W. Sphingosine kinase 1 knockdown reduces insulin synthesis and secretion in a rat insulinoma cell line[J].ArchBiochemBiophys, 2012, 518(1): 23-30.
[12] Laychock S G, Sessanna S M, Lin M H. Sphingosine 1-phosphate affects cytokine-induced apoptosis in rat pancreatic islet beta-cells[J].Endocrinology, 2006, 147(10): 4705-12.
Effects and possible mechanism of sphingosine-1-phosphate-stimulated insulin secretion from rat islets
ZHAO Yan-li1,3, DING Ya-qin2, WANG Hui2, ZHANG Yi2, YANG Jing1,3, LIU Yun-feng1,3
(1.theFirstClinicalMedicalCollege, 2.DeptofPharmacology, 3.DeptofEndocrinologyoftheFirstHospital,ShanxiMedicalUniversity,Taiyuan030001,China)
Aim To observe the effects of glucose-stimulated insulin secretion (GSIS) on rat islets after S1P treatments and the underlying molecular mechanisms. Methods Collagenase P and Histopaque 1077 were used to digest and isolate rat pancreatic islets, and Dispase II was used to digest pancreatic islet to obtain pancreatic cells. Insulin secretions were measured after S1P (0~20 μmol·L-1) treatment under low glucose (LG, 2.8 mmol·L-1) and high glucose (HG, 16.7 mmol·L-1) conditions. Patch-clamp recordings were applied to monitor voltage-dependent potassium channel currents (Kv currents) after S1P treatment. Calcium image technique was used to measure the changes of intracellular Ca2+concentration after S1P (0~20 μmol·L-1) treatments. Results HG group significantly increased insulin secretion compared to LG group (P<0.01) . S1P had no effect on insulin secretion under LG condition (P>0.05). S1P increased insulin secretion significantly in a dose-dependent manner under HG condition (P<0.01) . Kv currents of β cells were inhibited significantly after S1P treatment (P<0.01) . S1P increased the concentrations of intracellular Ca2+in a dose-dependent manner under HG condition(P<0.01) . Conclusion S1P may promote GSIS by inhibiting Kv currents and increasing the level of intracellular Ca2+.
sphingosine-1-phosphate; Ca2+; insulin secretion; voltage-dependent potassium channels; SD rat; β cell
2016-06-17,
2016-07-27
國家自然科學基金資助項目(No 81273564,81373464);山西省自然科學基金資助項目(No 201401143);山西省回國留學人員科研資助項目(No 2013-111);中華醫學會臨床醫學科研專項資金項目(No 13040440429);山西醫科大學第一醫院青年創新基金資助項目(No YC1422);山西省留學回國人員科技活動項目擇優資助項目(No 2016-97)
趙艷麗(1990-),女,碩士生,醫師,研究方向:糖尿病的治療及發病機制,E-mail:zhaoyanli995@163.com;
劉云峰(1973-),女,博士,副主任醫師,碩士生導師,研究方向:糖尿病的治療及發病機制,通訊作者,E-mail:nectarliu@163.com
時間:2016-10-20 10:29
http://www.cnki.net/kcms/detail/34.1086.R.20161020.1029.016.html
10.3969/j.issn.1001-1978.2016.11.008
A
1001-1978(2016)11-1516-05
R-332;R329.24;R335.6;R587.105;R977.15

