慢性心力衰竭大鼠肝臟組織的代謝輪廓
巫 菲, 李 彤,張 磊,董志歡,米 睿
(1.天津醫科大學三中心臨床學院 300170;2.天津市第三中心醫院; 3.天津市人工細胞重點實驗室)
?
慢性心力衰竭大鼠肝臟組織的代謝輪廓
巫 菲1, 李 彤2,3,張 磊2,董志歡1,米 睿2
(1.天津醫科大學三中心臨床學院 300170;2.天津市第三中心醫院; 3.天津市人工細胞重點實驗室)
目的 建立慢性心力衰竭大鼠肝臟組織代謝輪廓模型,從代謝角度探索慢性心衰肝臟代謝變化規律,探尋對心力衰竭分子機制及疾病診療具有價值的特征代謝物。方法 Wistar雄性大鼠20只,心衰組行腹主動脈縮窄手術,對照組行假手術, 術后飼養24周。利用代謝組學研究平臺對大鼠肝臟組織進行代謝輪廓分析,建立心衰大鼠肝臟組織正交偏最小二乘判別模型及主成分分析模型,結合 SPSS 19.0軟件的數據處理最終得到特征代謝物。結果 成功建立了主成分分析模型及正交偏最小二乘判別模型,同時從模型中篩選并鑒定了10種在心衰組與對照組具有差異的特征代謝物,包括溶血磷脂酰膽堿、 溶血磷脂酰乙醇胺,油酸,甘氨膽酸,硫酸脫氫表雄酮等物質。結論 構建的代謝輪廓模型很好地擬合慢性心衰大鼠肝臟的代謝紊亂狀態,篩選出的特征代謝物可為該疾病的病理生理分子機制以及該疾病診療等提供參考和幫助。
心力衰竭;色譜法;高壓液相;質譜分析法;代謝組學;大鼠
慢性心力衰竭(chronic heart failure, CHF)是高血壓和冠心病等多種心血管疾病進行性發展的終末階段。肝臟是機體代謝的樞紐,參與了合成、分解、轉化和排泄等代謝過程,心力衰竭可以導致不可逆的肝臟損傷和肝硬化,反之,肝損傷會加劇心衰患者預后不良,給患者及社會造成較大的負擔。因此了解心力衰竭狀態下肝組織代謝變化有重要意義。代謝組學是一種研究生物體狀態改變后內源性小分子物質變化情況的新技術,可揭示生物體在內外因素的刺激后整個代謝網絡的變化規律,得出和病理狀態、疾病進程相關的系統生物學結果[1]。本研究利用代謝組學的研究平臺構建疾病區分模型,篩選慢性心力衰竭狀態下肝臟組織特征代謝產物,初步探討心衰狀態下肝組織代謝變化,為該疾病病理生理分子學機制以及該疾病診療等提供參考和幫助。
1 材料和方法
1.1 材料
正常雄性Wistar大鼠20只,SPF級,體質量225~250 g,購自北京維通利華實驗動物有限公司【SCXK( 京)2012-0001】。Accela超高效液相色譜儀、低溫高速離心機Multifoge X1R 型、LTQ Orbitrap XL質譜儀(美國Thermo公司);Vevo2100 view高分辨率小動物超聲系統(英國Sonic公司);甲酸、乙腈、甲醇購自德國Merck KGaA公司。實驗相關操作在天津醫科大學動物實驗設施內進行【SYXK( 津)2009-0001】。
1.2 方法
1.2.1 分組: 將大鼠按隨機數字表法分為心力衰竭組(CHF組)、對照組(SHAM組)。
1.2.2 模型制備: 3%戊巴比妥鈉(0.05 g/kg)溶液行腹腔注射麻醉。手術區域備皮、消毒,腹正中暴露腹腔探查,游離腹主動脈,穿過3-0絲線,進行缺血預適應,將腹主動脈縮窄于平頭綠色注射器針頭(21G,d=0.6 mm)上,后撤出針頭并確認縮窄效果良好,逐層關閉腹腔。消毒、排氣并注射20萬單位青霉素預防腹腔感染。術后合理飼養24周,行心動超聲檢測。Sham組:經相同手術操作程序,腹主動脈穿線缺血預適應后不結扎,飼養同CHF組。
1.2.3 標本的采集和預處理: 大鼠脫頸處死后,摘取肝臟組織,迅速液氮冷凍后置于-80℃超低溫冰箱保存。取出組織稱重,以1∶3加入純水充分研磨,超聲震蕩器混勻,10 000 r/min離心15 min,取上清液100 μL,再加入300 μL甲醇,充分震蕩搖勻,10 000 r/min 離心10 min,取上清液100 μL真空離心蒸干得干粉后加300 μL乙腈重新溶解, 上樣。
1.2.4 樣本分析: 液相色譜為Thermo公司的Accela超高效液相色譜系統。色譜柱為Thermo Hypersil GOLD反相C18柱(2.1 mm i.d.x 50 mm.1.9 μm)。流動相A為0.1%甲酸水溶液,流動相B為0.1%甲酸乙腈溶液,色譜洗脫過程為15 min,進樣量為10 μL,流速設定在200 μL/min。洗脫梯度起始為5%B并維持3 min,然后10 min內B線性增加至50%,再往后3 min內B增加至95%,并維持4 min,然后降回5%,平衡色譜柱4 min,進樣量為10 μL。自動進樣器內溫度保持在4℃。質譜釆用正離子模式進行檢測,采用棒狀(centroid)模式掃描,掃描質荷比區間為50~1000 (m/z)。二級質譜采用選擇離子檢測(SIM)模式,碰撞能量為35(標準化碰撞能量)。分辨率為l00000 (FMHW)。毛細管電壓30 V,錐孔電壓150 V,離子源電壓4.5 kV,鞘氣流速為30 arb,輔氣流速5 arb。使用廠家提供校正液進行質量校正。
1.2.5 數據處理: 根據篩選出的變量重新設定儀器參數,對質控溶液進行MS/MS掃描,獲得這些代謝物的二級質譜圖;利用精確質量數(m/z)和 MS/MS 圖譜搜索 Mass Frontier 6.0 自帶數據,Medlin數據庫,KEGG數據庫以及HMDB數據庫,經過結構推導得出初步結果;通過與標準品的MS/MS質譜圖對比得到鑒定。
1.2.6 統計學方法: 經SPSS 19.0統計軟件對實驗數據進行兩個獨立樣本的非參數檢驗分析,以P<0.05 為差異有統計學意義。
2 結果
2.1 心臟超聲結果
CHF組可見射血分數(EF)、縮短分數(FS)、收縮期末左室后壁厚度(LVPW)、收縮期室間隔厚度(IVS)、主動脈平均流速(Mean Vel),主動脈峰值流速(Peak Vel)明顯降低(表1)

Tab.1 Cardiac echocardiography of the rats
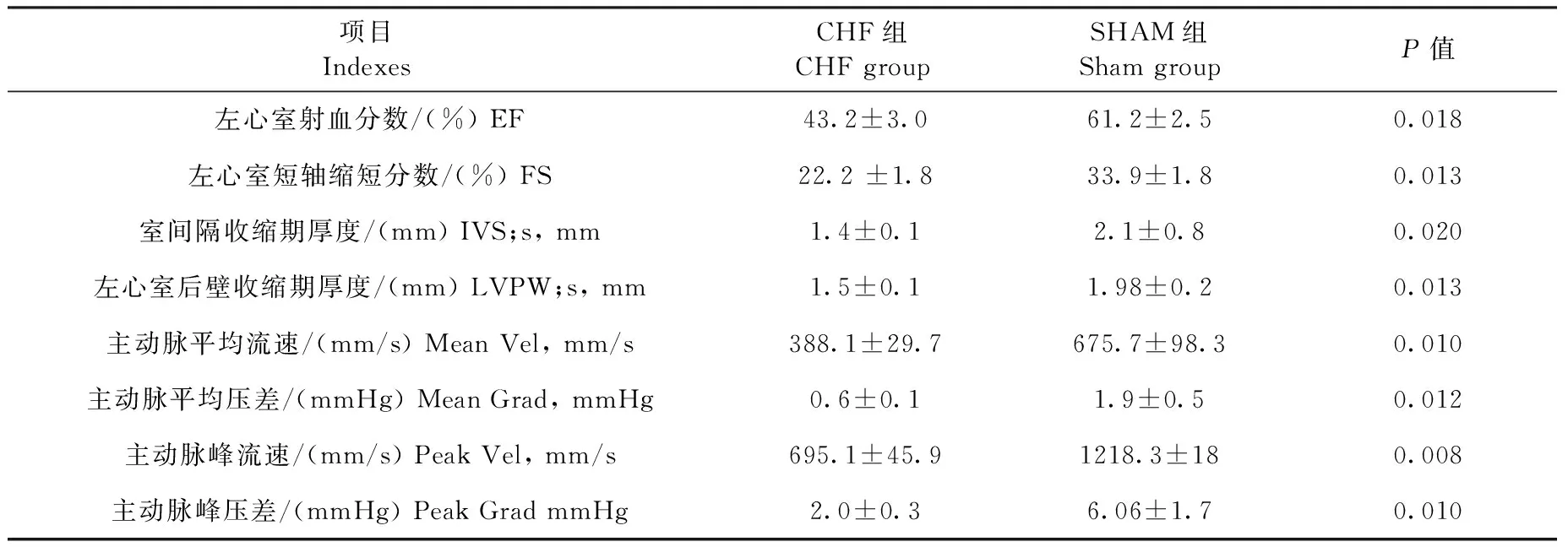
項目IndexesCHF組CHFgroupSHAM組ShamgroupP值左心室射血分數/(%)EF43.2±3.061.2±2.50.018左心室短軸縮短分數/(%)FS22.2±1.833.9±1.80.013室間隔收縮期厚度/(mm)IVS;s,mm1.4±0.12.1±0.80.020左心室后壁收縮期厚度/(mm)LVPW;s,mm1.5±0.11.98±0.20.013主動脈平均流速/(mm/s)MeanVel,mm/s388.1±29.7675.7±98.30.010主動脈平均壓差/(mmHg)MeanGrad,mmHg0.6±0.11.9±0.50.012主動脈峰流速/(mm/s)PeakVel,mm/s695.1±45.91218.3±180.008主動脈峰壓差/(mmHg)PeakGradmmHg2.0±0.36.06±1.70.010
2.2 病理學檢查
同倍數下觀察CHF組可見肝組織的病理嚴重程度與心衰模型構建的時間呈正相關,鏡下主要表現為肝臟淤血性損害。可見肝血竇增寬,細胞出現輕度腫脹,細胞核出現深染、核固縮改變,提示可能發生了肝細胞凋亡;肝臟病理改變加重,靜脈系統內淤血明顯,肝細胞出現大面積壞死,尤其以中央靜脈周圍多見,局部仍還有散在的形態正常的細胞團。肝細胞本身出現核固縮、核碎裂、核溶解改變,并存在不同程度的脂肪變,沒有出現明顯的肝硬化征象,無明顯的結締組織增生和假小葉形成。(圖1)
2.3 數據的總離子流圖和質控分析
以正常和心衰肝臟樣本為依托,結合超高效液相色譜與質譜連用系統平臺成功得到標本的總離子流圖(圖2)。通過質控溶液在整個樣品分析過程中的檢測分析評價UPLC-MS系統的工作穩定性,對15個質控溶液數據進行主成分分析(PCA)后,得到一個擁有2個成分的PCA模型,系統在樣品分析過程中相對平穩,整個質控沒有出現界外值。且根據相關文獻提出的有關UPLC-MS平臺重復性的質控合格標準本研究15個質控液穿插于樣品分析過程中,可靠離子峰分布在85.6%到94.8%之間。因此,可以認為該批次樣本分析結果可靠。
2.4 代謝輪廓對疾病的區分能力
Simca分析軟件將數據轉換成UV格式和平均中心化模式,獲得更直觀的圖像結果。Simca軟件進行PCA分析共獲得四個主成分,R2X=42.1%,Q2=22.4%。當R2X值大于40%就可以認為該模型可靠,因此當前PCA模型可用于顯示兩組之間的代謝差異(圖3A)。同時構建正交偏最小二乘判別分析(OPLS-DA)模型分析,該模型有一個預測主成分,三個正交主成分,R2X=68.5%,R2Y=99.3%,Q2=96.1%),由此可見此模型具有很好的擬合度和預測能力。模型組樣本數據構建的 OPLS-DA模型在第一預測主成份與第一正交主成份上的打分圖(圖3B)。全部的驗證組標本均能夠正確的歸入相應分組聚類,模型的預測準確度達100%。

圖1 光鏡下肝臟病理改變。A:正常肝臟;B:心衰肝臟(標尺=100 μm)Fig.1 Pathological changes of the liver tissues. A: Liver of the sham group; B: Liver of the CHF group.

圖2 總離子流圖Fig.2 Total ion chromatogram of serum metabolic profile

A: PCA 模型; B:OPLS-DA 模型; CHF:心衰組; SHAM:對照組圖3 肝臟樣本代謝輪廓模型A: PCA model. B:OPLS-DA model. CHF:Heart failure group. SHAM:Control group.Fig.3 Metabolic profile of the liver samples
2.5 特征代謝物的篩選和鑒定
根據檢測得出的一級質譜,設定質譜儀分辨率為100000 (FMHW),得到特征代謝物的精確質荷比數值,然后進入HMDB數據庫比對查找,按照質荷比(m/z)值誤差不超過0.01的標準,得到與之相匹配的物質鑒定結果;將特征代謝物進行二次質譜(MS/MS)檢測,得到該代謝物的二級質譜圖,同 HMDB數據庫內的理論碎片進行比對,按照特征代謝物的二級質譜質荷比值與理論碎片比對差值≤0.01,且理論碎片與特征代謝物的二級碎片的主要峰匹配,能夠覆蓋特征代謝物二級碎片主要質譜峰的80%以上,即可認定該特征代謝物為理論碎片物質,有鑒定結果的特征代謝物共計10個,且在 2 組間差異均有統計學意義(表2)
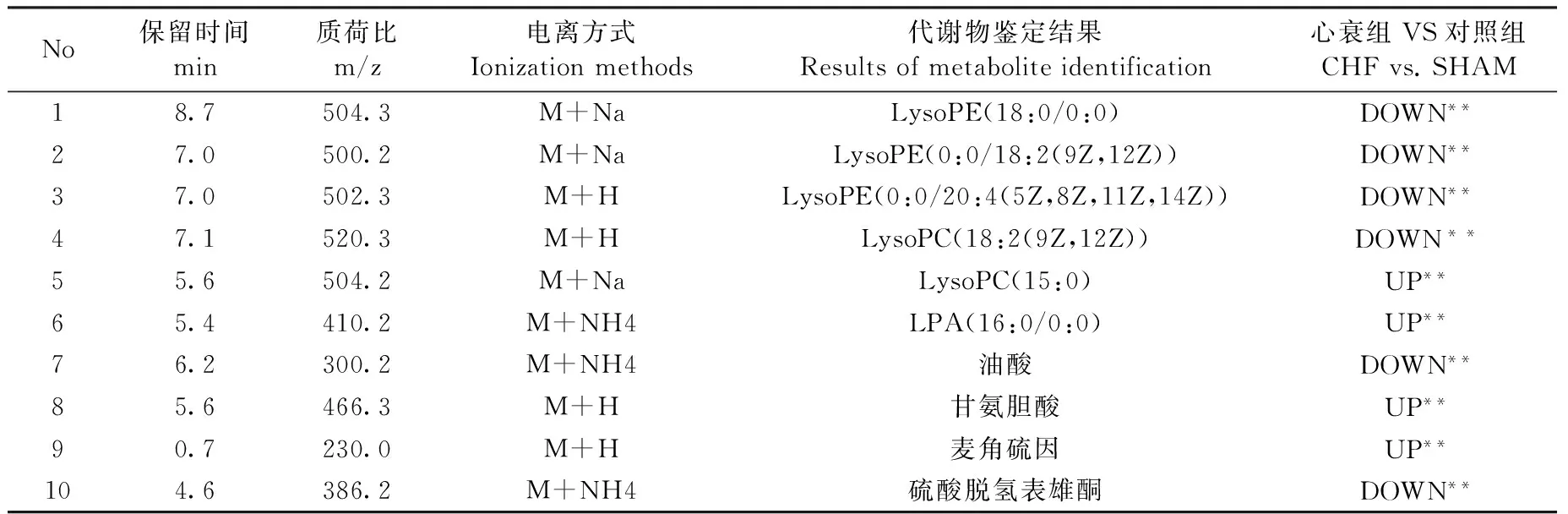
表2 特征代謝物鑒定結果
LysoPC: 溶血磷脂酰膽堿(LPC); LysoPE:溶血磷脂酰乙醇胺(LPE);P<0.05,**P<0.01
3 討論
在心血管疾病的研究中代謝組學已得到廣泛的應用,有關心力衰竭的代謝研究多集中于血清、血漿、尿液等物質,對于組織代謝變化的關注較少。
心力衰竭過程中,肝臟由于長期的體循環淤血會發生了病理學改變。越來越多的研究顯示心力衰竭過程中會出現血清白蛋白下降、轉氨酶升高、黃疸等表現,表明肝臟在心衰過程中存在代謝紊亂,肝功能的進行性損害會制約且影響著心衰患者的診療效果及預后。故本文應用代謝組學方法研究了慢性心力衰竭大鼠模型肝臟組織的代謝變化,構建慢性心力衰竭大鼠的代謝輪廓,成功篩選出肝臟特征代謝物,對特征代謝物分析發現其主要與糖脂代謝、細胞膜代謝等有關。
本研究結果顯示3種溶血磷脂酰乙醇胺、溶血磷脂酰膽堿(18:2(9Z, 12Z))對照組比較呈明顯降低趨勢,而溶血磷脂酰膽堿(15:0)與對照組則出現了明顯上調的趨勢,該類物質主要是與細胞膜的水解代謝有關。溶血磷脂酰膽堿(LPC)和溶血磷脂酰乙醇胺(LPE)通過磷脂酶A2水解磷脂酰膽堿和磷脂酰乙醇胺生成。研究表明在肝組織中磷脂代謝的變化與肝組織修復過程中肝細胞膜和細胞內各種生物膜的更新換代相關。此外磷脂是膽汁和膜表面活性物質的成分之一,并參與細胞膜對蛋白質的識別和信號傳導。研究還表明當溶血磷脂類物質釋放入循環系統會給機體帶來巨大的危害。LPC參與心血管內皮的損傷以及炎癥反應,在體內大量的 LPC會引起心肌細胞膜的電信號紊亂,引發心律失常[2]。LPE會影響鈣離子通道信號傳導,從而影響心肌的收縮功能[3]。本研究中肝組織中溶血磷脂類代謝異常應與心衰狀態下,心排血量減少,肝臟低灌注造肝臟損傷,肝細胞出現大面積壞死,肝細胞凋亡,線粒體、細胞器數目的減少相關。
此外,本研究顯示心衰狀態下肝組織中油酸,硫酸脫氫表雄酮相對于對照組呈顯著增高趨勢,甘氨膽酸,麥角硫因相對于對照組呈降低趨勢。這些變化主要反映心衰大鼠肝臟中糖脂類、膽汁酸,類固醇類等代謝紊亂。油酸(oleic acid, OLA)一種含有一個雙鍵單不飽和游離脂肪酸。近年來研究指出心力衰竭本身是一種代謝綜合征,而心力衰竭的患者往往存在胰島素抵抗[4], Perdomo等研究表明油酸可預防心血管胰島素抵抗、改善內皮功能障礙,降低促炎反應信號擴散和減少細胞凋亡,有助于改善動脈粥樣硬化過程和斑塊的穩定性[5]。在飲食中用油酸代替亞油酸可以改善2型糖尿病患者中低密度脂蛋白(LDL)和高密度脂蛋白(HDL)的水平。本研究中油酸含量顯著降低,這是否與機體胰島素敏感性下降相關有待進一步研究。而對于心衰患者適量增加富含油酸的飲食可有助于改善其臨床轉歸。
脫氫表雄酮(dehydroepiandrosterone, DHEA)是循環血液中濃度最高的類固醇激素,在體內以硫酸鹽形式(DHEAS)的形式存在。DHEAS 在經肝臟、脂肪、肌肉等組織可轉化性激素、皮質醇和皮質酮等其他激素,經過血液循環到達靶器官,發揮調解機體生理功能的作用。在動物實驗證實 DHEAS能降低血漿TG和磷脂[6]。Kathleen Brennan 等人研究表明DHEAS與胰島素抵抗指數HOMA-IR負相關,提示 DHEAS 有利于增加胰島素敏感性,具有提高胰島素水平、抗糖尿病作用[7]。老年人口服DHEA(85 mg/d)可有效地減少血漿脂質過氧化物,抑制低密度脂蛋白的氧化[8]。本研究中肝臟組織中的脫氫表雄酮呈明顯下調趨勢,這與以往研究中血清中DHEAS下調是相一致的,提示在心衰狀態下肝臟的物質轉化作用出現了異常,并可能通過受體機制和離子通道影響肝臟糖脂質代謝。對與心衰患者是否可以進行補充DHEA治療,其益害作用及相應的機理可作為進一步的研究方向。
甘氨膽酸(glycocholic acid, GCA)是由膽酸與甘氨酸在肝內合成的結合型膽汁酸,是膽汁酸的主要成分之一。在正常生理情況下外周血清GCA濃度維持較低的穩定水平,當肝臟發生病變時,血清GCA會出現不同程度的增高。既往的研究表明當血清中出現較高濃度的膽汁酸可能提示心臟疾病。2013年,Moezi等報道表明膽汁酸是導致心血管功能異常的主要因素。在體外實驗中,親脂性膽汁酸可對離體心肌細胞造成損傷,破壞心肌細胞線粒體功能誘導心肌細胞凋亡[9]。細胞水平研究發現牛磺去氧膽酸(taurodeoxycholic acid, TDCA)、牛磺膽酸(taurocholate, TC)、甘氨膽酸(glycocholic acid, GCA)均可影響心肌細胞的收縮。甘氨膽酸在300 μmol/L濃度時候會形成特殊的鈣波頻率雙相改變和細胞內鈣超載,從而改變鈣離子動力學,對心肌細胞收縮起抑制作用[10]。本研究中發現在心力衰竭時的肝臟組織中甘氨膽酸呈上調趨勢,這應與早期肝損害相關,心衰進展時肝瘀血加重造成肝實質損害,肝臟對甘氨膽酸攝取和排泄功能發生障礙從而導致血清甘氨膽酸量增高。循環中膽汁酸升高可能會影響心肌細胞功能,在心衰的發生和進展中起一定作用,對此類產物進行監測可以為心力衰竭的臨床診治提供幫助。
綜上所述,對心衰大鼠肝臟代謝輪廓的研究并對特征代謝物代謝途徑進行分析,可為心力衰竭的病理生理分子機制以及該疾病診療等提供新的思路。
[1] 馬曉麗, 駱新, 盧偉, 等. 基于1 H 核磁共振譜分析的自發性高血壓大鼠尿液代謝特征[J]. 中國實驗動物學報,2014, 22(4): 20-23.
[2] 鄭明奇, 劉剛, 田立. 溶血磷脂酰膽堿對T型鈣離子通道的心肌細胞內信號調控機制[J]. 中華心臟與心律電子雜志, 2013, 1(1): 24-26.
[3] Park KS, Lee HY ,Lee SY, et al. Lysophosphatidylethanolamine stimulates chemotactic migration and cellular invasion in SK-OV3 human ovarian cancer cells: Involvement of pertussis toxin-sensitive G-protein coupled receptor [J]. FEBS Lett, 2007, 581(23): 4411-4416.
[4] Perrone-Filardi P, Paolillo S, Costanzo P, et al. The role of metabolic syndrome in heart failure [J]. Eur Heart J. 2015, 36(39): 2630-2634.
[5] Perdomo L, Beneit N, Otero YF, et al. Protective role of oleic acid against cardiovascular insulin resistance and in the early and late cellular atherosclerotic process [J]. Cardiovasc Diabetol. 2015, 14: 75. doi: 10.1186/s12933-015-0237-9.
[6] Lea-currie YR, Wu SM, Mclntosh MK. Effects of acute administration of dehydroepiandrosterone sulfate on adipose tissue mass and cellularity in male rats [J]. Int J Obesity. 1997, 21: 147-154.
[7] Brennan K, Huang A, Azziz R. Dehydroepiandrosterone sulfate and insulin resistance in patients with polycystic ovary syndrome [J]. Fertil Steril, 2009, 91(5): 1848-1852.
[8] Longcope C. Metabolism of dehydroepiandrosterone [J]. Ann N Y Acad Sci, 1995, 774: 143-147.
[9] Zavecz JH, Battarbee HD. The role of lipophilicbile acids in the development of cirrhotic cardiomyopathy [J]. Cardiovasc Toxicol, 2010, 10(2): 117-129.
[10] Gorelik J, Harding SE, Shevchuk AI, et al. Taurocholate induces changes in rat cardiomyocyte contraction and calcium dynamics [J]. Clin Sci (Lond), 2002, 103(2): 191-200.
Metabolic profiling of liver in the rats with chronic heart failure
WU Fei1, LI Tong2,3, ZHANG Lei2, DONG Zhi-huan1, MI Rui2
(1. The Third Central Clinical College of Tianjin Medical University, Tianjin 300170, China; 2. Tianjin Third Central Hospital; 3. Tianjin Institute of Hepatobiliary Diseases, Tianjin Key laboratory of Artificial Cells)
Objective To establish a rat model of liver metabolism profile in chronic heart failure (CHF), to explore the dynamics of liver metabolism in CHF from the point of view of metabolism, and to find the characteristic metabolites valuable for the molecular mechanism and management of CHF. Methods Twenty male Wistar rats were assigned to the CHF group to receive aortic coarctation or to the control group to receive sham surgery, and were bred for 24 weeks following surgery. The metabolic profiling of the rat liver tissues was analyzed on a metabonomics research platform. Orthogonal partial least squares-discriminant analysis (OPLS-DA) model and principal component analysis (PCA) model were established for liver tissues of the CHF rats, and the characteristic metabolites were finally derived by data processing with SPSS 19.0 software. Results The PAC and OPLS-DA models were established successfully. Ten characteristic metabolites with significant differences between the CHF and control groups, including lysophosphatidyl choline, lysophosphatidyl ethanolamine, oleic acid, glycocholic acid, and dehydroepiandrosterone sulfate, were screened and identified from the models. Conclusions The metabolic disorders in CHF rats are well fitted to the established metabolic profile models, and these identified characteristic metabolites may provide reference for the pathophysiological molecular mechanism and management, etc., of chronic heart failure.
Chronic heart failure; Chromatography, high pressure liquid; Mass spectrometry; Metabolomics; Rat
天津市衛生局攻關項目(12KG106)。
巫菲(1989-),女,碩士研究生,主要從事心血管代謝研究。
李彤,博士生導師,主要從事心血管研究。 E-mail:Litongtj@163.com。
R-33
A
1671-7856(2016)10-0019-06
10.3969.j.issn.1671-7856. 2016.10.005
2016-05-12

