手助腹腔鏡在胃癌治療中的臨床評價
周鄭,顧問,吳文涌,朱德芾,余昌俊
(安徽醫科大學第一附屬醫院胃腸外科,安徽 合肥 230022)
?
手助腹腔鏡在胃癌治療中的臨床評價
周鄭,顧問,吳文涌,朱德芾,余昌俊
(安徽醫科大學第一附屬醫院胃腸外科,安徽 合肥 230022)
目的 評價手助腹腔鏡在胃癌治療中應用的近期臨床療效。方法 選擇接受手助腹腔鏡和開放手術的胃癌患者,收集患者術前、術后第1天以及術后第3天外周血,分別測定C-反應蛋白(CRP)、白細胞介素-6(IL-6)、皮質醇(COR)水平。同時收集患者的術前參數:患者的基本資料、合并的基礎疾病及實驗室指標;術中參數:手術時間、切口長度、術中出血量,淋巴結的陽性檢出率,腫瘤的大小與分期,手術方式及手術性質;術后患者胃腸功能恢復時間、術后并發癥的發生率及住院時間。結果 兩組患者的術前各參數比較差異無統計學意義(P>0.05)。手助腹腔鏡組與開放手術組在術中淋巴結的陽性檢出率,腫瘤的大小與分期,手術方式及手術性質上差異無統計學意義(P>0.05);手助腹腔鏡組患者的手術切口長度小于開腹手術組患者的切口長度[(5.07±0.41)vs(13.00±1.75) cm](P<0.05);在術中失血量,術后通氣時間及住院時間上手助腹腔鏡組與開腹手術組相比差異有統計學意義 [(183.3±61.87)vs(242.5±105.08) mL;(3.12±0.73)vs(3.38±0.83) d;(7.83±1.56)vs(8.68±1.96) d](P<0.05);細胞因子CRP、IL-6及COR在術前兩組之間差異無統計學意義,術后第1天手助腹腔鏡組的數值均明顯低于開放手術組[(94.22±14.99)vs(101.81±18.66) mg·L-1;(35.83±4.12)vs(38.56±4.58) ng·L-1;(389.00±30.97)vs(406.61±36.89) μg·L-1](P<0.05);而術后第3天差異無統計學意義。結論 手助腹腔鏡手術治療胃癌是安全可行的,其短期療效與開放手術相當;且手助腹腔鏡具有對機體干擾較小,術后胃腸道功能恢復更快的優勢。
手助腹腔鏡;開放手術;胃癌;近期臨床評價
胃癌是全球最常見的消化道惡性腫瘤之一。日本、韓國及我國是胃癌高發區,我國每年新發病例約40萬例,占世界總發病例數的42%。目前手術切除病灶仍然是胃癌的主要治療方式。手助腹腔鏡技術把腹腔鏡手術與開放手術結合在一起,外科醫生通過藍蝶裝置把手放入患者腹腔進行操作,而不影響氣腹的壓力。它的優勢包括保留了外科醫生的觸覺,利用操作手進行組織的鈍性分離及意外出血的迅速控制。手助腹腔鏡技術應用于臨床取得了良好效果,患者恢復快,創傷小[1]。但手助腹腔鏡技術在胃癌患者中的應用還少有報告。本研究收集接受手助腹腔鏡手術和開放手術的胃癌患者的臨床數據和實驗室指標,分析手輔助腹腔鏡在胃癌治療中應用的近期臨床療效。
1 資料與方法
1.1 一般資料 選取安徽醫科大學第一附屬醫院胃腸外科2014年1月至2016年3月行手助腹腔鏡和開放手術的胃癌患者,所有患者術前均經胃鏡和胃組織病理檢查證實為胃癌。一般資料比較:納入的開放手術組患者56例,平均年齡為(64.52±9.92)歲,其中男性39例,女性17例;納入的手助腹腔鏡組患者42例,平均年齡為(61.78±8.01)歲,其中男性32例,女性10例。兩組患者的年齡、性別、BMI、ASA分級、合并基礎疾病、既往腹部手術史以及術前實驗室指標,包括:凝血時間,血紅蛋白,血小板,白細胞和白蛋白水平差異無統計學意義,見表1。本研究獲安徽醫科大學第一附屬醫院倫理委員會批準,患者或近親屬對研究方案簽署知情同意書。

表1 兩組患者的一般資料比較
1.2 手術方法
1.2.1 手助腹腔鏡胃癌手術 手術前準備同常規開腹手術。采用氣管插管全麻,仰臥位。依據腹腔鏡探查對腫瘤進行手術中分期,并進行胃周區域淋巴結清掃。 于上腹部正中劍突下方4~6 cm 手術切口,放置藍蝶手助器,進行手術操作。提起大網膜,沿橫結腸上緣用電刀游離大網膜和胃結腸韌帶,分離結腸系膜前葉。然后將手術者左手經藍蝶手助器插入患者腹腔,分別安置 Trocar 和建立 CO2人工氣腹。用超聲刀分離胃網膜左血管予以切斷。分離胃左動脈和胃冠狀靜脈,清掃7組和9組淋巴結并離斷血管;向上分離至賁門右側,緊鄰肝左葉臟面分離肝胃韌帶,清掃1組淋巴結。分離胰十二指腸動脈和幽門下,清掃6組淋巴結和離斷胃網膜右血管;沿胰十二指腸動脈向上分離至幽門上和肝動脈,清掃12組和 5 組淋巴結,并離斷胃右血管。根治性遠端胃切除術,保留胃短血管和胃后血管,清掃胃小彎賁門側3組淋巴結。荷包鉗夾閉食管下段并切斷,移出切除的全胃及切除淋巴結和大網膜,食管殘端埋入吻合器針氈,采用食管空腸端側吻合+空腸空腸側側吻合術重建消化道。
1.2.2 開放胃癌手術 麻醉平穩后取仰臥位,導尿完成后常規消毒、鋪巾。于劍突與臍之間正中切口,長約13 cm,逐層進腹,探查腹腔內轉移情況,確定手術方案。于大網膜與橫結腸交界處超聲刀切開,將大網膜連同橫結腸系膜前葉及胰腺背膜解離,右側至結腸肝曲,左側至結腸脾曲。術者左手提起胃體,游離脾胃韌帶,夾閉胃網膜左及胃短血管,清掃周圍淋巴脂肪組織。游離胃后方,夾斷胃左動靜脈,清掃周圍淋巴脂肪組織。游離幽門部,離斷胃網膜右動靜脈,清掃周圍淋巴脂肪組織。近肝臟處超聲刀切開小網膜,清掃十二指腸韌帶周圍淋巴脂肪組織,離斷胃右動靜脈,清掃周圍淋巴脂肪組織。在幽門下方離斷十二指腸,用荷包鉗夾閉食管下段并切斷,取出切除組織和完成消化道重建。
1.3 檢測指標
1.3.1 基本資料 年齡、性別、體質量指數(BMI)、美國麻醉師協會 (ASA)分級、是否合并基礎疾病、是否有既往腹部手術史、術前血紅蛋白(Hg)及術前白蛋白水平、腫瘤最大徑、腫瘤的TNM分期。
1.3.2 術中情況 切口長度、手術時間、清掃的淋巴結數目、陽性淋巴結檢出數。
1.3.3 術后恢復情況 術后通氣時間、術后住院時間、是否發生手術相關并發癥。
1.3.4 應激指標 分別于術前、術后第1天和術后第3天采集患者空腹外周靜脈血,檢測C-反應蛋白 (CRP),白細胞介素-6(IL-6)和皮質醇 (COR)。CRP、IL-6及COR均采用ELISA 法檢測。

2 結果
2.1 術中參數比較 兩組患者中的腫瘤最大徑以及腫瘤的TNM分期相比差異無統計學意義;兩組患者在清掃的淋巴結數目以及陽性淋巴結檢出數比較差異無統計學意義。手助腹腔鏡組患者的手術時間顯著長于開放手術組患者的手術時間[(234.36±63.57)vs(178.61±51.04)]min,差異有統計學意義(P<0.01),而手助腹腔鏡組患者的切口長度小于開放手術組患者[(5.07±0.41)vs(13.00±1.75)] cm,差異有統計學意義(P<0.01),同時手助腹腔鏡組患者的術中失血量也少于開放手術組患者[(183.3±61.87)vs(242.5±105.08)] mL,差異有統計學意義(P<0.01),見表2。
2.2 術后恢復參數比較 兩組患者在術后進食時間及術后并發癥的發生率方面差異無統計學意義。手助組患者術后通氣時間短于開放組患者的術后通氣時間[(3.12±0.73)vs(3.38±0.83) d,P=0.029],且手術腹腔鏡組患者的住院時間更短,兩組間比較差異有統計學意義,見表2。
2.3 細胞因子檢測結果比較 兩組患者術前的三種細胞因子檢測值比較差異無統計學意義。在術后第1天兩組患者間的三種細胞因子比較差異有統計學意義,而在術后第3天檢測發現兩組間三種細胞因子數值相比差異無統計學意義,見表3。
3 討論
手助腹腔鏡技術現已廣泛應用于惡性腫瘤切除手術等外科領域,它的安全可行性已得到證實[2-3]。研究表明,手助腹腔鏡手術和開放手術相比有諸多優勢,如切口美觀,術后并發癥減少,術后恢復快等[3-6]。
本研究對手輔助腹腔鏡在胃癌治療中應用的近期臨床療效進行了分析。在淋巴結的檢出率方面,手助腹腔鏡在結直腸腫瘤的應用中未發現與開腹手術差異有統計學意義[7-8];在本研究中,兩組患者的術中清掃的淋巴結數目及術后的陽性淋巴結檢出數差異無統計學意義,說明手助腹腔鏡手術達到了與開放手術一致的胃癌治療效果。此次我們調查的術后并發癥包括術后肺炎,胸腔積液,消化道瘺及切口感染,兩組患者的術后并發癥的發生率相似,可能由于本次研究病例數較少所致,有待今后更大樣本的研究。分析數據得出開放手術組患者的切口長度2倍于手助腹腔鏡組患者的切口長度。小切口不僅可以達到美容效果,更可以減少切口疝、切口感染及切口裂開的發生率[9-10]。術中減少失血既可以減少患者發生圍手術期的死亡,又可以避免患者的免疫功能受到損害[11-12],我們的結果發現手助腹腔鏡組患者的術中失血量要小于開腹手術組患者的術中失血量,且差異有統計學意義。術后數據分析發現手助腹腔鏡組患者的消化道功能恢復時間和住院時間均小于開腹手術組患者,表明接受手助腹腔鏡技術治療的胃癌患者術后恢復更快。

表2 兩組患者的術中參數及術后參數的比較
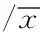
表3 兩組患者的術前與術后細胞因子的比較±s
注:時點間兩兩比較的顯著線水準a,=0.017。
手術所造成的創傷可以引起機體產生應激反應。本研究主要研究了CRP、IL-6和COR三種細胞因子的變化。CRP是一種急性期蛋白,有激活補體、釋放炎癥介質、促進黏附等功能。 CRP一般于術后4~12 h升高,24~72 h達到高峰,之后2周內在一定的水平范圍內波動。Jung等[13]的研究證實相比于開放手術的胃癌患者術后CRP水平,行腹腔鏡手術的胃癌患者的術后CRP水平更低,且差異有統計學意義。這與我們的研究結果一致,術后1 d手助腹腔鏡組胃癌患者的血液CRP值低于開放手術組患者的血液CRP值。IL-6是促炎細胞因子,一般于術后1~3 h升高,其上升的越高,代表機體遭受的損傷越嚴重。IL-6一般在手術創傷的早期便可表達,與手術創傷嚴重程度及失血量等因素相關,是組織損傷最為敏感的標志物。Okholm等[14]通過薈萃分析得出接受腹腔鏡手術的胃癌患者術后血液IL-6水平明顯低于接受開放手術的胃癌組患者的IL-6水平,因此腹腔鏡手術對機體應激較小,可以降低患者術后并發癥的發生率。本研究發現,兩組患者術后第1天的血液IL-6水平比較差異有統計學意義,提示手助腹腔鏡組患者所經歷的應激反應較小。COR是一種重要的激素,手術可刺激下丘腦-垂體-腎上腺軸,促使機體內COR水平迅速升高。張雪峰等[15]研究發現開放直腸癌切除術與腹腔鏡直腸癌切除術后血清COR均有所升高,術后1 d腹腔鏡直腸癌切除術組降至術前水平,而開放直腸癌切除術組下降緩慢,差異有統計學意義。本研究發現術后第1天兩組患者的血液皮質醇濃度迅速升高,且開放手術組患者的血液皮質醇濃度升高數值明顯高于手助腹腔鏡組;術后第3天兩組患者的血液皮質醇濃度均下降,但差異無統計學意義;提示手助腹腔鏡技術對患者所造成的應激反應更小。
綜上所述,手助腹腔鏡胃癌手術具有與開放胃癌手術相同的短期療效,且接受手助腹腔鏡手術患者的術后通氣時間更早,機體應激反應更小。因此,手助腹腔鏡技術可作為胃癌手術的選擇模式。
[1] Aalbers AG,Doeksen A,Van Berge Henegouwen MI,et al.Hand-assisted laparoscopic versus open approach in colorectal surgery:a systematic review[J].Colorectal Dis,2010,12(4):287-295.
[2] Eguchi S,Takatsuki M,Soyama A,et al.Elective living donor liver transplantation by hybrid hand-assisted laparoscopic surgery and short upper midline laparotomy[J].Surgery,2011,150(5):1002-1005.
[3] Pendlimari R,Holubar SD,Pattan-Arun J,et al.Hand-assisted laparoscopic colon and rectal cancer surgery:feasibility,short-term,and oncological outcomes[J].Surgery,2010,148(2):378-385.
[4] Moghadamyeghaneh Z,Carmichael JC,Mills S,et al.Hand-assisted laparoscopic approach in colon surgery[J].J Gastrointest Surg,2015,19(11):2045-2053.
[5] Miyagaki H,Rhee R,Shantha Kumara HM,et al.Surgical treatment of diverticulitis:Hand-assisted laparoscopic resection is predominantly used for complex cases and is associated with increased postoperative complications and prolonged hospitalization[J].Surg Innov,2016,23(3):277-283.
[6] Oshikiri T,Yasuda T,Kawasaki K,et al.Hand-assisted laparoscopic surgery (HALS) is associated with less-restrictive ventilatory impairment and less risk for pulmonary complication than open laparotomy in thoracoscopic esophagectomy[J].Surgery,2016,159(2):459-466.
[7] Liu FL,Lin JJ,Ye F,et al.Hand-assisted laparoscopic surgery versus the open approach in curative resection of rectal cancer[J].J Int Med Res,2010,38(3):916-922.
[8] Osarogiagbon RU,Ogbeide O,Ogbeide E,et al.Hand-assisted laparoscopic colectomy compared with open colectomy in a nontertiary care setting[J].Clin Colorectal Cancer,2007,6(8):588-592.
[9] 池畔,林惠銘,陳燕昌,等.手助腹腔鏡擴大右半結腸切除血管骨骼化淋巴清掃術[J].中華胃腸外科雜志,2005,8(5):410-412.
[10] Senagore AJ,Stulberg JJ,Byrnes J,et al.A national comparison of laparoscopic vs open colectomy using the National Surgical Quality Improvement Project data[J].Dis Colon Rectum,2009,52(2):183-186.
[11] Amato A,Pescatori M.Perioperative blood transfusions for the recurrence of colorectal cancer[J].Cochrane Database Syst Rev,2006,25(1):CD005033.
[12] Mortensen FV,Jensen LS,S?rensen HT,et al.Cause-specific mortality associated with leukoreduced,buffy coat-depleted,or no blood transfusion after elective surgery for colorectal cancer:a posttrial 15-year follow-up study[J].Transfusion,2011,51(2):259-263.
[13] Jung IK,Kim MC,Kim KH,et al.Cellular and peritoneal immune response after radical laparoscopy-assisted and open gastrectomy for gastric cancer[J].J Surg Oncol,2008,98(1):54-59.
[14] Okholm C,Goetze JP,Svendsen LB,et al.Inflammatory response in laparoscopic vs.open surgery for gastric cancer[J].Scand J Gastroenterol,2014,49(9):1027-1034.
[15] 張雪峰,李永雙,金紅旭,等.腹腔鏡和開放結直腸癌手術應激反應的比較[J].中國內鏡雜志,2008,14(6):572-574.
A short-term clinical evaluation of hand assisted laparoscopic surgery in the treatment of gastric cancer
ZHOU Zheng,GU Wen,WU Wenyong,et al
(TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei,Anhui230022,China)
Objective To investigate the short-term clinical evaluation of hand assisted laparoscopic surgery in the treatment of gastric cancer.Methods We selected gastric cancer patients who underwent HALS and OS at the gastrointestinal department of the First Affiliated Hospital of Anhui Medical University between January 2014 and March 2016.We collected serum from these patients preoperatively,1stday and 3rd day postoperatively to detect the levels of C-reactive protein(CRP),interleukin-6(IL-6) and cortisol(COR).Clinical indicators were also collected,including the patients′ basic information,underlying diseases and laboratory indexes,together with intraoperative parameters including operation time,incision length,blood loss,lymph node positive rate,tumor size and tumor stage,surgical methods and surgical properties,and also recovery time of postoperative gastrointestinal functions,postoperative complication occurrence rate and hospitalization time.Results Preoperative parameters of the two groups were not statistically different.Intraoperative lymph node positive rate,tumor size and tumor stage,surgical methods and surgical properties in HALS group and OS group were not statistically different (P>0.05);the length of incision in hand assisted laparoscopic group was shorter than that in OS group[(5.07±0.41)vs(13.00±1.75)cm] (P>0.05).Intraoperative blood loss,postoperative flatus time and hospitalization time in HALS group were superior to those in OS group [(183.3±61.87)vs(242.5±105.08) mL;(3.12±0.73)vs(3.38±0.83) d;(7.83±1.56)vs(8.68±1.96) d] (P<0.05);preoperative CRP,IL-6 and COR were not different between the two groups.In the first postoperative day,the levels of the three cytokines in HALS group were significantly lower than those in the OS group [(94.22±14.99)vs(101.81±18.66) mg·L-1;(35.83±4.12)vs(38.56±4.58) ng·L-1;(389.00±30.97)vs(406.61±36.89)μg·L-1] (P<0.05) while there was no statistical difference in the three cytokines levels between the two groups in the third postoperative day.Conclusions HALS is safe and feasible for patients with gastric cancer,which achieves the same short-term curative effect as OS.Compared with OS,HALS achieves faster recovery of gastrointestinal function and less stress interference.
Hand assisted laparoscopy;Open surgery;Gastric cancer;Short term clinical evaluation
國家自然科學基金面上項目(81572305);安徽省教育廳重點人才支持項目(gxyqZD2016051)
吳文涌,男,副教授,碩士生導師,研究方向:胃腸腫瘤及炎性疾病,E-mail:hfwwy@126.com
10.3969/j.issn.1009-6469.2016.10.026
2016-05-17,
2016-07-29)

