長效與短效制劑GnRH-a長方案對IVF患者激素水平及臨床妊娠的影響
謝廣妹,倪亞莉
(甘肅省婦幼保健院 生殖醫學中心,甘肅 蘭州,730050)
?
長效與短效制劑GnRH-a長方案對IVF患者激素水平及臨床妊娠的影響
謝廣妹,倪亞莉
(甘肅省婦幼保健院 生殖醫學中心,甘肅 蘭州,730050)
目的 考察低劑量長效促性腺激素激動劑(GnRH-a)與短效GnRH-a長方案對體外受精-胚胎移植(IVF-ET)患者激素水平及臨床妊娠的影響。 方法 選取進行IVF-ET助孕治療患者180例,排卵正常者采取黃體中期降調長方案,異常者行口服避孕藥(OC)預處理。根據使用長效或短效GnRH-a分為長效組和短效組,其中排卵正常者為長效A組42例,短效A組46例;異常者為長效B組40例,短效B組52例,比較長效組與短效組臨床結局。結果 2組月經第3天基礎血卵泡雌激素(FSH)、雌二醇(E2)、基礎竇卵泡計數(AFC),注射人體絨膜促性腺激素(HCG)日E2、子宮內膜厚度及取卵個數均無顯著差異(P>0.05); 長效組促性腺激素(Gn)用量、注射日孕酮(P)水平顯著高于短效組(P<0.01),臨床妊娠率、種植率顯著低于短效組(P<0.05)。不同方案各主導卵泡直徑范圍周期所占比例比較未見顯著差異(P>0.05),但長效組較主導卵泡直徑>20 mm的周期數有逐漸增多的趨勢。結論 在IVF-ET周期長方案中,長效制劑GnRH-a會升高孕酮水平,降低妊娠率和種植率,一定程度上不利于臨床結局。
促性腺激素釋放激素激動劑; 低劑量; 卵巢反應性; 體外受精-胚胎移植
自1978年世界第1例試管嬰兒誕生以來,體外受精-胚胎移植(IVF-ET)已發展成為一項較為成熟的助孕技術[1]。由促性腺激素釋放激素激動劑(GnRH-a)而衍生出的長方案、短方案、超長方案及超短方案廣泛應用控制性超排卵[2]。研究[3]指出,使用長效或短效GnRH-a對臨床結局無明顯影響。但也有報道[4]指出,長效GnRH-a會對卵巢造成過度抑制,加之使用時間較長,使患者經濟負擔加重,而短效GnRH-a可根據患者情況選擇用藥劑量,不影響體外受精(IVF)結局,但能減少促性腺激素(Gn)用量。本研究通過比較長效低劑量與短效GnRH-a方案參數,評估GnRH-a長方案降調節在IVF-ET中的應用價值,現報告如下。
1 資料與方法
1.1 一般資料
選擇2014年10月—2015年10月在第四軍醫大學第一附屬醫院接受IVE-ET助孕患者180例,不孕原因包括:輸卵管因素、盆腔粘連、子宮內膜異位癥、排卵障礙以及男方因素等,年齡22~44歲,平均(31.46±4.74)歲;體質量指數(20.78±2.59)kg/m2; 不育年限(4.51±3.16)年。排卵正常者采取黃體中期降調長方案,異常者行口服避孕藥(OC)預處理。根據使用長效或短效GnRH-a分為長效組和短效組,其中排卵正常者長效A組42例,短效A組46例;異常者長效B組40例,短效B組52例。所有患者均知情同意,并經醫學倫理委員會同意認可。
1.2 方法
1.2.1 長效組:排卵正常者于黃體中期皮下注射GnRH-a 1.875 mg/次;無排卵者從月經來潮第3天起口服去氧孕烯-炔雌醇1片,其中去氧孕烯0.15 mg,炔雌醇0.03 mg,共21 d,口服OC第17天皮下注射長效GnRH-a 1.875 mg/次。
1.2.2 短效組:排卵正常者于黃體中期皮下注射GnRH-a 0.1 mg/次;無排卵者從月經來潮第3天起口服去氧孕烯-炔雌醇1片,共21 d,OC第17天皮下注射短效GnRH-a 0.1 mg,劑量由0.1 mg/d逐漸減至0.05 mg/d直至注射絨促性素(HCG)。
1.2.3 胚胎移植:當2個主導卵泡直徑≥18 mm時,給予HCG 5000~10 000 IU或重組HCG 250 μg,36~38 h后在陰道B超聲引導下行穿刺取卵術,獲卵后行常規IVF或單精子卵胞漿內注射(ICSI),體外受精后72 h行胚胎移植術,每個周期移植1~2枚胚胎,術后予常規黃體酮支持。
1.3 觀察指標
移植胚胎后14 d測定尿妊娠試驗,B超顯示有胚胎和胎心者確定為臨床妊娠;測定月經第3天基礎血卵泡雌激素(FSH)、雌二醇(E2)、基礎竇卵泡計數(AFC)以及注射HCG日E2、孕酮(P)水平、子宮內膜厚度;種植率以移植4周后宮內孕囊數進行計算。
1.4 統計學處理
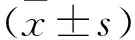
2 結 果
2.1 2組臨床效果比較
2種長方案中,長效組與短效組月經第3天基礎FSH、E2、AFC,注射日E2、子宮內膜厚度及取卵個數均無顯著差異(P>0.05); 長效組Gn用量、注射HCG日P水平顯著高于短效組(P<0.01),臨床妊娠率、種植率顯著低于短效組(P<0.05)。見表1、2。
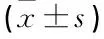
表1 采用黃體中期降調長方案的臨床效果比較

表2 采用OC預處理長方案的臨床結果比較
2.2 2種長方案中主導卵泡直徑范圍周期分布比較
不同方案,各主導卵泡直徑范圍周期所占比例比較無顯著差異(P>0.05);與短效組比較,長效組主導卵泡直徑>20 mm的周期數有逐漸增多的趨勢。見表3。

表3 2種方案主導卵泡直徑范圍周期分布比較[n(%)]
3 討 論
GnRH又稱黃體生成激素釋放激素,GnRH-a是GnRH的結構類似物,能可逆性地阻斷垂體GnRH釋放,抑制卵巢功能[5]。臨床根據其作用時間分為長效及短效2種制劑[6],長效制劑一次注射可在4周內使血藥濃度維持在0.23 μg/L左右,40~45 d垂體恢復功能。長效GnRH-a應用方便,患者可接受性和依從性強[7]。有研究[8]表明,GnRH-a預治療3~6個月可改善子宮內膜異位癥患者IVF-ET的妊娠結局。短效制劑作用時間只能維持24 h或更短,一般從前次月經的黃體中期開始注射GnRH-a,Gn暫時升高,10~14 d后即可達到降調節作用[9],其在臨床中可根據患者具體情況選擇用藥劑量,但每天注射或引起患者不適[10]。
目前常用長效制劑劑量為3.75 mg,短效標準劑量為0.1 mg/d[11]。但有研究[12]指出,3.75 mg長效GnRH-a對卵巢有過度抑制作用。本研究使用半量長效1.875 mg,短效0.1 mg逐漸降低至每日皮下注射1/2支(0.05 mg/d)。李潔等[13]認為,在降調前行OC預處理,患者的卵巢反應性、促排卵過程中的FSH、促黃體生成素(LH)變化等與單行GnRH-a調節有差異,因此本研究對OC預處理長方案與黃體中期降調長方案分別進行分析,以全面評估GnRH-a長方案降調節在IVF-ET中的應用。本研究結果顯示,2種長方案中,長效組Gn用量、注射HCG日P水平顯著高于短效組,且臨床妊娠率、胚胎種植率顯著低于短效組,表明長效GnRH-a可能對卵巢反應性及臨床結局產生不利影響。推測可能是由于長效GnRH-a的應用對卵巢的過度抑制,造成Gn用量增加,使用時間延長,垂體呈過度抑制狀態,導致IVF周期中卵巢反應性降低,LH下降影響雌激素分泌從而間接影響到內膜容受性,影響種植,降低妊娠率。
另外,岳林林等[14]研究發現,主導卵泡直徑在18~20 mm獲得卵子的成熟度較好,受精率高,隨著卵泡直徑的增加,卵子開始呈現出過度成熟的趨勢。因此,本研究根據注射HCG日直徑≥18 mm的所有主導卵泡的平均值分為3組,分別計算其比例,結果顯示長效組較短效組主導卵泡直徑>20 mm的周期數有逐漸增多的趨勢。趙淑芹等[15]認為,主導卵泡直徑的增加會引起血孕酮水平的升高,促排卵周期在高FSH、低LH的狀態下孕酮于HCG日前2~3 d開始升高,使子宮內膜在胚胎發育前提前發育,影響胚胎種植,從而降低臨床妊娠率[16-19]。由此推測主導卵泡直徑越大,卵泡膜細胞活性越強,孕酮生成和轉化越多,造成長效組Gn用量多、孕酮水平較高,妊娠率和種植率下降。
[1] Albuquerque L E,Saconato H,Maciel M C,et al. Depot versus daily administration of GnRH agonist protocols for pituitary desensitization in assisted reproduction cycles: a Cochrane Review[J]. Hum Reprod,2003,18(10): 2008-2017.
[2] 曹云霞,徐千花. 垂體降調節在控制性超排卵中的應用[J]. 中國實用婦科與產科雜志,2010,26(10): 745-748.
[3] Broekmans F J,Verweij P J,Eijkemans M J,et al. Prognostic models for high and low ovarian responses in controlled ovarian stimulation using a GnRH antagonist protocol[J]. Hum Reprod,2014,29(8): 1688-1697.
[4] 鄭娟,周黎明,孫亦婷,等. 低劑量長效GnRH-a在控制性超排卵方案中的臨床應用[J]. 生殖醫學雜志,2015,24(6): 465-469.
[5] Gizzo S,Andrisani A,Noventa M,et al. Recombinant LH supplementation during IVF cycles with a GnRH-antagonist in estimated poor responders: A cross-matched pilot investigation of the optimal daily dose and timing[J]. Mol Med Rep,2015,12(3): 4219-4229.
[6] Drakopoulos P,Blockeel C,Stoop D,et al. Conventional ovarian stimulation and single embryo transfer for IVF/ICSI. How many oocytes do we need to maximize cumulative live birth rates after utilization of all fresh and frozen embryos[J]. Hum Reprod,2016,31(2): 370-376.
[7] 周衛琴,潘艷平,莊燕燕,等. 添加GnRH-a黃體支持的輔助生殖技術治療后妊娠結局及子代隨訪結局分析[J]. 中華婦產科雜志,2016,51(1): 31-35.
[8] 劉景瑜,孔娜,朱靜靜. 重癥子宮內膜異位癥IVF/ICSI周期超長方案中添加短效GnRH-a對臨床結局的影響[J]. 安徽醫藥,2013,17(11): 1958-1960.
[9] Li Y,Yang D,Zhang Q. Clinical outcome of one-third-dose depot triptorelin is the same as half-dose depot triptorelin in the long protocol of controlled ovarian stimulation[J]. J Hum Reprod Sci,2012,5(1): 14-19.
[10] Venetis C A,Kolibianakis E M,Bosdou J K,et al. Estimating the net effect of progesterone elevation on the day of hCG on live birth rates after IVF: a cohort analysis of 3296 IVF cycles[J]. Hum Reprod,2015,30(3): 684-691.
[11] Wright P E,Dyson H J. Intrinsically disordered proteins in cellular signalling and regulation[J]. Nat Rev Mol Cell Biol,2015,16(1): 18-29.
[12] 崔彥芬,劉英,張軍,等. 子宮內膜厚度與體外授精-胚胎移植妊娠結局間的相關性研究[J]. 中國優生與遺傳雜志,2014,22(3): 113-115.
[13] 李潔,楊菁,徐望明,等. PCOS患者GnRH-ant方案超促排卵過程中雌二醇水平下降的臨床對策[J]. 生殖醫學雜志,2016,25(1): 5-10.
[14] 岳林林. 絨毛膜促性腺激素注射日直徑≥17mm卵泡占比與妊娠結局的關系[J]. 中國計劃生育學雜志,2016,24(1): 39-41,45.
[15] 趙淑芹,黃淑娟,丁晨,等. 取卵日卵泡大小對體外受精胚胎發育早期的影響[J]. 現代婦產科進展,2014,23(7): 556-559.
[16] 余莎,謝梅青. GnRH-a對內異癥在位子宮內膜細胞HOXA10表達的影響[J]. 海南醫學院學報,2016,22(3): 225-228.
[17] 李海艷. 促性腺激素釋放激素激動劑預防子宮內膜異位癥腹腔鏡術后復發的臨床觀察[J]. 實用臨床醫藥雜志,2013,17(15): 151-153.
[18] 王琴,趙玲軍. 腹腔鏡手術聯合藥物治療子宮內膜異位癥的療效對比觀察[J]. 中華全科醫學,2014,12(10): 1619-1621.
[19] 官林,郭清萍. 促性腺激素釋放激素激動劑聯合克齡蒙在子宮內膜異位癥保守性手術治療后的應用[J]. 實用臨床醫藥雜志,2013,17(23): 45-48.
Effect of long protocols of long- and short-acting preparations gonadotropin-releasing hormone agonist on the hormone level and clinical pregnancy in patients with in vitro fertilization
XIE Guangmei,NI Yali
(CentreforReproductiveMedicine,GansuProvincialMaternityandChild-careHospital,Lanzhou,Gansu,730050)
Objective To investigate the effect of long protocols of long- and short-acting preparations gonadotropin-releasing hormone agonist (GnRH-a) on the hormone level and clinical pregnancy in patients with in vitro fertilization-embryo transfer (IVF-ET). Methods Totally 180 patients underwent IVF-ET were selected,in which the cases of normal ovulation were given mid-luteal phase long protocols of down-regulation,while the abnormal ones orally took contraceptives (OC). According to application conditions of long- and short-acting GnRH-a,the patients were divided into long- and short-acting groups. For patients with normal ovulation,there were 42 and 46 cases respectively in long-acting group A and short-acting group A. For those with abnormal ovulation,there were 40 and 52 cases respectively in long-acting group B and short-acting group B. The clinical outcomes were compared among groups. Results There was no significant differences between two groups in the levels of follicle-stimulating hormone (FSH) and estradiol (E2),antral follicle count (AFC) on third day of menstruation,E2and endometrial thickness on day of human chorionic gonadotropin (HCG) administration as well as number of ova obtained (P>0.05). Both amount of gonadotropin (Gn) and progesterone (P) level on day of HCG administration were significantly higher,but clinical pregnancy rate and implantation rate were significantly lower in long-acting groups than in short-acting groups (P<0.05 orP<0.01). There were no significant differences in the cycle proportions of each dominant follicle diameter range in different protocols (P>0.05),but the cycle number of dominant follicle diameter >20 mm in long-acting groups tended to increase gradually. Conclusion In the long protocol of IVF-ET cycles,long-acting preparation GnRH-a can increase P level,and decrease pregnancy rate and implantation rate,which is unfavorable to clinical outcome to some extent.
gonadotropin-releasing hormone agonist; low dose; ovarian response; in vitro fertilization-embryo transfer
2016-05-11
中國高校醫學期刊臨床專項資金(11526670)
R 321
A
1672-2353(2016)21-076-04
10.7619/jcmp.201621023

