轉錄因子Foxp3對人肺腺癌細胞A549增殖周期的影響及機制研究
劉亞慶 趙 博 羅亞東 李祎南 楊 巍
(吉林大學基礎醫學院免疫學系,長春130021)
?
轉錄因子Foxp3對人肺腺癌細胞A549增殖周期的影響及機制研究
劉亞慶 趙 博 羅亞東 李祎南 楊 巍
(吉林大學基礎醫學院免疫學系,長春130021)
目的:研究Foxp3對肺腺癌細胞A549增殖及細胞周期的影響,并探討相關調控機制。方法:采用siRNA沉默A549細胞Foxp3表達;MTT法檢測細胞增殖;流式細胞術檢測細胞周期變化;RT-PCR篩選細胞周期相關checkpoint基因;免疫熒光及雙熒光素酶報告基因分析Foxp3對相關checkpoint基因調控機制。結果:沉默A549細胞Foxp3后,其增殖明顯減慢并發生G0/G1期阻滯,G1/S期checkpoint基因CCND1表達顯著降低。機制研究發現Foxp3能直接調控CCND1表達。結論:Foxp3通過上調細胞周期G1/S期checkpoint基因CCND1表達,促進肺腺癌細胞A549增殖,從而促進了肺腺癌發展,為肺腺癌的發生發展及治療靶點提供了新思路。
Foxp3;CCND1;肺腺癌;增殖;細胞周期
Foxp3(Forkhead box protein 3)是叉頭/翼狀螺旋轉錄因子家族成員之一,最初被發現表達于CD4+CD25+調節性T淋巴細胞(regulatory T cells,Tregs),是其特異的標志物,也是維持其免疫抑制功能的關鍵調節基因。在某些腫瘤中,如結腸癌、乳腺癌、卵巢癌、肺癌、胰腺癌等,外周血和腫瘤局部Foxp3+Tregs增多,能抑制多種免疫細胞的作用,促進腫瘤免疫逃逸[1],與腫瘤進展及不良預后關系密切[2]。而近年研究發現Foxp3不僅在Tregs表達,在多種腫瘤組織和腫瘤細胞中也有表達,但是發揮的作用、與預后的關系卻不盡相同。在舌鱗狀細胞癌、肝癌、胃癌中,Foxp3表達與不良預后呈正相關,發揮促癌作用[3,4];而在前列腺癌、乳腺癌中,Foxp3高表達者預后較好,Foxp3發揮抑癌作用[5,6]。惡性腫瘤的發生發展是多基因參與的過程,表現為細胞的增殖、凋亡、遷移和侵襲等生物學行為調節異常,這是影響患者預后的重要因素。因此,腫瘤細胞Foxp3可能改變了腫瘤細胞的生物學行為,進而促進或抑制腫瘤的發生發展,影響患者預后。增殖是細胞的重要生命特征,在胃癌、黑色素瘤中,Foxp3對腫瘤細胞增殖的影響也不一致[7,8]。腫瘤細胞能夠無限增殖究其原因在于細胞周期調控紊亂,細胞周期的調控是一個精細復雜的過程,由多種蛋白共同參與。在肺腺癌中,Foxp3對其增殖影響尚不明確,其機制研究更是鮮有報道。因此,本課題擬以人肺腺癌細胞A549為模型,研究Foxp3對肺腺癌細胞增殖周期的影響及相關機制。
1 材料與方法
1.1 實驗材料、試劑 人肺腺癌細胞系A549為本課題組前期凍存。Foxp3 siRNA購于廣州銳博公司。轉染試劑Lipofecta mine 2000購于Invitrogen公司。MTT購于Sigma公司。細胞周期試劑盒、anti-Foxp3和anti-CCND1購于天津三箭公司。膠回收試劑盒和DNA抽提試劑盒購于Roche公司。pGL3螢光素酶雙報告載體質粒以及雙熒光素酶報告基因檢測試劑盒購于Promega公司。限制性內切酶KpnⅠ、BgⅢ及T4 DNA連接酶購于北京全式金公司。
1.2 方法
1.2.1 siRNA沉默肺腺癌細胞Foxp3表達 取對數生長期的A549細胞,調濃度2×105ml-1,接種于六孔板(每孔1.5 ml),次日細胞密度達到60%~70%后進行轉染。先分別孵育轉染試劑和siRNA,再將兩者充分混合,室溫孵育20 min。吸棄原六孔板內培養基,換無血清無抗生素DMEM。將上述混合溶液加入六孔板內(siRNA終濃度50 nmol/L),置于細胞培養箱孵育6 h后,吸棄培養上清,加入含10%胎牛血清的DMEM培養基繼續培養。48 h后收細胞提取總RNA,RT-PCR檢測Foxp3 mRNA表達水平。
1.2.2 MTT比色法檢測細胞增殖 取對數生長期A549細胞,調濃度8×104ml-1,接種于96孔板(每孔100 μl)。沉默Foxp3表達72 h后每孔加入10 μl MTT溶液,繼續培養4 h,棄掉上清后加入100 μl DMSO,低速震蕩10 min,使顆粒物充分溶解,于酶標儀波長570 nm測OD值。
1.2.3 流式細胞術檢測細胞周期 沉默A549細胞Foxp3表達48 h后,胰酶消化收取細胞,調濃度1×106ml-1,70%乙醇4℃固定過夜。PBS洗滌2次后加入500 μl PI染液,室溫避光孵育30 min后上機檢測。
1.2.4 RT-PCR檢測細胞周期相關基因的mRNA水平 沉默A549細胞Foxp3表達48 h后,胰酶消化收取細胞,提取總RNA,RT-PCR檢測CCND1、CCND2、CCND3、CCNE2、CCDE1、CDK2、CDK4、CDK6 mRNA表達水平。
1.2.5 免疫熒光 在24孔板中做細胞爬片,次日取出玻片用PBS洗3次,4%多聚甲醛固定15 min,PBS再清洗3次,0.5% Triton室溫打孔20 min,PBS清洗后用1% BSA封閉。加入稀釋的一抗,濕盒內4℃過夜。次日加熒光二抗,PBST浸洗3次,濕盒中37℃孵育1 h,再用PBST浸洗3次。滴加DAPI避光孵育1~3 min染核,PBST洗去多余DAPI并吸干液體,封片后在熒光顯微鏡下觀察采集圖像。
1.2.6 雙熒光素酶報告基因 根據http://www.geneco-poeia.com網站提供預測的CCND1可能的啟動子作用區,設計引物,為了報告載體構建簡便,在引物上下游分別插入限制性內切酶KpnI及BglII,引物由上海生工生物公司合成。上游引物為5′-GCGGTACCTCAGTCCCAGGGCAAATTCT-3′,下游引物為5′-GGCAGATCTAAACTCCCCTGTAGTCCGT-GC-3′,序列大小為1 143 bp。切膠回收PCR產物,在T4 DNA連接酶的作用下行連接反應(16℃過夜),將連接產物轉化感受態大腸桿菌,篩選培養陽性克隆質粒測序鑒定。
沉默A549細胞Foxp3表達24 h后,轉染pGL3-CCND1-promoter質粒。48 h后收集細胞裂解物,用雙螢光素酶報告基因檢測試劑盒檢測pGL3-CCND1-promoter質粒的螢光素酶活性。
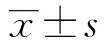
2 結果
2.1 沉默A549細胞Foxp3表達 為干預A549細胞Foxp3表達,采用RNAi的方法將siRNANC、Foxp3siRNA1和Foxp3siRNA2分別轉染A549細胞48h后,RT-PCR法檢測各組細胞Foxp3表達。結果顯示:siRNA1、siRNA2兩組Foxp3表達水平明顯低于siRNANC組,差異具有統計學意義(P<0.05)。該結果表明:兩對siRNA均可特異性干擾Foxp3表達,可以用于后續實驗,見圖1。
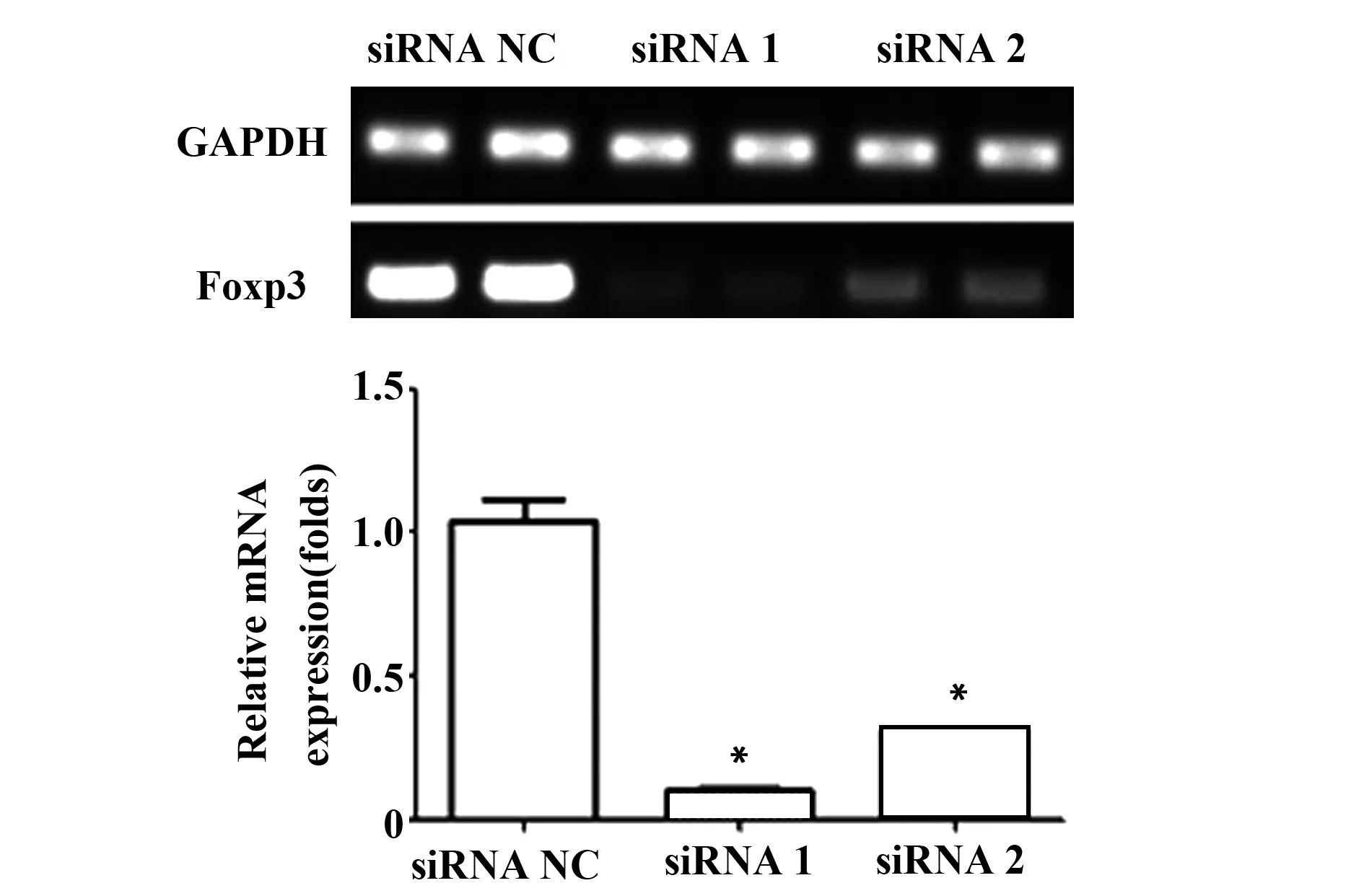
圖1 RT-PCR mRNA水平檢測Foxp3沉默效果Fig.1 mRNA expression of silencing Foxp3 was detected by RT-PCRNote: *.P<0.05,compared with siRNA NC group.
2.2Foxp3對A549細胞增殖的影響 為研究Foxp3對A549細胞增殖的影響,沉默Foxp3后采用MTT法檢測細胞增殖情況。結果顯示:沉默A549細胞Foxp3后,細胞增殖明顯減慢,siRNA1、siRNA2兩組OD值分別為2.155±0.007、1.786±0.032,明顯低于siRNANC組,差異具有統計學意義(P<0.05)。該結果表明:Foxp3可以促進A549細胞增殖,見表1、圖2。
2.3Foxp3對A549細胞周期的影響 為研究Foxp3對A549細胞周期的影響,沉默Foxp3后采用流式細胞術檢測A549細胞的細胞周期。結果顯示:沉默A549細胞Foxp3后,細胞發生G0/G1期阻滯,siRNA1、siRNA2兩組G0/G1期細胞比例分別為65.6%、64.6%,明顯高于siRNANC組50.5%,且S期細胞比例明顯低于siRNANC組,差異均具有統計學意義(P<0.05)。該結果表明:Foxp3可以促進A549細胞從G1期向S期轉化,見圖3。
2.4Foxp3對CCND1表達的調控 為研究Foxp3調控CCND1表達過程中的作用機制,首先采用細胞免疫熒光檢測A549細胞Foxp3和CCND1的定位情況。結果顯示:在A549細胞中,部分區域出現了綠色熒光(代表CCND1表達)及紅色熒光(代表Foxp3表達)的重疊區域(黃色區域),即CCND1與Foxp3的表達出現了共定位。該結果提示Foxp3與CCND1可能直接相互作用,見圖4。
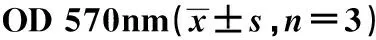
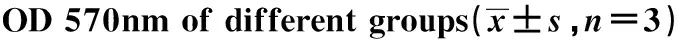

GroupsOD570nmsiRNANC2.484±0.104siRNA12.155±0.007siRNA21.786±0.032
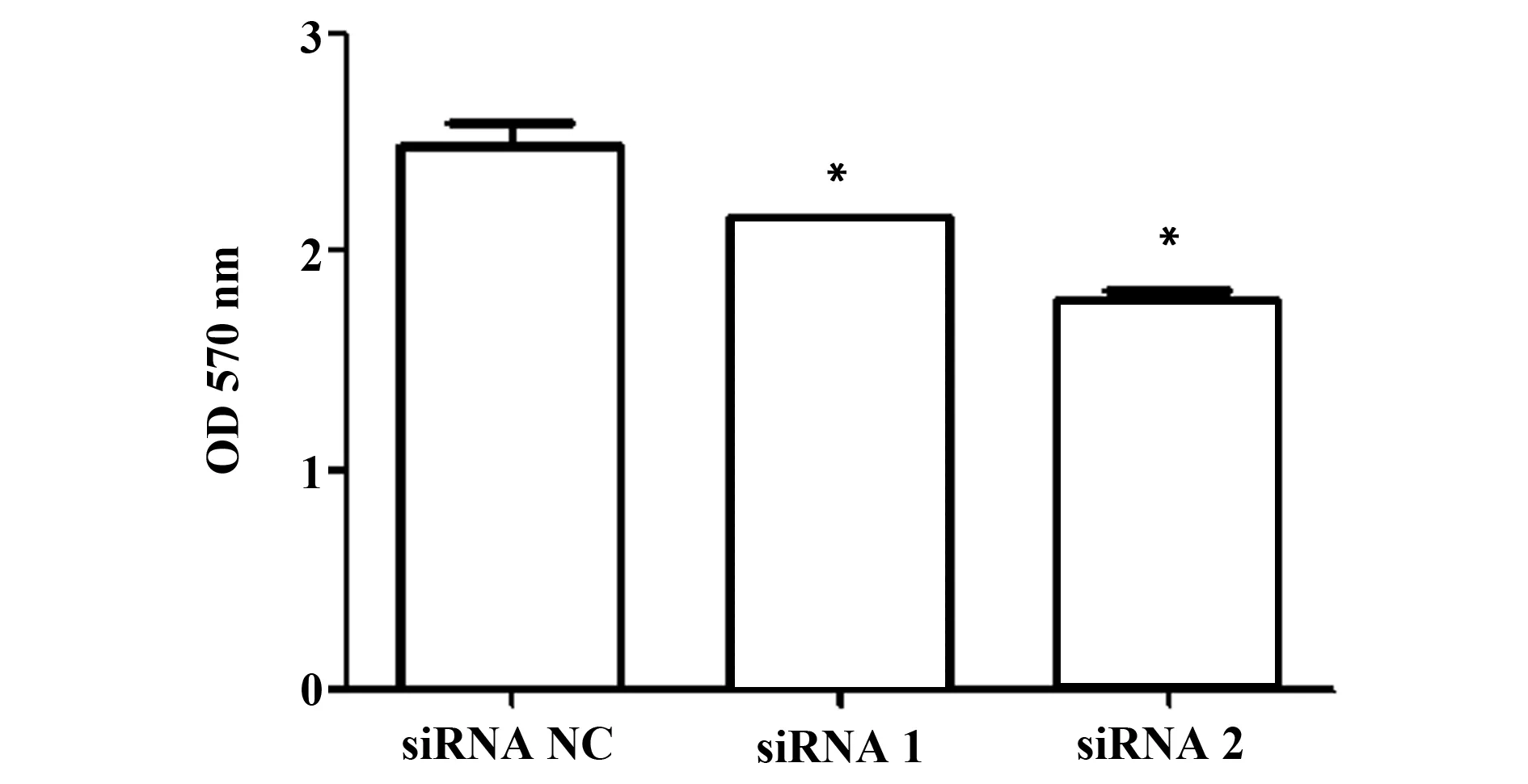
圖2 MTT檢測沉默Foxp3后A549增殖變化Fig.2 Proliferation of A549 after silencing Foxp3 was detected by MTTNote: *.P<0.05,compared with siRNA NC group.
2.5 G1/S期checkpoint基因的篩選 為研究Foxp3對A549細胞G1/S期checkpoint基因的影響,沉默Foxp3后采用RT-PCR檢測G1/S期checkpoint基因,包括CCND1、CCND2、CCND3、CCNE2、CCDE1、CDK2、CDK4、CDK6。結果顯示:沉默A549細胞Foxp3后,CCND1表達隨之降低,明顯低于siRNA NC組,差異具有統計學意義(P<0.05)。該結果表明,Foxp3可以促進A549細胞G1/S期checkpoint基因CCND1表達,見圖5。
為進一步驗證Foxp3是否對CCND1具有直接調控作用,我們構建了含有CCND1啟動子熒光素酶報告基因質粒(pGL3-CCND1-promoter)。重組質粒經雙酶切可見大小為1 143 bp的條帶,見圖6。熒光素酶報告基因檢測結果顯示:沉默A549細胞Foxp3后,CCND1啟動子熒光素酶報告基因活性明顯降低(P<0.05)。該結果明確了Foxp3對CCND1的直接調控作用,見圖7。
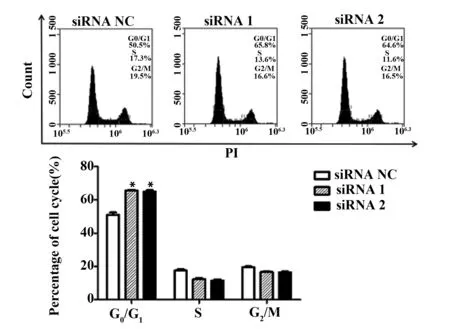
圖3 流式細胞術檢測沉默Foxp3后A549細胞周期變化Fig.3 Cell cycle of A549 after silencing Foxp3 was detected by FCMNote: *.P<0.05,compared with siRNA NC group.
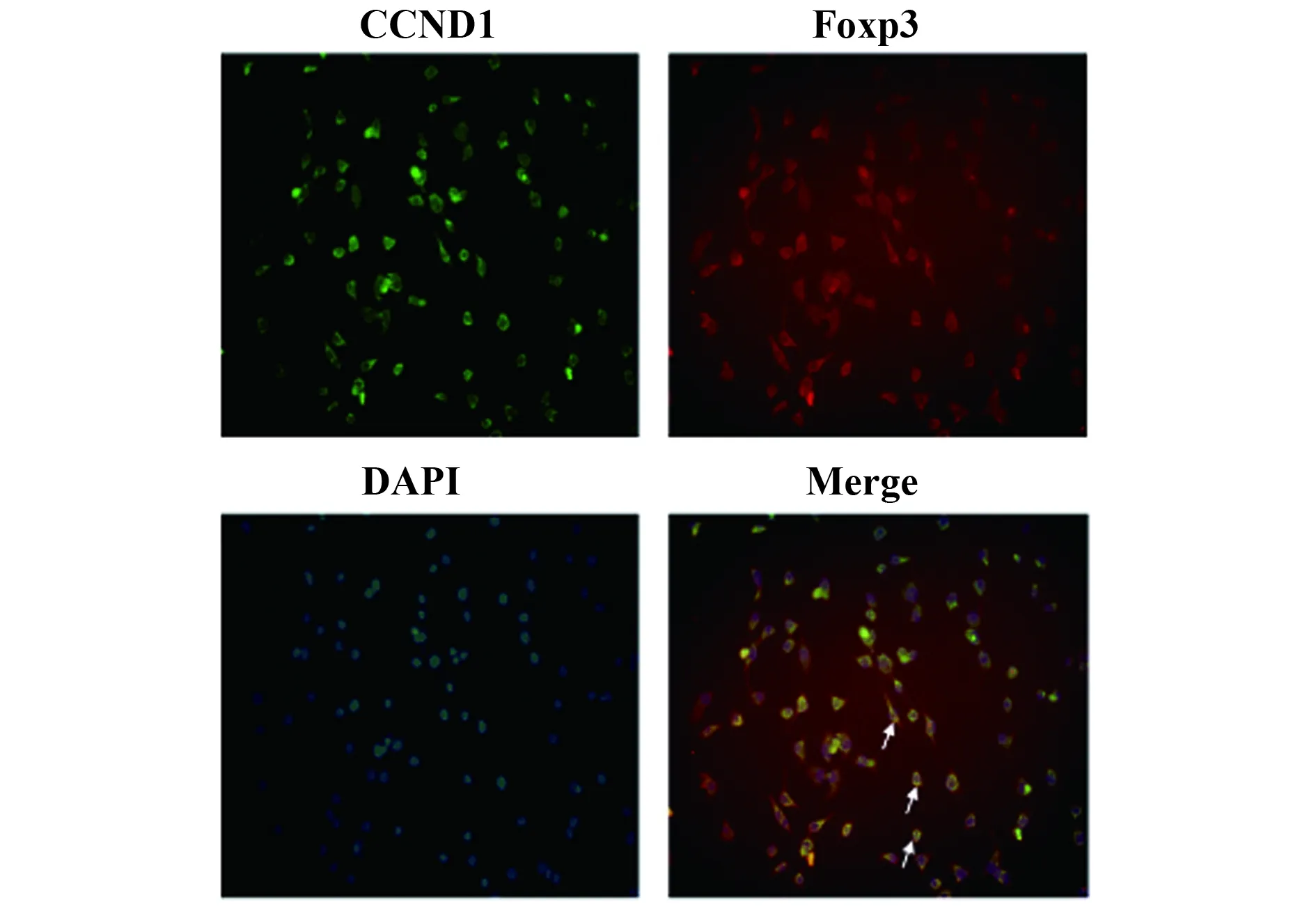
圖4 A549細胞Foxp3和CCND1的定位表達Fig.4 Expression of CCND1 and Foxp3 on A549 cell by immunofluorescences
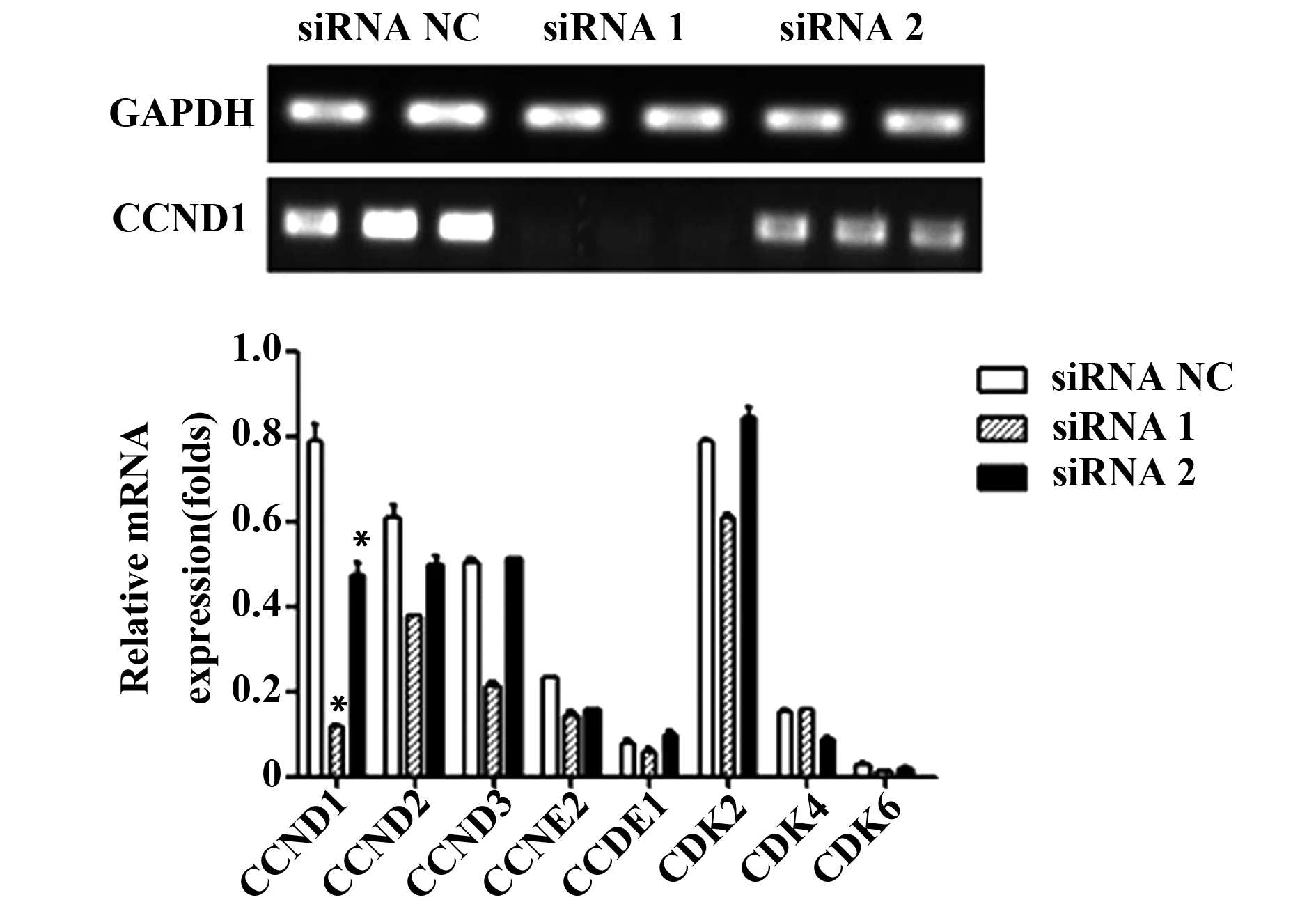
圖5 RT-PCR檢測G1/S期checkpoint基因變化Fig.5 mRNA expression of G1/S cycle checkpoint gene was detected by RT-PCRNote: *.P<0.05,compared with siRNA NC group.
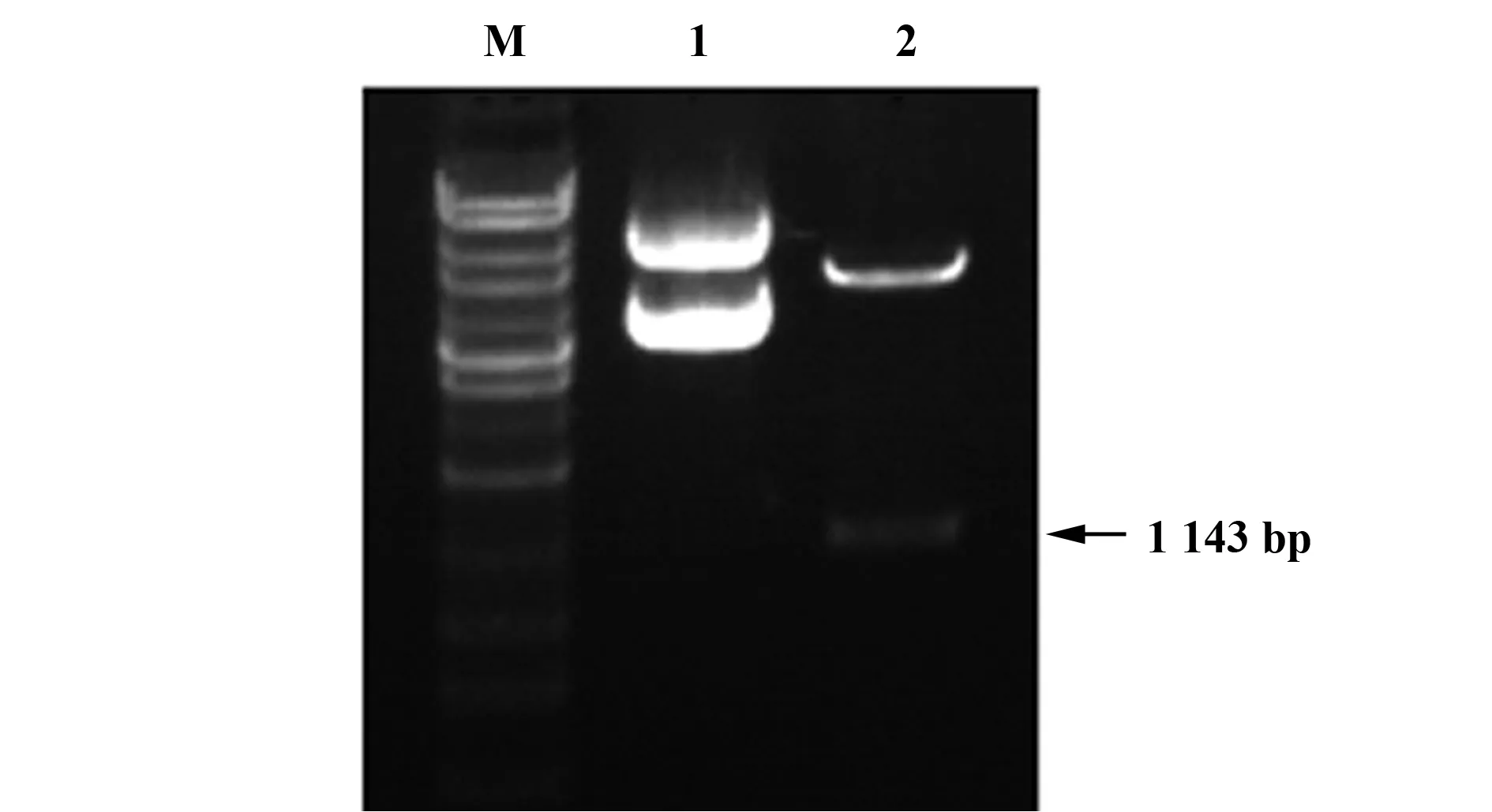
圖6 雙酶切鑒定pGL3-CCND1-promoter質粒Fig.6 Identification of eukaryotic expression plasmids by restriction endonuclease analysisNote: M.Represents marker;1.Represents pGL3-CCND1-promoter;2.Represents pGL3-CCND1-promoter PCR product after digestion.
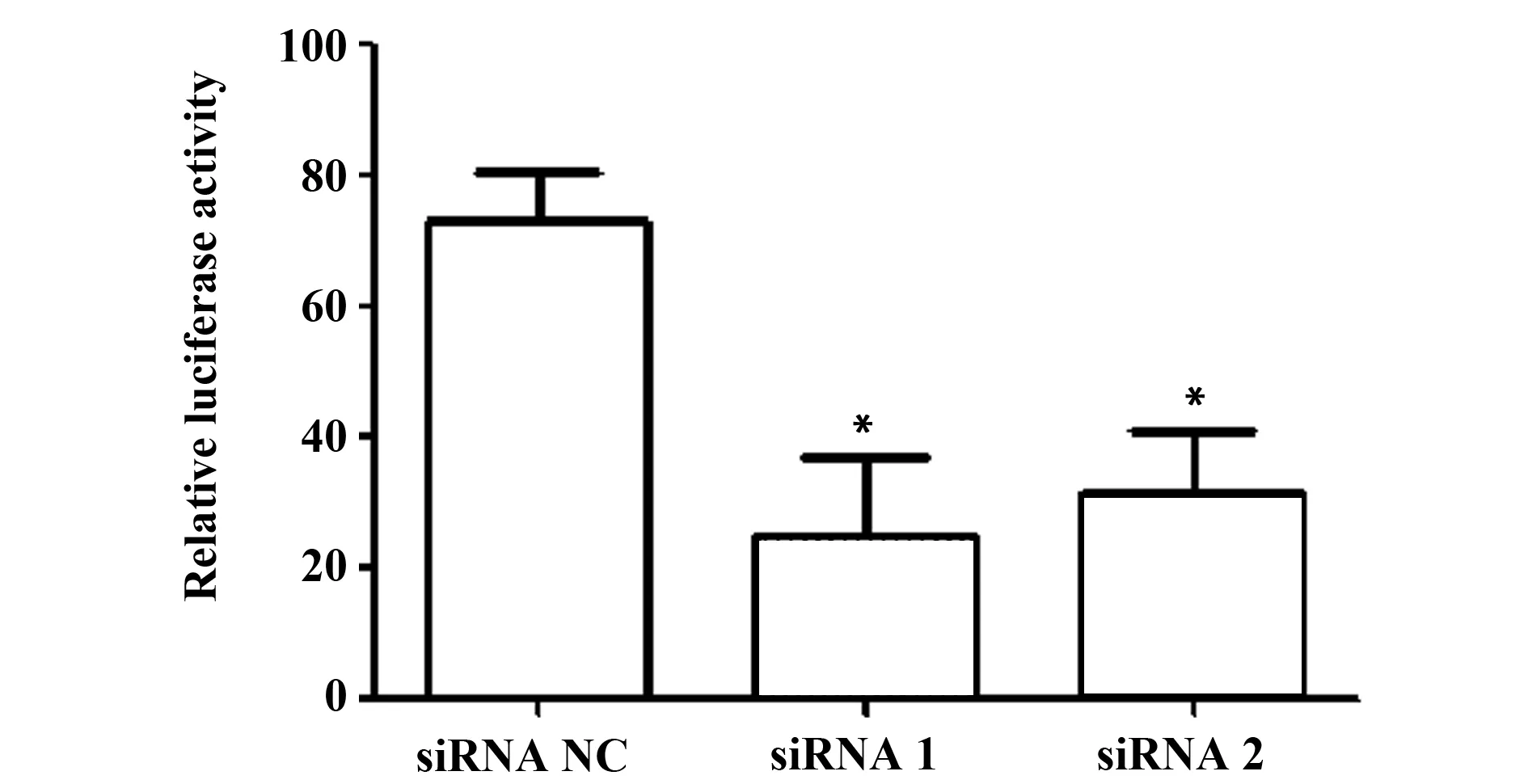
圖7 雙熒光素酶報告基因檢測Foxp3對CCND1啟動子活性的影響Fig.7 Effect of Foxp3 on activity of CCND1 promoters was detected by dual-luciferase reporter gene assayNote: *.P<0.05,compared with siRNA NC group.
3 討論
轉錄因子Foxp3是Tregs特異的標志物及細胞發育和功能的關鍵調節基因[9]。一旦Tregs缺失Foxp3,其抑制功能將隨之缺失,因此,Foxp3是維持Tregs抑制功能所必需[10]。在腫瘤微環境中,Tregs也發揮著免疫抑制作用,參與了腫瘤免疫逃逸[11,12],去除Tregs可以誘導抗腫瘤免疫,因此,Tregs是介導腫瘤免疫逃逸的關鍵細胞。最初人們認為Foxp3僅表達于淋巴細胞,而近年來越來越多的研究發現Foxp3在多種腫瘤組織及細胞中也有表達,高表達Foxp3的腫瘤病人一般預后較差[13,14]。但Foxp3在不同腫瘤中發揮的作用也不盡相同,并且相關機制研究較少。本課題組前期研究發現Foxp3在人非小細胞肺腺癌中高表達,并與淋巴結轉移和TNM分期密切相關[15]。因此,本研究以人肺腺癌細胞A549為模型,研究Foxp3在肺腺癌中的作用及相關機制。
腫瘤發生發展的關鍵之一在于腫瘤細胞的無限增殖,其本質就是細胞周期調控紊亂。本研究結果顯示,Foxp3通過促進細胞G1期向S轉化從而促進細胞增殖。因此,Foxp3在肺腺癌中發揮促腫瘤細胞生長作用,并與腫瘤細胞周期調控紊亂有密切關系。細胞周期的調控是一個精細的生物學過程,有一個復雜的分子調控網絡。細胞周期進程主要由細胞周期蛋白(Cyclin)、細胞周期蛋白依賴性激酶(Cyclin-dependent kinase,CDK)和細胞周期蛋白依賴性激酶抑制物(Cyclin-dependent kinase inhibitor,CDKI)驅動[16],在G0/G1、G2/M兩個關鍵性限制點進行調控。其中,cyclin和CDK為細胞周期正調控蛋白,CDKI為負調控蛋白。G0/G1期轉變標志DNA合成開始,G2/M期轉變標志有絲分裂開始,其中G1期向S期轉變更為重要。
本研究中我們發現,Foxp3可以促進A549細胞G1/S期checkpoint基因CCND1表達,從而促進細胞從G1期向S期轉化。CCND1是細胞周期調控蛋白家族的重要成員,屬于細胞周期素cyclin D家族,正向調控G0/G1期限制點,推動細胞從G1期進入S期,開始合成DNA,實現細胞的增殖過程[17]。CCND1的表達、激活、在核內的聚集全都發生在G1中期[18]。CCND1最初被發現于甲狀旁腺癌,是一種原癌基因,在乳腺癌、前列腺癌、膀胱癌等多種腫瘤中通過基因擴增、基因重排及突變導致過表達[19-21]。腫瘤細胞CCND1過表達可縮短G1期,促進細胞從G1期向S期轉化,加速細胞周期進程,促進細胞分裂,引起細胞周期調控紊亂,導致細胞增殖異常,從而導致腫瘤發生發展[22]。在舌鱗狀細胞癌、乳腺癌等腫瘤中,CCND1對于淋巴結轉移及預后、提高診斷陽性率均有重要意義[23-25]。但在肺腺癌中,CCND1與腫瘤的發生發展及在肺腺癌中的表達情況一直存在爭議[26]。本研究中利用雙熒光素酶報告基因實驗證實了Foxp3可直接與CCND1啟動子結合,促進其轉錄,引起細胞周期調控紊亂,加速細胞周期進程,最終導致腫瘤細胞無限增殖。這與CCND1在乳腺癌、甲狀腺癌、膀胱癌等腫瘤中發揮促癌作用的結果是一致的。但Foxp3與CCND1具體的結合位點還需要進一步研究證實。
基于上述研究結果,我們證實了在人肺腺癌中,腫瘤細胞Foxp3可直接與CCND1啟動子結合,促進其轉錄,引起細胞周期調控紊亂,促進細胞從G1期向S期轉化,加速細胞周期進程,導致腫瘤細胞無限增殖促進其發展。以細胞周期調控分子為靶點的腫瘤治療已成為一個研究熱點,Foxp3通過CCND1調控細胞周期影響細胞增殖可為腫瘤治療提供新思路。
[1] Battaglia M,Stabilini A,Draghici E,etal.Induction of tolerance in type 1 diabetes via both CD4+CD25+T regulatory cells and T regulatory type 1 cells[J].Diabetes,2006,55(6):1571-1580.
[2] 商偉菊,李 巖,梁 婧,等.胃癌患者Th17及Foxp3+調節性T細胞水平檢測及臨床意義[J].醫學與哲學,2012,33(6B):47-49.
[3] Yu-Jie L,Hai-Chao L,Yu-Xiong S,etal.Foxp3 expressed by tongue squamous cell carcinoma cells correlates with clinicopathologic features and overall survival in tongue squamous cell carcinoma patients[J].Oral Oncol,2011,47(7):566-570.
[4] Wang WH,Jiang CL,Yan W,etal.FOXP3 expression and clinical characteristics of hepatocellular carcinoma[J].World J Gastroenterol,2010,16(43):5502-5509.
[5] Ladoire S,Arnould L,Mignot G,etal.Presence of Foxp3 expression in tumor cells predicts better survival in HER2-over expressing breast cancer patients treated with neoadjuvant chemotherapy[J].Breast Cancer Res Treatment,2011,125(1):65-72.
[6] Ladoire S,Martin F,Ghiringhelli F.Prognostic role of Foxp3+regulatory T cells infiltrating human carcinomas:the paradox of colorectal cancer[J].Cancer Immunol Immunotherapy Cii,2011,60(7):909-918.
[7] 楊佳華,張文杰,呂文杰,等.shRNA-Foxp3對人胃癌BGC-823細胞增殖和凋亡的影響[J].中國實用外科雜志,2013,33(1):57-60.
[8] 陳立松,蓋曉東,歷 春.Foxp3表達對黑色素瘤B16細胞增殖的影響[J].北華大學學報(自然科學版),2014,15(5):606-609.
[9] Li B,Samanta A,Song X,etal.FOXP3 ensembles in T-cell regulation[J].Immunol Rev,2006,212(1):99-113.
[10] Williams LM,Rudensky AY.Maintenance of the Foxp3-dependent developmental program in mature regulatory T cells requires continued expression of Foxp3[J].Nat Immunol,2007,8(3):277-284.
[11] Mougiakakos D,Choudhury A,Lladser A,etal.regulatory T cells in cancer[J].Adv Cancer Res,2010,107(1):57-117.
[12] Schneider T,Kimpfler S,Warth A,etal.Foxp3+regulatory T cells and natural killer cells distinctly infiltrate primary tumors and draining lymph nodes in pulmonary adenocarcinoma[J].J Thorac Oncol,2011,6(3):432-438.
[13] Winerdal ME,Marits P,Winerdal M,etal.FOXP3 and survival in urinary bladder cancer[J].BJU Int,2011,108(10):1672-1678.
[14] Zeng C,Yao Y,Jie W,etal.Up-regulation of Foxp3 participates in progression of cervical cancer[J].Cancer Immunol Immunother,2013,62(3):481-487.
[15] Fu HY,Li C,Yang W,etal.FOXP3 and TLR4 protein expression are correlated in non-small cell lung cancer:implications for tumor progression and escape[J].Acta Histochem,2013,115(2):151-157.
[16] 邵榮光.以細胞周期調控分子為靶點的腫瘤治療[J].中國腫瘤,2005,14(11):8-10.
[17] Wen JM,Huang JF,Hu L,etal.Establishment and characterization of human metastatic hepatocellμlar carcinoma cell line[J].Cancer Genet Cytogen,2002,135(1):91-95.
[18] Masamha CP,Albrecht TR, Wagner EJ.Discovery and characterization of a novel CCND1/MRCK gene fusion in mantle cell lymphoma[J].J Hematol Oncol,2016,9(1):30.
[19] Sukov WR,Ketterling RP, Lager DJ,etal.CCND1 rearrangements and cyclin D1 overexpression in renal oncocytomas: frequency, clinicopathologic features, and utility in differentiation from chromophobe renal cell carcinoma[J].Hum Pathol,2009,40(9):1296-1303.
[20] Stahl P,Seeschaaf C, Lebok P,etal.Heterogeneity of amplification of HER2, EGFR, CCND1 and MYC in gastric cancer[J].BMC Gastroenterol,2015,15(2):7.
[21] Burandt E, Grünert M, Lebeau A,etal.Cyclin D1 gene amplification is highly homogeneous in breast cancer[J].Breast Cancer,2016,23(1):111-119.
[22] Davies L,Welch HG.Increasing incidence of thyroid cancer in the United States,1973-2002[J].JAMA,2006,295(18):2164-2167.
[23] Ullah Shah A, Mahjabeen I, Kayani MA.Genetic polymorphisms in cell cycle regulatory genes CCND1 and CDK4 are associated with susceptibility to breast cancer[J].J BUON,2015,20(4):985-993.
[24] 任曉東,牛清華.CCND1、MDM2在乳腺癌中的表達及其對于淋巴結轉移和預后的意義[J].中國醫療前沿,2012,7(3):18-20.
[25] 鄧 君,饒紹琴,黃文芳.ccnd1基因表達和其它腫瘤標志物在乳腺癌診斷中的應用[J].現代腫瘤醫學,2009,17(11):2110-2112.
[26] Rong L,She-Juan A,Zhi-Hong C,etal.Expression of cyclin D1 splice variants is differentially associated with outcome in non-small cell lung cancer patients.[J].Human Pathol,2008,39(12):1792-1801.
[收稿2015-12-15]
(編輯 許四平)
Effect and mechanism of transcription factor Foxp3 on proliferation and cell cycle of human lung adenocarcinoma cell A549
LIU Ya-Qing,ZHAO Bo,LUO Ya-Dong,LI Yi-Nan,YANG Wei.Department of Immunology,Basic Medical College,Jilin University,Changchun 130021,China
Objective:To investigate the effect and mechanism of transcription factor Foxp3 on the proliferation and cell cycle of human lung adenocarcinoma cell line A549.Methods: We knocked down the expression of Foxp3 using siRNA.Foxp3 inhibition was detected by RT-PCR.Cell proliferation was detected by MTT.Cell cycle of A549 cells were detected by flow cytometry after the transfection of siRNA.Cell cycle-related checkpoint genes were filtered by RT-PCR.The regulation of Foxp3 on cell cycle-related checkpoint genes were detected by immunofluorescence and dual-luciferase reporter assay system.Results: The proliferation of A549 cells were inhibited after silencing Foxp3,and A549 cells were arrested in G0/G1cycle.G1/S cycle checkpoint gene CCND1 was down regulated.Mechanism research show that Foxp3 can regulate the expression of CCND1 directly.Conclusion: Foxp3 can promote the proliferation of A549 cell line by up regulating G1/S cycle checkpoint gene CCND1.This provides a new target for the therapeutic targets of lung adenocarcinoma.
Foxp3;CCND1;Lung adenocarcinoma;Proliferation;Cell cycle
10.3969/j.issn.1000-484X.2016.04.009
劉亞慶(1990年-),女,碩士,主要從事腫瘤免疫學研究,E-mail:yqliu13@jlu.edu.cn。
及指導教師:李祎南(1988年-),女,博士,主要從事腫瘤免疫研究,E-mail:liyn13@mails.jlu.edu.cn。 楊 巍(1980年-),女,博士,副教授,主要從事免疫耐受方面的研究,E-mail:ywei@jlu.edu.cn。
R730.3
A
1000-484X(2016)04-0490-05