大豆蛋白自組裝纖維聚集體的界面及乳化性質研究
王金梅 陳燕瓊 王夢萍 楊曉泉
(華南理工大學輕工與食品學院食物蛋白工程研究中心,廣州 510640)
大豆蛋白自組裝纖維聚集體的界面及乳化性質研究
王金梅 陳燕瓊 王夢萍 楊曉泉
(華南理工大學輕工與食品學院食物蛋白工程研究中心,廣州 510640)
大豆分離蛋白(SPI)經酸性熱處理后可自組裝形成具有交叉β-折疊結構的纖維聚集體,研究了SPI纖維化對其界面吸附動力學、界面膜擴張流變特征及乳化性質的影響。由于纖維化過程中伴隨的蛋白水解,酸性熱處理明顯改善了SPI在等電點附近的溶解度,但中性pH處溶解度明顯下降。SPI纖維化過程中,蛋白表面壓增加速度和Ed值明顯增強,說明其擁有較高的界面活性,且增強了蛋白分子在界面上的相互作用,易于在界面形成較厚的多層結構。纖維聚集體的形成使蛋白乳液粒徑隨加熱時間延長而不斷增加,但其pH穩定性明顯增強,明顯抑制了其在中性條件下的絮凝,這一改善受加熱時間強烈影響。
大豆蛋白 自組裝 纖維聚集 界面性質 乳化性質
蛋白質在低pH(2.0)和低離子強度下加熱會發生自組裝形成纖維聚集體,其具有典型的交叉β-折疊結構(crossβ-sheet)[1]。研究者針對這一普遍現象進行形成機制研究,以期通過調控(抑制或促進)蛋白聚集進程來開發其優異的功能性質[1-2]。近年來,蛋白纖維以其剛性的β-sheet結構和良好的流變學特性(特別是彈性)引起了生物醫藥和材料等領域研究者的廣泛關注,擴展蛋白纖維聚集體應用范圍成為研究熱點。Cherny等[3]綜述了蛋白纖維作為功能性結構單元在材料科學中潛在的用途。蛋白纖維材料擁有較其他生物材料更高的強度,表現更好的優越性,可用于構建水凝膠體系,例如熱響應型水凝膠[4]。另外,在生命科學領域,蛋白纖維結構可用做支架或者配基結合體應用于器官移植等醫藥應用[5]。
在食品工業中,蛋白纖維聚集體因其良好的流變學性質,主要用作增稠劑和凝膠填充物[6]。在其理論研究領域也主要集中于纖維凝膠的構建,表征其微結構和流變學特性[7-9]。目前,蛋白纖維聚集體的界面吸附性質及其在乳液體系中的應用等領域報道較少見,且僅限于動物蛋白。Mezzenga研究團隊報道了β-乳球蛋白及其蛋白纖維在油水和汽水界面的吸附和剪切流變性質,發現蛋白纖維聚集體可以有效地穩定界面。研究者利用探針顆粒跟蹤技術深入揭示了蛋白纖維穩定界面的可能機制[10-11]。另外,有報道通過多層靜電沉積方法在乳液液滴構建甲氧基果膠/纖維多層結構來強化微膠囊,并對檸檬烯進行控制釋放[12-13]。
目前已證實,大豆蛋白在酸性pH加熱可形成纖維聚集體,且7S球蛋白聚集能力高于11S球蛋白,靜電屏蔽可以有效改善其纖維化聚集進程[14-15]。考慮到蛋白質的界面及乳化性質對于食品體系的重要指導意義,以大豆分離蛋白(SPI)為原料,著重探討蛋白纖維聚集體的形成對界面(界面吸附及界面膜擴張流變性質)和乳化性質的影響,為擴展蛋白纖維聚集體的開發利用提供參考。
1 材料與方法
1.1 材料與設備
低溫脫脂豆粕:山東禹王公司;Florisil分子篩(60~100目):Sigma公司;牛血清白蛋白(BSA)和Folin-Ciocalteu’s 試劑:北京鼎國試劑公司;金龍魚玉米油:市售;其他試劑均為分析純。
OCA20視頻光學接觸角測量儀、ODG20P界面黏彈測量儀:德國Dataphysics公司;DMA35N便攜式密度計:奧地利Anton Paar公司;CR22G型冷凍離心機:日本HITACHI公司;Dumas定氮儀:法國Elementar公司;T25高速剪切機:德國IKA公司;M-110EH-30高壓微射流納米均質機:美國MFIC公司; Mastersize2000粒度分布儀:英國Malvern公司。
1.2 試驗方法
1.2.1 SPI的制備
以料液比1∶10向低溫脫脂豆粕加入去離子水,調節其pH為8.0,室溫攪拌2 h后10 000 g離心20 min。將上清液pH調至4.5進行酸沉,10 000 g離心10 min后的蛋白沉淀重新溶于去離子水中,調節pH至中性后進行透析和凍干。Dumas法測得SPI蛋白含量為[(85.79±0.70)%, N× 5.71]。
1.2.2 SPI纖維聚集的誘導
將凍干的蛋白分散于去離子水中(2%,m/V),室溫攪拌2 h后,調節其pH至2.0,置于4 ℃水化過夜。蛋白溶液經過10 000 g離心20 min后,采用Lowry法測定上清液的蛋白含量,以BSA為標準蛋白。使用預調至pH 2.0的去離子水稀釋蛋白濃度至1%。將蛋白樣品置于帶有密封蓋的小瓶中,于85 ℃加熱不同時間,定時取樣,立即冷卻到室溫以終止蛋白纖維化。電鏡圖片證實,大豆蛋白在pH 2.0條件下加熱誘導20 h后,形成了“蠕蟲狀”扭曲螺旋的蛋白纖維聚集體。
1.2.3 溶解度
將纖維化的蛋白溶液經過室溫10 000 g離心20 min后,采用Lowry法測定上清液的蛋白含量,以BSA為標準蛋白制作標準曲線。
溶解度=上清液蛋白質質量/樣品蛋白質質量×100%。
1.2.4 界面張力的測定
選擇玉米油為油相,考慮到其含有少量表面活性成分可能影響測試,使用前對其純化處理,具體參見Gaonkar[16]方法:向100 mL玉米油中加入3 g Florisil吸附劑,攪拌、靜置和離心后,再加入新的吸附劑,重復操作,直至去離子水界面張力在30 min內不發生明顯變化。純化玉米油密度為0.915 6 g/cm3,去離子水的界面張力為(25.5±0.5) mN/m。
采用動態滴形分析法檢測纖維化蛋白在O/W界面上的界面張力(σ)隨吸附時間(θ)的變化,步驟參考Wang等[17]方法。將連接在毛細管上的不銹鋼針(外徑1.65 mm,內徑1.19 mm)插入盛有油相的玻璃槽內。將蛋白溶液(1 mg/mL)置于注射器中,靜置至樣品溫度平衡,由電動注射單元通過毛細管推入樣液,在針尖上形成15 μL的液滴。在室溫下,視頻攝像系統立即連續采集液滴的外形圖象,計算獲得σ隨θ的變化,采集時間持續 180 min。動態界面張力為表面壓力(π) 隨吸附時間的變化,π=σ0-σ,式中:σ為蛋白樣品的表面張力;σ0為緩沖液的值,室溫條件測得σ0=(25.5 ± 0.5) mN/m。
1.2.5 界面膜擴張流變性質的測定
采用動態滴形分析結合振蕩滴技術,研究纖維化蛋白在O/W界面上的界面擴張模量(E)、界面擴張彈性模量(Ed)及界面擴張黏性模量(Ev)隨吸附時間(θ)的變化,方法詳見Wang 等[17]方法。將蛋白溶液(1 mg/mL)置于注射器中,注射形成10 μL液滴后,使用ODG振蕩發生器對其施以周期性正弦振蕩,液滴的表面積(A)發生擴張應變,從而引起σ的變化(擴張應力)。O/W界面形成1 min后開始收集σ,每個測量點是5個周期(50 s)內的平均值,測試在室溫下進行,重復2次,其界面張力檢測結果誤差為±0.5 mN/m,相應地擴張模量檢測結果誤差為± 4 mN/m。液滴在適當的頻率(f)和振幅(ΔA/A0)條件下正弦規律振蕩,本試驗f恒定為0.1 Hz,ΔA/A0為10%,處于線性黏彈性范圍內,試驗持續180 min。
線性黏彈性界面擴張模量(E, mN/m)是評定膜抗形變能力的參數,其絕對值是材料對彈性形變和黏性形變的總形變阻力,定義為界面張力(σ, mN/m)變化與界面面積(A, m2)相對變化的比值見式(1)。界面擴張模量由2個獨立的部分組成,即彈性模量(Ed, mN/m)和黏性模量(Ev, mN/m),擴張模量可寫作復數形式,見式(2)。
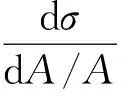
(1)
E=|E|cosθ+i|E|sinθ=Ed+iEv
(2)
1.2.6 乳液的制備及表征
將一定量不同加熱時間的SPI纖維聚集體(pH 2.0)與玉米油混合,并加入0.02%(m/V) 疊氮鈉抑制微生物生長。常溫下,混合物經預乳化后 (5 000 r/min, 2 min)進行微射流處理二次(40 MPa),制備成蛋白含量為0.5 g/100 mL,含油量為10%(m/V)的乳液。將乳液pH調節至設定值(2.0、4.5和7.0)待測。
采用Mastersizer 2000 粒度分布儀測定乳液液滴的粒徑。參數為:顆粒折射率:1.520;顆粒吸收率:0.001;分散劑:水;分散劑折射率:1.330。試驗采用體積平均直徑(d43)表征液滴粒度的大小。乳液的絮凝率(FD%)=(d43-d43SDS)/d43SDS×100[18],其中d43SDS為加入SDS所測得的d43。
2 結果與分析
2.1 蛋白纖維化過程中溶解度的變化
蛋白質溶解性與其乳化性質密切相關,溶解性較好樣品一般具有較好的乳化性。明確酸性條件熱處理蛋白的溶解情況將有助于其在食品加工中的合理利用,對SPI纖維化進程中溶解度的變化進行監測,結果見圖1。隨著加熱時間的延長,在等電點附近 (pH 5.0) 的溶解度不斷上升,而在中性(pH 6.0~8.0)范圍內不斷減小,特別是加熱12 h,纖維聚集體在pH 8.0仍具有較低的溶解性。可以從蛋白質在酸性條件下發生水解和隨之產生的蛋白纖維化聚集角度來理解此現象[14-15]。纖維化過程中部分發生聚集,部分以多肽形式存在,這導致了蛋白在等電點處溶解度的升高,隨著水解的加劇,溶解度逐漸上升,而纖維聚集體這一剛性結構的形成則降低了溶解度。
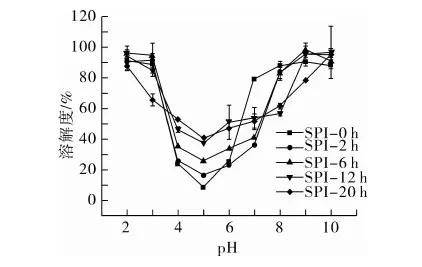
圖1 SPI纖維化過程中溶解度的變化
2.2 界面吸附動力學
圖2為SPI纖維聚集體在O/W界面上的表面壓隨時間的變化。整體來看,樣品間差異較明顯。天然SPI在吸附初期擁有最小的π值,隨著吸附時間增加而逐漸上升,且上升速度慢慢趨于平緩,這表明蛋白不斷在界面上完成吸附。在初始吸附階段,纖維聚集體出現了較高的π值,且隨著加熱時間延長而逐漸升高,且吸附后期π值也不斷升高。這說明,酸性條件下熱處理使蛋白質的界面活性明顯提高。從能壘角度考慮,這可能是由于伴隨加熱發生的蛋白水解使其結構處于去折疊狀態,降低了蛋白在O/W界面上吸附的能壘,克服了因聚集體尺寸變大而帶來的擴散速度減小,進而引起表面壓的整體提高。另外,蛋白水解產生的小分子量多肽也可能促進了表面壓的快速增加。Jung等[10]對β-乳球蛋白纖維聚集體的O/W界面吸附進行表征,發現酸熱處理蛋白的高表面活性主要來自于加熱過程中未轉化成纖維聚集體的多肽。
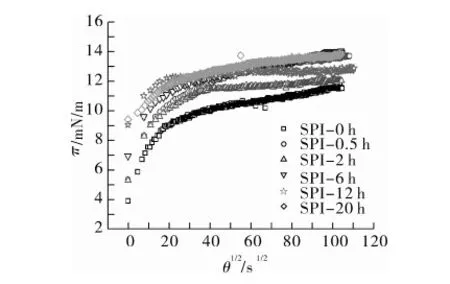
注:SPI-0h表示天然SPI,體相蛋白質量濃度1 mg/mL。
圖2 SPI纖維聚集體在O/W界面隨吸附時間變化(θ1/2)的表面壓變化(π)
2.3 界面膜擴張黏彈特性
圖3反映了不同時間加熱誘導纖維聚集體的界面膨脹模量E隨π值增加的變化情況,以反映界面上蛋白分子的結構特征和分子間相互作用。E-π曲線斜率的增加往往代表界面上吸附分子間相互作用的增強。由圖3可知,隨著蛋白不斷吸附到O/W界面上(π值的增加),所有樣品的E都不斷增加,且擴張彈性模量(Ed) 明顯大于黏性模量(Ev)(數據未列出),這說明蛋白質在界面上形成了黏彈性吸附膜,且蛋白分子間相互作用的存在和增強。纖維聚集體的形成明顯地增加了E-π曲線的斜率,且隨著加熱時間的延長而上升,意味著SPI纖維的生長增強了界面上蛋白分子間的相互作用。另外,長時間加熱誘導的纖維聚集體自身擁有更有序的結構,導致其流變學特性的增強,當它在O/W界面上吸附也就導致了其界面黏彈性的增加。

注:SPI-0h表示天然SPI,體相蛋白質量濃度1 mg/mL,測試頻率為0.1 Hz,振幅為10%。
圖3 SPI纖維聚集體在O/W界面上的擴張黏彈模量(E)隨表面壓 (π) 的變化
當加熱時間延長到20 h后,出現明顯不同的E-π曲線變化趨勢。π值增加到16 mN/m時,E值達到最大,隨著π值的持續增加,E值卻逐漸下降。這可能是由于纖維聚集體在界面上發生的去折疊和隨之而來的構象改變也許導致了蛋白聚集體固有剛性結構的破壞[19-20]。Freer等[19]曾研究了溶菌酶在十六烷/水界面上吸附膜的擴張流變特性,研究發現,在吸附初期,伴隨著蛋白在界面發生部分去折疊和聚集而出現界面黏彈模量隨π值增加而逐漸增加,經過長時間的吸附,蛋白質在界面形成了多層結構引起了界面黏彈模量的劇烈下降。以上所述現象與此結果一致,由此可推測,SPI纖維聚集體較為疏松的空間狀態可能導致其在O/W界面上形成較厚的界面吸附層,纖維聚集體可能在界面上定向排列,導致多層界面結構的出現。
圖4為纖維聚集體的界面吸附層膨脹彈性模量(Ed)隨時間的變化情況。不同加熱時間樣品的Ed隨時間變化明顯不同。天然SPIEd值表現為逐漸增加的趨勢,與其他球蛋白一致[21]。短時間加熱沒有改變Ed值變化趨勢,長時間加熱形成的纖維聚集體在吸附初期就表現了較高的Ed值,可能說明蛋白分子間快速發生相互作用。隨著吸附時間延長,纖維聚集體Ed值迅速增加,這可能來自于纖維聚集體本身固有的有序剛性結構。有報道稱,β-乳球蛋白纖維可以有效地穩定O/W界面,且認為蛋白纖維的穩定機制明顯不同于天然蛋白,可以將蛋白纖維理解為具有表面活性的納米膠體顆粒,這種顆粒的剛性結構可以使蛋白在界面吸附的過程中誘發二維結晶相的形成,進一步增強了界面穩定性[10-11]。

注:SPI-0h表示天然SPI,體相蛋白質量濃度1 mg/mL,測試頻率為0.1 Hz,振幅為10%。
圖4 SPI纖維聚集體的O/W界面吸附層的膨脹彈性模量隨時間的變化
2.4 蛋白纖維聚集體的乳化性質
鑒于蛋白酸性熱處理后具有較快的降低表面張力的能力,且蛋白在界面上形成的吸附膜具有較強的膨脹黏彈模量,這些特征都有利于蛋白對O/W界面的穩定。因此,本文嘗試驗證是否纖維聚集體的形成有利于其乳化性質的提高。圖5為蛋白纖維聚集體穩定乳液的粒徑分析。短時間加熱會輕微減小蛋白乳液的粒徑。遺憾的是,隨著加熱時間延長,盡管界面活性顯著提高(圖2),但纖維聚集體的形成使蛋白乳液粒徑隨加熱時間延長而不斷增加,未能改善其乳化性質。高壓均質乳化時,由于大粒徑分子具有較高的對流傳質速度,均質產生的巨大湍流可促進蛋白聚集體在界面上的優先吸附。因此,纖維聚集體的空間位阻作用可能導致蛋白分子不能很好的覆蓋油滴,阻止油滴的重新聚結,最終表現為較大的液滴粒徑[22]。由此可知,可以通過控制蛋白的加熱時間來調控纖維聚集體乳液的粒度。需要指出,所有乳液粒徑都小于1 μm,可以認為纖維聚集體乳液仍是一個較為穩定的乳液體系。
圖6為不同pH條件下乳液粒度和絮凝率的變化。所有乳液在pH 2.0時均有較小的粒度和絮凝率。調節乳液pH至4.5時,乳液粒徑和絮凝率均明顯增加,這可能是由于蛋白在等電點附近,其表面電荷減小導致液滴之間的靜電排斥力減弱,發生絮凝。值得注意的是,纖維聚集體乳液的粒徑和絮凝率明顯小于天然SPI(0 h),且隨加熱時間延長呈現逐漸減小的趨勢。這可能歸因于蛋白在等電點處溶解度的提高(圖1)。當乳液pH為7.0時,乳液粒度和絮凝率均明顯下降。長時間加熱誘導的纖維聚集體乳液較天然SPI乳液擁有更小的粒徑和絮凝率,這說明纖維聚集體的形成明顯抑制了蛋白乳液在中性條件下的絮凝,這一改善受加熱時間強烈影響。值得注意的是,纖維聚集在pH 7.0溶解度小于天然SPI,因此溶解度可能不是乳液絮凝改善的直接原因,乳液界面結構也許與之相關。纖維聚集體增強的界面膜黏彈特性支持了以上推斷(圖3、圖4)。

注:SPI-0h表示天然SPI。
圖5 SPI纖維聚集體穩定乳液的液滴粒徑大小(d43)
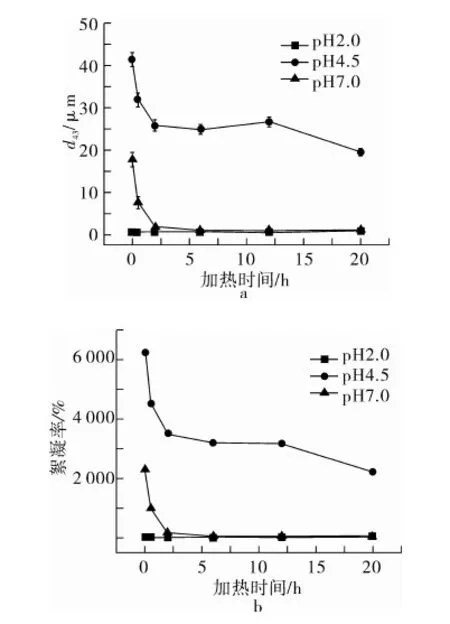
圖6 pH對SPI纖維聚集體乳液粒度(d43)和絮凝率的影響
3 結論
SPI經酸性條件熱處理后,等電點附近的溶解度明顯改善,但中性pH處溶解度明顯下降。蛋白的表面壓增加速度和幅度隨著熱處理時間的延長明顯增強,證實其擁有較高的界面活性。界面擴張特征參數變化證實,大豆蛋白纖維聚集體的Ed值及其增長速度明顯高于天然SPI,且隨加熱時間的延長而不斷提高,說明纖維聚集體的形成和生長增強了蛋白分子在界面上的相互作用,長時間吸附后,E值慢慢下降,易于形成多層界面結構。纖維聚集體的形成使蛋白乳液粒徑隨加熱時間延長而不斷增加,但其pH穩定性明顯增強,明顯抑制了蛋白乳液在中性條件下的絮凝,這一改善受加熱時間強烈影響。以上理解將有利于拓展蛋白纖維聚集體在真實乳液食品體系中的應用。
[1]Lara C, Adamcik J, Jordens S, et al. General self-assembly mechanism converting hydrolyzed globular proteins into giant multistranded amyloid ribbons [J]. Biomacromolecules, 2011, 12 (5): 1868-1875
[2]Jones O G,Mezzenga R. Inhibiting, promoting, and preserving stability of functional protein fibrils [J]. Soft Matter, 2012, 8(4): 876-895
[3]Cherny I,Gazit E. Amyloids: not only pathological agents but also ordered nanomaterials [J]. Angewandte Chemie International Edition, 2008, 47 (22): 4062-4069
[4]Bakota E L, Aulisa L, Galler K M, et al.Enzymatic cross-linking of a nanofibrous peptide hydrogel [J]. Biomacromolecules, 2011, 12 (1): 82-87
[5]Jung J P, Gasiorowski J Z, Collier J H. Fibrillar peptide gels in biotechnology and biomedicine [J]. Biopolymers, 2010, 94(1): 49-59
[6]Van der Linden E. From peptides and proteins to micro-structure mechanics and rheological properties of fibril systems [J]. 2012, 26(2): 421-426
[7]Sagis L M C, Veerman C, Ganzevles R, et al. Mesoscopic structure and viscoelastic properties ofβ-lactoglobulin gels at low pH and low ionic strength [J]. Food Hydrocolloids, 2002, 16(3): 207-213
[8]Weijers M, Sagis L M C, Veerman C, et al. Rheology and structure of ovalbumin gels at low pH and low ionic strength [J]. Food Hydrocolloids, 2002, 16(3):269-276
[9]Zhang Y H, Tang C H, Wen Q B, et al. Thermal aggregation and gelation of kidney bean (Phaseolus vulgaris L.) protein isolate at pH 2.0: Influence of ionic strength [J]. Food Hydrocolloids, 2010, 24(4): 266-274
[10]Jung J M, Gunes D Z, Mezzenga R. Interfacial activity and interfacial shear rheology of nativeβ-lactoglobulin monomers and their heat-induced fibers [J]. Langmuir, 2010, 26(19): 15366-15375
[11]Isa L, Jung J M, Mezzenga R. Unravelling adsorption and alignment of amyloid fibrils at interfaces by probe particle tracking [J]. Soft Matter, 2011, 7(18): 8127-8134
[12]Rossier-Miranda F J, Schro?n K, Boom R. Mechanical characterization and pH response of fibril-reinforced microcapsules prepared by layer-by-layer adsorption [J]. Langmuir, 2010, 26(24): 19106-19113
[13]Humblet-Hua K N P, Scheltens G, van der Linden E, et al. Encapsulation systems based on ovalbumin fibrils and high methoxyl pectin [J]. Food Hydrocolloids, 2011, 25(4): 569-576
[14]Tang C H,Wang C S. Formation and characterization of amyloid fibrils from soy β-conglycinin and glycinin [J]. Journal of Agricultural and Food Chemistry, 2010, 58(20): 11058-11066
[15]Tang C H, Wang C S, Huang Q. Improvement of heat-induced fibril assembly of soy β-conglycinin (7S Globulins) at pH 2.0 through electrostatic screening [J]. Food Research International, 2012, 46(1): 229-236
[16]Gaonkar A G. Interfacial tensions of vegetable oil/water systems: Effect of oil purification [J]. Journal of the American Oil Chemists' Society, 1989, 66(8): 1090-1092
[17]Wang J M, Xia N, Yang X Q, et al. Adsorption and dilatational rheology of heat-treated soy protein at the oil-water interface: relationship to structural properties. Journal of Agricultural and Food Chemistry, 2012,60(12), 3302-3310
[18]Kim D A, Cornec M, Narsimhan G. Effect of thermal treatment on interfacial properties of β-lactoglobulin [J]. Journal of Colloid Interface Science, 2005, 285(1): 100-109
[19]Freer E M, Yim K S, Fuller G G, et al. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: comparison of shear and dilatation deformation [J]. Journal of Physical Chemistry B, 2004, 108(12): 3835-3844
[20]Freer E M, Yim K S, Fuller G G, et al. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface [J]. Langmuir, 2004, 20(23): 10159-10167
[21]Patino J M R, Nino M R R, Sanchez C C. Adsorption of whey protein isolate at the oil-water interface as a function of processing conditions: A rheokinetic study [J]. Journal of Agricultural and Food Chemistry, 1999, 47(6): 2241-2248
[22]Guilmineau F,Kulozik U. Impact of a thermal treatment on the emulsifying properties of egg yolk. Part 1: effect of the heating time [J]. Food Hydrocolloids, 2006, 20(8): 1105-1113.
Interfacial and Emulsifying Properties of Self-Assembly Fibrillar Aggregates from Soy Protein
Wang Jinmei Chen Yanqiong Wang Mengping Yang Xiaoquan
(Research and Development Center of Food Proteins, Department of Food Science and Technology,South China University of Technology, Guangzhou 510640)
Soy protein isolate (SPI) could convert to fibrillar aggregates with crossβ-sheet structure under self-assembly upon acidity heating treatment at pH 2.0. The influence of SPI fibrillation on the interfacial (adsorption at the oil-water interface and dilatational rheology of interfacial layers) and emulsifying properties of SPI was evaluated. The solubility of fibrillar aggregates at near isoelectric point was obviously improved due to polypeptide hydrolysis during the fibrillation of SPI, while the solubility was significantly decreased at neutral pH. During the fibrillation of SPI, higher interfacial activity was supported by the increase in the increase speed of protein surface pressure and Ed value, and interactions between protein molecules on the interface was enhanced,leading to the formation of the thicker multilayer structure. The formation of fibrillar aggregates maked protein emulsion particle diameter increased with the prolonging of heating time, but its pH stability was enhanced significantly, which significantly suppresses the flocculation under nuetural conditions, while such improvements were influenced by heating time.
soy protein, self-assembly, fibrillar aggregates, interfacial properties, emulsifying properties
TS201.1
A
1003-0174(2016)12-0033-06
國家自然科學基金(31301432, 31371744)
2015-05-12
王金梅,女,1982年出生,講師,植物蛋白加工與利用
楊曉泉,男,1965 年出生,教授,植物蛋白加工與利用

