馬錢子對臍血源性神經干細胞巢蛋白mRNA表達的影響
陳敬國+鄂桂娟+方慧云
【中圖分類號】R615 【文獻標識碼】A 【文章編號】2095-6851(2016)12-0-01
巢蛋白表達最初開始于胚胎早期的神經前體細胞,在胚胎腦中主要以時空序列的方式進行表達,當前巢蛋白已經成為神經肝細胞的標記蛋白,常常被用于神經干細胞的分離、鑒定以及培養中[1]。巢蛋白 mRNA 在哺乳類動物中樞神經系統發育中的表達具有區域相關性,其表達的強弱可反映某些區域內神經細胞的增殖活性[2]。本文筆者運用采用RT-PCR方法對臍血單個核細胞培養前后及馬錢子誘導培養后巢蛋白mRNA表達進行檢測,現將試驗方法和試驗結果簡單匯報如下:
1.資料與方法
1.1 材料
1.1.1 臍血來源。臍血主要是用肝素抗凝采血袋從本院產科無菌收集健康產婦足月妊娠順產或剖宮產的嬰兒臍帶血50~100ml,性別不限,均獲得產婦極其家屬同意用于科研中,并且獲得我院倫理委員會的同意,簽署了知情同意書,所有產婦均身體健康、無結核、肝炎、獲得性免疫缺陷綜合癥、梅毒等傳染病,新生兒均無先天性畸形。將臍血充分混勻后,置保溫盒中。
1.1.2 主要試劑。DMEM培養基購自Gibco公司。新生牛血清:杭州四季青生物工程材料研究所產品。淋巴細胞分離液(1.077 g/cm3):天津血液病研究所產品。瓊脂糖為Sigma公司產品。RNA提取試劑盒為上海生物工程公司產品,RevertAidTM First StrandcDNA Synthesis Kit為MBI Fermentas公司產品。其他PCR試劑均購自Promega公司。
1.2 方法
1.2.1 臍血MNCs的分離方法。密度梯度離心法分離臍血MNCs。用酒精棉球擦拭采血袋的塑料導管,以無菌手術剪刀剪斷塑料管,然后將血袋內的抗凝臍血導入一250 ml無菌生理鹽水瓶中,用無菌的PBS(pH7.0)等體積稀釋,輕輕震蕩搖勻。取數個50 ml的無菌帶蓋離心管,先加入1.077 g/cm3的淋巴細胞分離液20~25 ml,無菌吸管吸取稀釋后的臍血25~30ml,離液面約1 cm處緩慢加入,應形成一明顯的界面,上下液體勿混合。2 000 r/min離心25 min,小心吸取中間的白膜層。加入7~10倍體積的PBS緩沖液,1 000 r/min、10 min離心洗滌3次,棄上清。所得MNCs經臺盼藍染色、光學顯微鏡下計數,調整至適當細胞密度用于細胞培養,并凍存部分細胞于液氮中備用[3]。
1.2.2 細胞培養與收集 以1.0×106ml-1(T-25培養瓶)的密度接種于含體積分數20%胎牛血清的DMEM培養液中,置于37℃、含體積分數為5%的CO2飽和濕度培養箱內培養。在培養過程中,每3 d換液1次。15 d后,培養物在200 r/min搖動約30min,收集、離心洗滌細胞;將凍存的未培養的細胞解凍、離心洗滌。在顯微鏡下,臺盼藍染色、計數,調整細胞密度備用。另一組細胞加用馬錢子粉。
1.2.3 引物設計與合成 采用相關軟件設計RT-PCR引物。nestin引物(上游引物N1:5-AGG ATG TG AGGTAGTGAGA-3,下游引物N2:5-TGGAGATCTCAGTGG CTCTT-3),內對照β-actin引物(上游引物A1: 5-GGC ATG GGT CAG AAG GATTCC-3,下游引物A2:5-ATGTCA CGC ACG ATTTCC CGC-3)。均由上海生物工程公司合成。
1.2.4 RT-PCR RNA提取及cDNA合成參照試劑盒說明進行。在完成cDNA合成之后進行PCR擴增。在Ependoff管中依次加入下列物質:10 mmol/L 4×dNTP 1 ml,Taq酶0.5 ml (5 u/ml), cDNA5 ml,特異性引物1、2各1 ml,內對照引物0.3 ml, 10×緩沖液5 ml, ddH2O36.2 ml。PCR擴增條件為:94℃1 min, 94℃30 s,57℃30 s,72℃30 s,40個循環后,72℃延伸7 min。
1.2.5 擴增產物的檢測 取10ml加有載樣緩沖液的擴增產物加樣至含有溴化乙錠(EB)、質量分數為2%的瓊脂糖凝膠中,在電壓5~10 V/cm下電泳60min后,置紫外透射儀下觀測結果,并利用凝膠掃描成像系統照相[4]。
2.結果
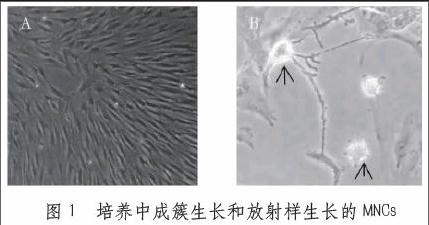
2.1 臍帶MNCs的形態極其活性
每一根臍帶分離到的MNCs數量為(4.13—6.41)×105個/L,細胞的活性高達96.71%—99.72%。運用倒置相差顯微鏡進行觀察,新鮮分離出來的MNCs胞體表現為圓形,將其接種大約48小時左右,有近25%的細胞由圓形變成了梭形,并且細胞開始貼壁,在72小時偶貼壁細胞的數量不斷增多,而發生細胞形態變化明顯,最終表現為長梭形,彼此之間緊密排列在儀器。在細胞培養10天后,可以看到1-2個HP胞體較大,還可以發現一些放射狀的突觸神經樣細胞,并且各個細胞表現的形態也不盡相同,具體如圖1所示。在培養30天后,細胞表現出不規律生長,因此無法根據其形態進行判斷。
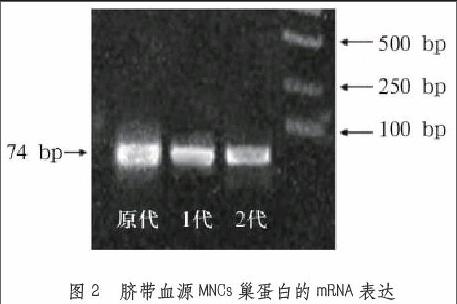
2.2 臍帶血源MNCs巢蛋白的mRNA表達分析
具體表達情況如如圖2所示。沒有培養的原代細胞和傳代細胞的巢蛋白mRNA均表現為陽性,原代細胞巢蛋白的mRNA相對表達量為2.64±0.42,第一代細胞的表達量為1.71±0.19,第二代細胞的表達量為0.26±0.06。
3.討論
巢蛋白在多器官、多細胞均有分布,尤以胚胎期分布為廣泛,目前已可在胚胎干細胞可分化的幾乎所有類型的組織細胞中發現表達,如神經系統、胰腺、肝臟、心肌、骨骼肌、牙齒、腎上腺、發囊、皮膚、睪丸和胃腸道及多系統腫瘤均有分布。王軍[5]等學者經過試驗證實臍帶中的MNCs總量常常高于血液和羊水中的總量,跟骨髓血中提取的MNCs比較相似,都具有多向分化的功能,這跟國外Lee[6]等學者的研究結果一致。
馬錢子原名番木鱉,為馬錢科馬錢子屬植物馬錢及云南馬錢的干燥成熟種子。臨床應用非常廣泛,化學成分含有多種生物堿,番木鱉堿(即士的寧)為馬錢子的最主要成分。約占總生物堿的45%。士的寧對整個中樞系統都有興奮作用。首先興奮脊髓的反射機能,其次興奮延髓的呼吸中樞及血管運動中樞,并能提高大腦皮質的感覺中樞機能。小劑量的士的寧能加強皮質的興奮過程,促使處于抑制狀態的患者蘇醒,還能提高味覺,觸覺,聽覺和視覺等感官器官的功能。
在本文中,筆者運用采用RT-PCR方法對臍血單個核細胞培養前后及馬錢子誘導培養后巢蛋白mRNA表達進行檢測來探討馬錢子對臍血原性神經干細胞巢蛋白mRNA表達產生的影響,結果發現,臍血MNCs呈巢蛋白mRNA陽性表達,并且其表達量在傳代后數量明顯減少.該研究結果跟烏優圖,王運杰[7]等研究結果一致。但是這并非意味著細胞中神經前體細胞的數量在減少,其主要是因為:首先上述變化跟巢蛋白在神經前體細胞向神經細胞分化時表現出來的變化是一致的,其次是發生的該變化可能跟細胞的橫向分化存在關聯。有研究指出[8]:臍血細胞在培養8天后能夠發現少數表現出放射狀突起類似神經樣細胞的生長形態,這些突出的形態跟樹突、軸突等形態相似,即便在傳代以后,依然有類似的細胞產生,但是在傳代5次之后,絕大部分的細胞表現為表皮樣生長或者無規則形態生長,無法找到神經樣細胞,這對這種情況可能是MNCs自發分化成神經前體細胞導致的,但是這些神經樣細胞在移植之后是否能夠表現出神經元功能還有待研究。
綜上所述,利用無菌的產婦足月妊娠順產或剖宮產的嬰兒臍帶血分離培養的原代細胞具有巢蛋白mRNA的表達,并且其傳代以后的基因也依然有表達,如此便證實了其具有分化成神經細胞的潛能,雖然在傳代之后的數量有一定程度減少,但是依然可以作為穩定、可靠的細胞供體,不僅如此,根據MNCs培養時出現的各種形態的類神經樣細胞,如此便證實了MNCs中可能存有一定的神經前體細胞,并且該細胞今后還有可能成為治療神經系統疾病的種子細胞之一。
參考文獻
[1]齊凱,董麗媛,陳顯久.人臍帶來源間充質干細胞分離培養方法的優化[J].中國組織工程研究與臨床康復. 2011.15(23)4220-4224.
[2]陳海,王軍,范亞珍,等. 人臍血源性神經干細胞中Nestin基因的表達及意義[J].實用兒科臨床雜志,2010,25(19):1503-1505.
[3]Suzuki S Nanki .J Shibata S et al The neural stem/progenitor cellmadcernestin is expressed in proliferative endothelial cells but not in mature vasculaiure[J].J Histochen Cytochen,2010,58(8):721-730.
[4]周華威, 趙寶東, 文普帥. 神經生長因子對局灶性腦缺血神經干細胞巢蛋白表達及細胞類型的影響[J].中國組織工程研究與臨床康復,2007,2(7):1222-1224.
[5]王軍,范亞珍,陳海,等.臍血單個核細胞誘導的神經干細胞中Foxgl和Nestin基因的表達及其相互關系[J].實用兒科臨床雜志,2010,25(11) :848-850.
[6]Lee ,J W , Krasnodembskaya A,et al. Concise,review :Mesenchymal stem cells for acute lung injure:role of paracrine soluble factors [J].Stem Cells. 2011.29(6):913-919.
[7]烏優圖,王運杰. 神經生長因子對神經干細胞分化及神經元軸突形成的影響[J].中國組織工程研究與臨床康復,2008,12(29):5631-5635.
[8]Woodbury D, Scbwarz EJ,Prockop DJ,et al. Adult rat and human bone marrow stromal cells differentiate into neurons[J].J Neuro Res, 2000,61(4):364-364.

