銅、汞和鉛對斑馬魚仔魚肝臟發(fā)育的影響
韓建,彭維兵,韓利文,何秋霞,張?jiān)疲瑢O晨,王榮春,楚杰,劉可春
(山東省科學(xué)院生物研究所,山東省生物檢測技術(shù)工程實(shí)驗(yàn)室,山東省生物傳感器重點(diǎn)實(shí)驗(yàn)室,山東省科學(xué)院藥物篩選技術(shù)重點(diǎn)實(shí)驗(yàn)室,山東 濟(jì)南 250014)
?
【藥理與毒理】
銅、汞和鉛對斑馬魚仔魚肝臟發(fā)育的影響
韓建,彭維兵,韓利文,何秋霞,張?jiān)疲瑢O晨,王榮春,楚杰,劉可春*
(山東省科學(xué)院生物研究所,山東省生物檢測技術(shù)工程實(shí)驗(yàn)室,山東省生物傳感器重點(diǎn)實(shí)驗(yàn)室,山東省科學(xué)院藥物篩選技術(shù)重點(diǎn)實(shí)驗(yàn)室,山東 濟(jì)南 250014)
以肝臟綠色熒光轉(zhuǎn)基因斑馬魚T3(lfabp:EGFP)為模型,研究水環(huán)境典型重金屬污染物銅(CuCl2)、汞(HgCl2)和鉛(Pb(Ac)2)在較低濃度暴露下對仔魚(72~144 hpf)肝臟發(fā)育的影響。結(jié)果顯示,各暴露組存活率均在95%以上;CuCl2和HgCl2在1 μmol/L時(shí)均能夠引起鰾發(fā)育或充氣異常;3種化合物均能夠顯著減小肝臟熒光面積和光密度。相同暴露濃度下,CuCl2抑制肝臟發(fā)育的能力強(qiáng)于Pb(Ac)2和HgCl2,但HgCl2在0.01 μmol/L時(shí)就能夠顯著抑制肝臟發(fā)育;CuCl2和Pb(Ac)2抑制lfabp表達(dá)量的能力強(qiáng)于HgCl2,且Pb(Ac)2在0.01 μmol/L時(shí)就能夠顯著抑制lfabp表達(dá)。結(jié)果表明,3種重金屬化合物均能夠顯著抑制肝臟發(fā)育;轉(zhuǎn)基因斑馬魚仔魚可以作為檢測環(huán)境污染物肝臟發(fā)育毒性的首選模型。
銅;汞;鉛;斑馬魚;仔魚;肝臟發(fā)育
重金屬是水環(huán)境中的典型污染物,目前水體突發(fā)性重金屬污染事故時(shí)有發(fā)生,主要的污染物有銅、汞、鉛、鎘、鉻和鎳等[1-2]。水環(huán)境重金屬污染嚴(yán)重威脅水生生物健康和生存,魚類作為水環(huán)境中較大的脊椎動(dòng)物類群,重金屬污染物對其產(chǎn)生的危害引起越來越多的關(guān)注[3-4]。魚類胚胎、仔魚期等早期發(fā)育階段對重金屬污染較為敏感,以此為動(dòng)物模型開展了許多相關(guān)的毒理學(xué)研究,且主要集中于急性毒性評價(jià)方面,暴露濃度水平一般在數(shù)百微克每升或數(shù)十毫克每升級別,評價(jià)指標(biāo)包括致死率、孵化率以及水腫、脊柱彎曲等[5-10]。然而重金屬污染物在水體中的含量相對較低,一般在100 μg/L以下[11-13],其在低劑量下對亞個(gè)體水平(如器官、組織水平等)產(chǎn)生的毒性效應(yīng)尚不清楚。肝臟是魚體重要的代謝和解毒器官,為魚類早期階段發(fā)育提供能量并降低外源毒物的毒性效應(yīng),而重金屬對魚類早期階段肝臟發(fā)育的影響尚不明確。因此,開展較低劑量重金屬暴露對魚類早期肝臟發(fā)育影響的研究具有重要意義。
斑馬魚(Daniorerio)是良好的實(shí)驗(yàn)動(dòng)物模型,已被廣泛應(yīng)用于藥物毒理學(xué)、生態(tài)毒理學(xué)、環(huán)境監(jiān)測以及疾病研究等科研領(lǐng)域[14-18]。與細(xì)胞及哺乳類實(shí)驗(yàn)動(dòng)物相比,斑馬魚及其胚胎在肝臟毒性方面的應(yīng)用更加符合國際上倡導(dǎo)的毒理實(shí)驗(yàn)3R原則(Replacement, Reduction and Refinement)[19]。隨著諸多轉(zhuǎn)基因模型的建立,斑馬魚在相關(guān)研究領(lǐng)域的應(yīng)用變得更加廣泛。張?jiān)频萚20]以發(fā)育72 hpf 的肝臟熒光轉(zhuǎn)基因斑馬魚仔魚Tg(lfabp:EGFP)為模型,研究了對乙酰氨基酚對仔魚肝臟的毒性。端正花等[21]也以肝臟轉(zhuǎn)基因斑馬魚Tg(lfabp10a: dsRed; elaA:EGFP)為模型,研究了環(huán)境中苯并三唑及其衍生物與重金屬鎘對斑馬魚的單獨(dú)與聯(lián)合肝臟毒性效應(yīng)。Zhang等[22]發(fā)現(xiàn)對乙酰氨基酚、利福平和阿司匹林等肝臟細(xì)胞損傷毒性物質(zhì)的暴露與轉(zhuǎn)基因斑馬魚品系Tg (lfabp10a: dsRed; elaA: EGFP)肝臟熒光量表達(dá)的降低存在顯著的劑量-效應(yīng)關(guān)系。
本文選取典型重金屬化合物氯化銅(CuCl2)、氯化汞(HgCl2)和醋酸鉛Pb(Ac)2作為研究對象,以肝臟熒光轉(zhuǎn)基因斑馬魚為模型,研究了3種重金屬化合物在低濃度暴露下對斑馬魚仔魚肝臟發(fā)育的影響。
1 材料與方法
1.1 實(shí)驗(yàn)魚及胚胎
本實(shí)驗(yàn)采用肝臟綠色熒光轉(zhuǎn)基因斑馬魚T3(lfabp:EGFP),具體養(yǎng)殖和繁殖操作參照文獻(xiàn)[23]方法。成魚在28 ℃、照明/黑暗(14/10 h)條件下分開飼養(yǎng),每天定時(shí)投喂顆粒餌料和活豐年蝦。于實(shí)驗(yàn)開始前一天下午,取健康性成熟的T3斑馬魚,按雌雄1∶2的比例放入交配缸內(nèi),雌雄用隔板分開,次日燈光開啟后抽隔板,雌雄追尾交配產(chǎn)卵。收集受精卵并用亞甲基藍(lán)溶液消毒,再用胚胎培養(yǎng)水清洗后培養(yǎng),光照周期和培養(yǎng)溫度同成年斑馬魚。每天換新鮮培養(yǎng)水,并及時(shí)將死卵和卵殼清除。養(yǎng)至72 hpf,依據(jù)國家標(biāo)準(zhǔn)GB/T 21807—2008化學(xué)品 魚類胚胎和卵黃囊仔魚階段的短期毒性試驗(yàn)[24]對孵化、存活和畸形情況進(jìn)行評價(jià)。在相關(guān)指標(biāo)符合國標(biāo)要求的條件下,挑選孵化出的健康個(gè)體進(jìn)行后續(xù)暴露實(shí)驗(yàn)。
1.2 試劑及儀器
考慮到暴露液濃度穩(wěn)定性和均一性,本實(shí)驗(yàn)重金屬均選用其易溶性鹽或其鹽的水合物。HgCl2(純度99.9%)購自西亞化學(xué)工業(yè)有限公司; Pb(Ac)2·3H2O(純度99.998%)和CuCl2·2H2O(純度99.99%)均購自Aladdin公司。其他均為國產(chǎn)分析純試劑。
斑馬魚胚胎培養(yǎng)用水成分為0.17 mmol/L KCl,0.4 mmol/L CaCl2,5 mmol/L NaCl,0.16 mmol/L MgSO4。仔魚拍照前先用0.15 mg/L MS-222(間氨基苯甲酸乙酯甲磺酸鹽)麻醉,于4%甲基纖維素中固定拍照。
顯微觀察和拍照使用奧林巴斯(Olympus)SZX-16熒光體視顯微鏡和FSX-100多功能顯微成像工作站。斑馬魚成魚飼養(yǎng)系統(tǒng)為北京愛生科技有限公司設(shè)備,胚胎和仔魚在控溫型光照培養(yǎng)箱中培養(yǎng)。
1.3 暴露及評價(jià)方法
考慮到簡化流程和操作等要求,本研究采用已經(jīng)成熟化的暴露評價(jià)方案[20]。在斑馬魚發(fā)育至72 hpf,挑選發(fā)育正常的斑馬魚仔魚,移入6 孔板中,每孔15尾仔魚。根據(jù)預(yù)實(shí)驗(yàn),設(shè)定3種重金屬化合物暴露濃度均為0、0.01、0.1和1 μmol/L,暴露液均用胚胎養(yǎng)殖水配制,每孔加5 mL暴露液,每個(gè)濃度組設(shè)3個(gè)平行孔。隨后于光照培養(yǎng)箱中恒溫(28 ℃)培養(yǎng),每24 h換液一次。暴露至144 hpf時(shí),觀察記錄各實(shí)驗(yàn)組仔魚的形態(tài)和肝臟損傷情況。于FSX-100顯微鏡下對肝臟側(cè)面進(jìn)行拍照,采用FSX-BSW軟件對照片進(jìn)行處理,并用Image-Pro plus 5.1軟件測定肝臟熒光面積(Area)和熒光光密度(integral optical density,IOD)。
1.4 統(tǒng)計(jì)分析
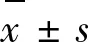
2 結(jié)果與分析
2.1 實(shí)驗(yàn)仔魚72 hpf基本指標(biāo)
發(fā)育至72 hpf,仔魚存活率為90.1%,孵化率為88.8%,未見明顯畸形個(gè)體。以上數(shù)據(jù)均符合相關(guān)國家標(biāo)準(zhǔn)(GB/T 21807—2008)對斑馬魚胚胎和卵黃囊仔魚階段存活率、孵化率的要求。
2.2 重金屬暴露對仔魚存活和形態(tài)的影響
經(jīng)過72~144 hpf暴露,不同處理組仔魚的存活率和畸形率結(jié)果見表1。對照組存活率為100%。染毒組存活率均在95%以上,與對照組相比無顯著性差異。對照組個(gè)體無畸形現(xiàn)象出現(xiàn);CuCl2和HgCl2最高濃度組畸形率分別為71.1%和20.0%,表現(xiàn)為無鰾或鰾不充氣狀態(tài),與對照組相比差異極顯著。其余組亦有部分個(gè)體無鰾或鰾不充氣,但無統(tǒng)計(jì)學(xué)差異。

表1 CuCl2、HgCl2、Pb(Ac)2和對照組仔魚在144 hpf時(shí)的存活率和畸形率Table1 Survival and malformation rates of CuCl2, HgCl2, Pb(Ac)2 and control groups at 144 hpf
為了更為直觀地展現(xiàn)染毒組畸形個(gè)體的形態(tài),我們對各組異常個(gè)體進(jìn)行了相差顯微拍照記錄。如圖1所示,對照組個(gè)體形態(tài)正常,仔魚發(fā)育良好(A),白色箭頭所指部位從左到右依次為鰾、腸和肝臟;而CuCl2-1 μmol/L組部分個(gè)體無鰾(B和C),肝臟和腸道出現(xiàn)病變(B,白色箭頭指示部位),體表出現(xiàn)類似增生(C和D,白色箭頭指示部位)。

A 對照組個(gè)體;B、C、D均為CuCl2-1 μmol/L組,其中B為無鰾且肝臟異常個(gè)體,C為無鰾、增生個(gè)體,D為有鰾、增生個(gè)體圖1 對照組和CuCl2-1 μmol/L組仔魚144 hpf時(shí)的形態(tài)Fig.1 Morphology of larvae at 144 hpf in control and CuCl2-1 μmol/L groups
2.3 重金屬暴露對肝臟發(fā)育的影響
通過熒光顯微觀察,檢測重金屬暴露對肝臟發(fā)育和lfabp表達(dá)情況。與對照組相比,重金屬暴露導(dǎo)致肝臟顯著減小。如圖2所示,圖中列出了對照組和各重金屬最高濃度組個(gè)體的明視場-熒光疊加圖片,白色箭頭所指部位為肝臟,從圖中可以看出暴露組肝臟熒光面積和亮度明顯減小。
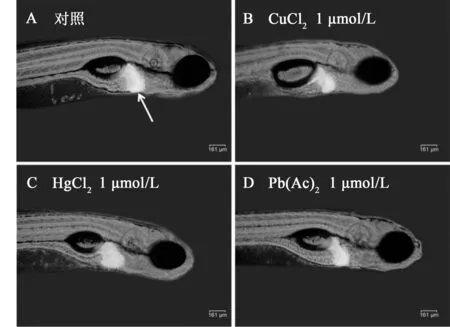
圖 2 CuCl2、HgCl2、Pb(Ac)2最高濃度組和對照組的肝臟熒光圖片F(xiàn)ig.2 Liver fluorescence images of the highest dose groups of CuCl2, HgCl2, Pb(Ac)2 and control groups
對各個(gè)處理組的部分個(gè)體進(jìn)行熒光拍照,測量了肝臟側(cè)面熒光面積(Area)和熒光光密度(IOD)。如圖3所示,與對照組相比,CuCl2(0. 1和1 μmol/L)和Pb(Ac)2(0.1和1 μmol/L)暴露組肝臟熒光面積均顯著減小,且呈現(xiàn)一定的劑量-效應(yīng)關(guān)系。如圖4所示,與對照組相比,CuCl2(1 μmol/L)和Pb(Ac)2(0.01、0.1和1 μmol/L)暴露組肝臟熒光光密度均顯著減小,且呈現(xiàn)一定的劑量-效應(yīng)關(guān)系。HgCl2各暴露組肝臟熒光光密度也呈現(xiàn)減小趨勢,但無統(tǒng)計(jì)學(xué)差異。肝臟熒光面積結(jié)果表明,上述3種重金屬化合物暴露顯著影響了肝臟發(fā)育,導(dǎo)致肝臟顯著小于對照組。肝臟熒光光密度結(jié)果表明,上述3種重金屬化合物暴露顯著影響了肝臟lfabp的正常表達(dá),從而影響了肝臟的生理學(xué)功能。相同暴露濃度下,CuCl2對肝臟發(fā)育大小的負(fù)面影響比Pb(Ac)2和HgCl2強(qiáng),但HgCl2在0.01 μmol/L時(shí)就能夠顯著抑制肝臟發(fā)育;CuCl2和Pb(Ac)2抑制lfabp表達(dá)量的能力比HgCl2強(qiáng),且Pb(Ac)2在0.01 μmol/L時(shí)就能夠顯著抑制lfabp表達(dá)。

圖3 CuCl2、HgCl2、Pb(Ac)2組和對照組肝臟熒光面積Fig.3 Liver fluorescence areas of CuCl2, HgCl2, Pb(Ac)2 and control groups

圖 4 CuCl2、HgCl2、Pb(Ac)2組和對照組肝臟熒光光密度(IOD)Fig.4 Liver fluorescence IOD of CuCl2, HgCl2, Pb(Ac)2 and control groups
3 討論
本研究豐富了轉(zhuǎn)基因斑馬魚在快速評價(jià)肝臟發(fā)育毒性方面的應(yīng)用,能夠?yàn)樵u估不同重金屬化合物對水生脊椎動(dòng)物早期發(fā)育階段的肝臟毒性提供參考,為綜合評價(jià)水環(huán)境重金屬污染物的毒性效應(yīng)和環(huán)境健康風(fēng)險(xiǎn)提供了科學(xué)依據(jù)。本文以肝臟綠色轉(zhuǎn)基因熒光斑馬魚T3(lfabp:EGFP)為模型,研究了3種重金屬化合物(CuCl2、HgCl2和Pb(Ac)2)在不顯著引起死亡率上升的濃度下對仔魚肝臟發(fā)育的影響。發(fā)育至72 hpf的仔魚存活率和孵化率均滿足相關(guān)標(biāo)準(zhǔn)要求,為實(shí)驗(yàn)結(jié)果的可靠性提供了保障。經(jīng)過72~144 hpf暴露期后,各組存活率均在95%以上,與對照組相比無顯著性差異。1 μmol/L的CuCl2和HgCl2暴露能夠分別引起71.1%和20.0%的個(gè)體無鰾或鰾不充氣,這與之前文獻(xiàn)報(bào)道的2.56 μg/L CuSO4暴露引起65.6%個(gè)體鰾缺失的結(jié)果類似[25]。
與以往單純測量熒光強(qiáng)度不同[20-21],本研究分別對肝臟側(cè)面熒光面積和熒光密度進(jìn)行了測量。熒光面積大小代表肝臟發(fā)育大小,熒光密度強(qiáng)弱代表lfabp表達(dá)量的高低,間接反映了肝臟功能發(fā)育是否完善。Cu、Hg和Pb都能夠顯著減小肝臟熒光面積,說明3種重金屬化合物均能夠顯著抑制肝臟的發(fā)育。斑馬魚肝型脂肪酸結(jié)合蛋白相關(guān)基因lfabp是脂肪酸結(jié)合蛋白家族(L-FABP)的重要成員之一,L-FABP不但可轉(zhuǎn)運(yùn)脂肪酸,為細(xì)胞生長提供能源及原材料,還可以結(jié)合和轉(zhuǎn)運(yùn)各種配體、參與細(xì)胞內(nèi)的信號轉(zhuǎn)導(dǎo)、影響有絲分裂,同時(shí)還具有抗氧化的功能[21]。Cu和Pb能夠顯著抑制lfabp的表達(dá)。雖然Hg的抑制作用無統(tǒng)計(jì)學(xué)差異,但抑制趨勢呈現(xiàn)一定的劑量效應(yīng)關(guān)系。通過分析可以得出,3種重金屬化合物都具有抑制仔魚肝臟正常生理功能的作用,肝臟細(xì)胞受到不同程度的損傷,不同金屬的毒性特點(diǎn)不一樣,且Pb的抑制作用強(qiáng)于Cu和Hg。
在72 hpf時(shí)仔魚肝臟基本形成,此后肝臟會(huì)繼續(xù)長大[26]。為了便于實(shí)驗(yàn)操作,并結(jié)合之前本方案的成功應(yīng)用經(jīng)驗(yàn)[20],本研究選擇的暴露期為72~144 hpf。這個(gè)時(shí)期內(nèi)肝臟將行使代謝功能,消化吸收卵黃囊的營養(yǎng)物質(zhì),肝體繼續(xù)長大,有利于特定考察重金屬對肝臟發(fā)育和功能的影響。考慮到持續(xù)暴露對肝臟分化發(fā)育的影響,以及選擇更加敏感的暴露窗口期,今后的實(shí)驗(yàn)將會(huì)對1 hpf內(nèi)的胚胎進(jìn)行暴露,直到72 hpf或144 hpf,與本文獲得的實(shí)驗(yàn)結(jié)果進(jìn)行比較,篩選出更加高效的暴露方案。
轉(zhuǎn)基因斑馬魚模型在快速評價(jià)化學(xué)品毒性方面具有顯著優(yōu)勢。通過建立多種器官、靶點(diǎn)特異的熒光轉(zhuǎn)基因品系,優(yōu)化毒性篩選方案,并結(jié)合分子毒理致毒機(jī)制研究,將為實(shí)現(xiàn)快速、高效的污染物毒理學(xué)評價(jià)和環(huán)境健康風(fēng)險(xiǎn)評估提供有力保障。此外,實(shí)際水環(huán)境中的污染物種類繁多,且多種同時(shí)存在于同一水體中,構(gòu)成復(fù)合污染。目前基于魚類胚胎/仔魚模型的復(fù)合暴露毒性評價(jià)指標(biāo)也仍然停留在死亡率、孵化率和畸形率等一般急性毒性指標(biāo)上[21,27-28]。通過優(yōu)化復(fù)合暴露方法和檢測指標(biāo),提高在復(fù)合暴露毒性評價(jià)中應(yīng)用相關(guān)轉(zhuǎn)基因斑馬魚品系的可行性,從而加快對多種污染物復(fù)合暴露的風(fēng)險(xiǎn)評價(jià),將成為下一階段的重點(diǎn)研究方向。
[1]孫維鋒, 肖迪. 水體重金屬污染現(xiàn)狀及治理技術(shù)[J]. 能源與節(jié)能, 2012(2):49-50.
[2]戚平平, 劉亮, 蘇乃洲,等.我國水體突發(fā)性污染不完全統(tǒng)計(jì)分析[J]. 濟(jì)南大學(xué)學(xué)報(bào)(自然科學(xué)版), 2014,28(5):335-341.
[3]趙順順, 孟范平, 王震宇,等. 監(jiān)測水體重金屬污染的分子生物標(biāo)志物研究進(jìn)展[J]. 生態(tài)環(huán)境學(xué)報(bào), 2010, 19(2):453-458.
[4]徐永江, 柳學(xué)周, 馬愛軍. 重金屬對魚類毒性效應(yīng)及其分子機(jī)理的研究概況[J]. 海洋科學(xué), 2004,28(10):67-70.
[5]孔祥迪, 陳超, 李炎璐,等. Cu2+、Zn2+、Pb2+對七帶石斑魚(Epinephelusseptemfasciatus)胚胎和初孵仔魚的毒性效應(yīng)[J]. 漁業(yè)科學(xué)進(jìn)展, 2014,35(5):115-121.
[6]王洪盼, 趙艷民, 秦延文,等. Cu和Cd對日本青鳉(Oryziaslatipes)早期發(fā)育階段的急性毒性效應(yīng)研究[J]. 生態(tài)毒理學(xué)報(bào), 2014, 9(4):793-802.
[7]穆景利, 王瑩, 王新紅,等. Cd2+、Hg2+、Cr6+和 Pb2+對黑點(diǎn)青鳉(Oryziasmelastigma)早期生活階段的毒性效應(yīng)研究[J]. 生態(tài)毒理學(xué)報(bào), 2011, 6(4):352-360.
[8]魯疆, 王占洋, 袁玉婷,等. 氯化鎘對斑馬魚胚胎的發(fā)育毒性[J]. 生態(tài)毒理學(xué)報(bào), 2013, 8(3):381-388.
[9]胡蓉, 謝玉華, 唐正義. 汞鎘離子對鯽魚胚胎發(fā)育和仔魚的毒性效應(yīng)[J]. 安徽農(nóng)業(yè)科學(xué), 2010, 38(34):19446-19448.
[10] SFAKIANAKIS D G, RENIERI E, KENTOURI M, et al. Effect of heavy metals on fish larvae deformities: Areview[J]. Environmental Research, 2015, 137:246-255.
[11]謝文平, 陳昆慈, 朱新平,等. 珠江三角洲河網(wǎng)區(qū)水體及魚體內(nèi)重金屬含量分析與評價(jià)[J]. 農(nóng)業(yè)環(huán)境科學(xué)學(xué)報(bào), 2010, 29(10):1917-1923.
[12]謝文平, 朱新平, 鄭光明,等. 廣東羅非魚養(yǎng)殖區(qū)水體和魚體中重金屬、 HCHs、DDTs 含量及風(fēng)險(xiǎn)評價(jià)[J]. 環(huán)境科學(xué), 2014,35(12):4663-4670.
[13] 簡敏菲, 李玲玉, 余厚平,等. 鄱陽湖濕地水體與底泥重金屬污染及其對沉水植物群落的影響[J]. 生態(tài)環(huán)境學(xué)報(bào), 2015,24(1):96-105.
[14] 王佳佳, 徐超, 屠云杰,等. 斑馬魚及其胚胎在毒理學(xué)中的實(shí)驗(yàn)研究與應(yīng)用進(jìn)展[J]. 生態(tài)毒理學(xué)報(bào), 2007, 2(2):123-135.
[15] CRISTINA S, ZON L I. Hooked! Modeling human disease in zebrafish[J]. Journal of Clinical Investigation, 2012, 122(7):2337-2343.
[16] DAI Y J, JIA Y F, CHEN N, et al. Zebrafish as a model system to study toxicology[J]. Environmental Toxicology & Chemistry, 2014, 33(1):11-17.
[17] 劉輝, 戴家銀. 斑馬魚在生態(tài)毒理學(xué)研究及環(huán)境監(jiān)測中的應(yīng)用[J]. 中國實(shí)驗(yàn)動(dòng)物學(xué)報(bào), 2015, 23(5):529-534.
[18]何秋霞, 董貞蘭, 楚杰,等. 蘆薈大黃素對斑馬魚胚胎發(fā)育及運(yùn)動(dòng)行為學(xué)的毒性研究[J]. 山東科學(xué), 2015, 28(3):23-28.
[19] FLECKNELL P. Replacement, reduction and refinement [J]. Altex, 2002,19(2):73-78.
[20] 張?jiān)? 彭維兵, 王希敏,等. 采用斑馬魚模型評價(jià)對乙酰氨基酚的肝臟毒性[J]. 藥物評價(jià)研究, 2013, 36(5):351-354.
[21] 端正花, 陳曉歐, 劉靈麗,等. 苯并三唑和鎘對斑馬魚肝臟的聯(lián)合毒性效應(yīng)[J]. 中國環(huán)境科學(xué), 2015, 35(6):1872-1876.
[22]ZHANG X Y, LI C X, GONG Z Y. Development of a convenientinvivohepatotoxin assay using a transgenic zebrafish line with liver-specific DsRed expression[J]. Plos One, 2014, 9(3):e91874.
[23] WESTERFIELD M. The Zebrafish Book [M]. Eugene: University of Oregon Press, 1995.
[24]中國人民共和國國家質(zhì)量監(jiān)督檢驗(yàn)檢疫總局,中國國家標(biāo)準(zhǔn)化管理委員會(huì). GB/T 21807—2008化學(xué)品 魚類胚胎和卵黃囊仔魚階段的短期毒性試驗(yàn)[S].北京:中國標(biāo)準(zhǔn)出版社.
[25] 章強(qiáng), 辛琦, 強(qiáng)麗媛,等. 銅及其與四環(huán)素的聯(lián)合暴露對斑馬魚胚胎的毒性效應(yīng)[J]. 生態(tài)毒理學(xué)報(bào), 2015, 10(5):35-46.
[26] CHU J, SADLER K C. New school in liver development: lessons from zebrafish.[J]. Hepatology, 2009, 50(5):1656-1663.
[27] 張亞輝, 劉征濤, 王一喆,等. Cu2+和Cd2+對斑馬魚胚胎早期發(fā)育的聯(lián)合毒性[J]. 環(huán)境科學(xué)研究, 2010, 23(11):1415-1420.
[28] 章曉鳳, 張微, 周聰. 氟蟲腈和銅對斑馬魚早期發(fā)育的聯(lián)合毒性效應(yīng)[J]. 浙江工業(yè)大學(xué)學(xué)報(bào), 2012, 40(6):612-615.
Impact of Cu,Hg and Pb on liver growth of zebrafish larvae
HAN Jian, PENG Wei-bing, HAN Li-wen, HE Qiu-xia, ZHANG Yun,SUN Chen, WANG Rong-chun, CHU Jie, LIU Ke-chun*
(Shandong Provincial Engineering Laboratory for Biological Testing Technology, Shandong Provincial Key laboratory of Biosensors,Key Laboratory for Drug Screening Technology of Shandong Academy of Sciences, Biology Institute,Shandong Academy of Sciences, Jinan 250014, China)
∶We addressed the impact of three typical heavy metal pollutants (copper chloride, mercury chloride and lead acetate) on liver growth of zebrafish larvae (72~144 hpf) with a liver green fluorescence transgenic zebrafish T3 (lfabp:EGFP) as a model. Results show that the survival rates of all groups are all more than 95%. CuCl2and HgCl2of 1 μmol/L can all cause abnormality of swimbladder growth or inflation. The three heavy metal compounds can all significantly reduce liver fluorescence area and integral optical density. CuCl2has more powerful inhibition capability for liver growth than Pb(Ac)2and HgCl2under identical exposure concentration. However, HgCl2of 0.01 μmol/L can inhibit liver growth. Inhibition capability oflfabpexpression of CuCl2and Pb(Ac)2is greater that of HgCl2. Moreover, Pb(Ac)2of 0.01 μmol/L can inhibit the expression oflfabp. Results show that the three heavy metal compounds can all significantly inhibit liver growth. Transgenic zebrafish larvae can serve as priority model for detection of environmental contaminants caused liver growth toxicity.
∶copper; mercury; lead; zebrafish; larvae; liver growth
10.3976/j.issn.1002-4026.2016.05.009
2016-07-14
山東省科學(xué)院青年基金(2015QN012);山東省自主創(chuàng)新及成果轉(zhuǎn)化專項(xiàng)(2014ZZCX02105);山東省自然科學(xué)基金三院聯(lián)合基金(ZR2015YL013)
韓建(1983—),男,博士,助理研究員,研究方向?yàn)槎纠韺W(xué)和藥物篩選。Email:hanjian251314@163.com。
*通信作者,劉可春(1964—),男,博士,研究員,研究方向?yàn)樗幬锖Y選。Email:hliukch@sdas.org。
R965.1
A

