血漿D-乳酸對非甾體抗炎藥相關腸黏膜損害的早期診斷探討
唐凱 周新妹 吳長明 陳群 陳濤 王彩平
血漿D-乳酸對非甾體抗炎藥相關腸黏膜損害的早期診斷探討
唐凱 周新妹 吳長明 陳群 陳濤 王彩平
目的探討NSAIDs引起小腸黏膜損傷的機制,D-乳酸作為血漿標志物應用于NSAIDs腸黏膜損害的早期診斷價值。方法 雄性大鼠40只,對照組20只,對照組灌胃2 ml蒸餾水,2次/d;模型組阿司匹林片50mg/kg,2次/d,分T1(2d給藥)和T2(7d給藥)亞組,各10只。實驗后進行小腸黏膜病理損傷評分;分析緊密連接Occludin蛋白的表達;同步測定血漿D-乳酸值。結果(1)模型組呈小腸黏膜損傷病理改變,T2亞組病理評分明顯高于T1亞組(P<0.01)。(2)Occludin/ GAPDH相對密度值模型組均較對照組明顯降低(P<0.01),T2亞組Occludin/GAPDH相對密度值顯著低于T1亞組(t=7.646,P<0.01)。(3)同步測定模型組血漿D-乳酸與對照組比較均明顯升高(P<0.01),T2亞組血漿D-乳酸較T1亞組明顯升高(t=67.773,P<0.01)。結論阿司匹林可導致大鼠小腸黏膜屏障破壞;測定血漿D-乳酸可以較早的反映NSAIDs引起的小腸黏膜損害。
血漿D-乳酸 非甾體抗炎藥 Occludin蛋白 小腸損傷
非甾體類抗炎藥(NSAIDs)具有良好的抗炎、解熱和鎮痛作用,廣泛用于關節炎及緩解疼痛癥狀,在心腦血管病預防也是基礎用藥之一。臨床重視NSAIDs引起的胃黏膜損害,而導致小腸潰瘍、出血、穿孔、腸通透性升高的副作用的發生率高、風險大,近年逐漸受到臨床關注[1]。2014年2月至2015年10月作者通過實驗研究,探討NSAIDs引起小腸黏膜損傷的機制,了解其病理生理變化,設立早期篩查指標,在發生腸并發癥之前,能夠為NSAIDs服用者提供一個便捷、可靠的非侵入性檢查方法,達到防止嚴重并發癥發生的目的。
1 材料和方法
1.1 實驗材料 雄性SD大鼠40只,180~220g。由嘉興醫學院動物實驗中心提供;阿司匹林腸溶片為德國拜耳制藥公司產品,試劑盒購自南京建成生物工程研究所。
1.2 動物分組 采用隨機抽簽法,將40只大鼠隨機分為2組,空白對照組20只,模型組20只,每組再進一步隨機分為2d給藥和7d給藥亞組,各10只,模型組分別標注為T1亞組、T2亞組。
1.3 給藥方法 對照組以2ml蒸餾水灌胃,2次/d;模型組以阿司匹林片50mg/kg灌胃,2次/d。2d給藥對照組和T1亞組大鼠在灌胃2d后處死,7d給藥對照組和T2亞組大鼠在灌胃7d后處死。
1.4 標本制作 大鼠禁食、不禁水12h,實驗時采用10%水合氯醛3ml/kg劑量腹腔注射麻醉后處死;肉眼觀測小腸黏膜標本損傷狀況。取頸靜脈血10ml,離心后取血漿分裝,-80℃保存,用于D-乳酸的測定;在距回盲部25cm取小腸1cm,置10%甲醛液中固定,常規石蠟包埋切片,HE染色。
1.5 小腸黏膜上皮損傷程度組織病理評分 采用Chiu氏評分法分級[2],O級:正常腸黏膜絨毛。Ⅰ級:腸黏膜絨毛頂端上皮下間隙增寬。Ⅱ級:中度固有層水腫,中央乳糜管擴張。Ⅲ級:腸黏膜上皮層細胞壞死,少數絨毛頂端脫落。Ⅳ級:部分絨毛脫落,固有層裸露,毛細血管充血。Ⅴ級:固有層崩解,出血或潰瘍形成。
1.6 Occludin蛋白檢測 過氧化物酶標記的鏈霉卵白素(SP)法檢測Occludin蛋白,按照說明書進行SP三步法進行免疫組化染色,Occludin陽性呈棕黃色顆粒狀,主要定位于小腸上皮細胞胞膜及胞質。WesternBlot檢測Occludin蛋白表達:取各組大鼠小腸組織,加入組織裂解液,勻漿后離心,取上清液,測定蛋白含量;經過凝膠蛋白電泳,光化學法顯色,拍片,以三磷酸甘油醛脫氫酶(GAPDH)作為內參照,利用QuantiScan凝膠圖像掃描分析軟件測定電泳條帶的光密度值,計算Occludin與GAPDH光密度的比值。
1.7 血漿D-乳酸濃度測定(分光光度法) 按照試劑盒說明書操作,計算大鼠血漿D-乳酸濃度。
1.8 統計學方法 采用SPSS 13.0統計學軟件,計量資料以(x±s)表示,配對t檢驗,以P<O.05為差異有統計學意義。
2 結果
2.1 小腸大體標本變化 對照組腸道黏膜光滑,腸管彈性好。T1亞組大鼠小腸黏膜可見散在淺表糜爛、潰瘍;T2亞組大鼠腸黏膜見多發潰瘍灶,部分有出血。
2.2 光鏡下觀察結果 對照組小腸黏膜無明顯改變,絨毛完整無脫落。T1亞組腸絨毛腫脹、增粗、縮短,部分頂端破損;T2亞組小腸黏膜明顯萎縮,固有層炎癥細胞浸潤,出現上皮細胞變性壞死、脫落,部分絨毛斷裂、脫落,固有層裸露。模型組病理評分均高于對照組(P<O.01),T2亞組病理評分明顯高于T1亞組(P<0.01),見圖1、表1。

圖1 各組大鼠小腸黏膜組織學表現(HE,×100)
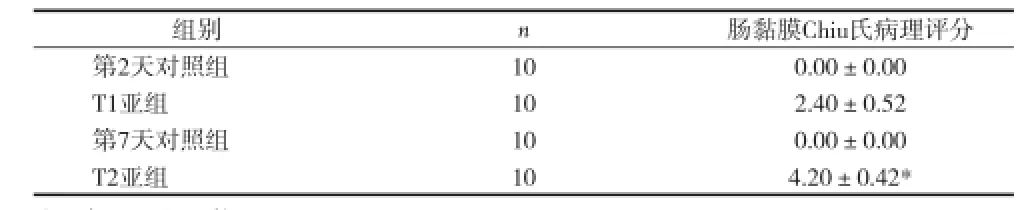
表1 對照組和模型組大鼠小腸黏膜病理評分(x±s)
2.3 各組Occludin蛋白表達 經過免疫組化染色的病理切片顯示,對照組小腸黏膜胞膜及胞質內見明顯Occludin蛋白表達,表現為較多棕黃色細顆粒聚集;T1亞組及T2亞組較對照組均有減少,T2亞組減少更明顯。腸黏膜緊密連接Occludin蛋白的表達:Occludin/ GAPDH相對密度值T1亞組(0.507±0.051)和T2亞組(0.644±0.026)均較對照組(1.264±0.016)明顯降低(P<0.01),T2亞組Occludin/GAPDH對密度值顯著低于T1組(t=7.646,P<0.01),見圖2~4。

圖2 各組大鼠小腸黏膜上皮細胞Occludin蛋白表達

圖3 各組大鼠腸黏膜Occludin蛋白電泳結果(Western blot法)
2.4 血漿D乳酸檢測結果T1、T2亞組血漿D乳酸與對照組比較均明顯升高(P<0.01),T2亞組血漿D乳酸較T1亞組明顯升高(t=67.773,P<0.01),差異均有統計學意義。見表2。
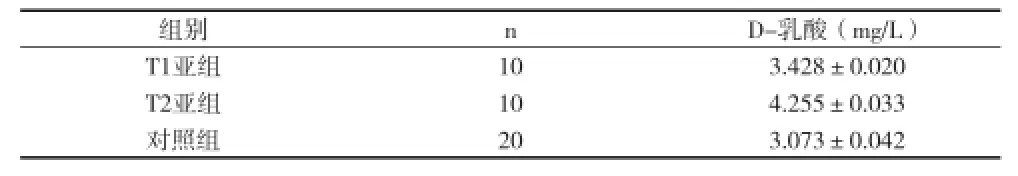
表2 分組大鼠D-乳酸值比較(x±s)

圖4 各組大鼠腸上皮緊密連接occludin蛋白表達的不同
3 討論
NSAIDs是具鎮痛及抗炎作用的藥物,廣泛應用于各種急慢性疼痛及風濕性心血管類疾病,每年大約有20萬使用NSAIDs患者出現并發癥,病死率>10%[3]。既往對NSAIDs的消化道損傷重點多關注在胃黏膜,但NSAIDs引起的腸道副作用的發生率高、風險大,近年逐漸受到臨床關注;NSAIDs所致的小腸黏膜早期病變多數為表淺性小潰瘍,潰瘍面與周圍黏膜界限清晰[4],還可出現小腸出血、蛋白質丟失性腸病、腸通透性升高及穿孔等,統稱為NSAIDs相關性腸病。本資料中參照成人用阿司匹林劑量作用大鼠腸道,結果大鼠小腸黏膜有不同程度的糜爛、潰瘍等病變發生,光鏡下也有相應的病理改變。
目前NSAIDs導致腸道損害的可能機制中,炎性反應起關鍵作用,通過抑制環氧合酶活性過程中增加白三烯的生成,促進組胺、自由基釋放,造成腸道黏膜損傷[5];腸道屏障破壞,通透性增加使小腸細胞暴露在膽汁、消化酶及細菌機會明顯增加,導致腸黏膜損傷[6]。腸黏膜機械屏障由腸道黏液層、上皮細胞、細胞間緊密連接等構成,是阻止致病物質入侵及細菌移位的屏障系統[7],其功能的發揮需要完整的上皮細胞屏障,Occludin作為一種整體膜蛋白,是細胞間緊密連接的重要組成部分,對維持腸道上皮屏障的完整至關重要[8]。本資料中對照組大鼠小腸上皮Occludin蛋白密集表達,T1亞組及T2亞組較對照組分布均有減少,T2亞組減少更明顯;Occludin/ GAPDH相對密度值模型組均較對照組明顯降低(P<0.01),T2亞組Occludin /GAPDH相對密度值顯著低于T1組(P<0.01)。提示模型組大鼠腸道黏膜機械屏障遭到破壞,隨病程延長破壞加重。
在此實驗,腸黏膜屏障狀況采用了新的血漿標志物D-乳酸定量測評。一般認為,D-乳酸是細菌代謝產物,腸道中多種細菌均可產生;當腸黏膜屏障受損,腸道細菌產生的D-乳酸通過受損黏膜入血循環,哺乳動物缺乏D-乳酸脫氫酶,當腸黏膜受損早期、腸黏膜通透性增加時,血中可檢測到D-乳酸水平升高[9]。本資料中,T2亞組光鏡下腸黏膜受損更明顯,同步檢測D-乳酸水平較T1亞組明顯升高,表明D-乳酸測定較好的反映大鼠腸黏膜的受損狀況,T1亞組較對照組D-乳酸顯著升高,可早期提示大鼠腸黏膜的損害,表明血漿D-乳酸水平變化與NSAIDs引起的小腸黏膜進行性受損相關。因此,通過靜脈血檢測D-乳酸水平可反映NSAIDs所致腸黏膜損害的程度。
總之,NSAIDs可導致腸黏膜破壞,體循環D-乳酸水平相應升高,其含量與小腸黏膜損害相關。因此,D-乳酸可作為血漿標志物應用于NSAIDs腸黏膜損害的早期診斷。對于長期服用NSAIDs的患者,可進行血檢測D-乳酸篩查,發現數值升高者,再考慮安排侵入性的內鏡檢查。NSAID的小腸損害機制尚不明確,本資料中大鼠腸黏膜occludin蛋白表達減少,反映腸道屏障的破壞是機制之一,其他途徑尚需進一步研究。
[1]Vakhrushev IaM, Zagrebina EA. Clinical and functional changes in small intestine in the treatment of osteoarthritis with nonsteroidal antiinflammatory drugs. Eksp Klin Gastroenterol,2010,(3):18-22.
[2]Chiu CJ, McArdle AH, Brown R, et al.Intestinal mucosal lesion in Low-flow states.I.A morphological,hemodynamic,and metabolic reappraisal. Arch Surg, 1970, 101:478-483.
[3]Bindu S,Mazumder S,Dey S,et al.Non-steroida1 anti-inflammatory drug induces proinflammatory damage in gastric mucosa through NF-KB activation and neutrophi1 infiltration:Anti-inflammatory role of heme oxygenase-1 against non-steroidal anti-infIammatory drug. Free Radic Bio1 Med,2013,65:456-457.
[4]Raghav K,Overman MJ.Small bowel adenocarcinomas existing evidence and evolving paradigms. Nat Rev C1in Oncol,2013, 10(9): 534-544.
[5]Matsui H, Shimokawa O,Kaneko T, et al. The pathophysiology of non-steroidal anti-inflammatory drug(NSAID)-induced mucosal injuries in stomach and small intestine.J Clin Biochem Nutr, 2011, 48(2): 107-111.
[6]Satoh H,Takeuchi K.Management of NSAID/aspirininduced small intestinal damage by GI-sparing NSAIDs,anti-ulcer drugs and food constituents.Curr Med Chem,2012,19(1):82-89.
[7]黃蓉,歐希龍,腸道黏膜屏障功能損傷機制及其防治的研究進展,現代醫學,2015,0(5):659-662.
[8]Fava F, Danese S. Intestinal microbiota in inflammatory bowel disease: friend of foe? World J Gastroenterol,2011,17:557-566.
[9]陳韻名,鄧烈華,姚華國.D-乳酸的臨床研究進展.醫學研究雜志,2012,41(5),188-190.
ObjectiveTo study the mechanism of NSAIDs induced intestinal mucosal injury,and the early diagnosis of D-lactate as a marker of NSAIDs in the early diagnosis of intestinal mucosal damage.Methods40 male rats,the control group of 20,the control to fi ll the stomach 2 ml distilled water twice a day;Model group aspirin 50 mg/Kg twice a day,points T1(2 day delivery)and T2 for 7 days(medicine)subgroups,10 each. After the experiment of small intestinal mucosa pathological damage score;analyze the changes of Occludin protein localizing at tight junction of intestinal epithelial cells;Simultaneous determination of D-lactate in plasma.ResultsIn the model group,the pathological changes of intestinal mucosa injury,the pathological score of T2 subgroup was signifi cantly higher than that in T1(P<0.01);(2)The relative density of Occludin/ GAPDH was signifi cantly lower than that in control group(P<0.01),and the relative density of Occludin/GAPDH in T2 subgroup was signifi cantly lower than that in T1(t=7.646,P<0.01);(3)In the model group,the plasma D-lactate was signifi cantly higher than that in the control group(P<0.01),and the D-lactate in the T2 subgroup was signifi cantly higher than that in the T1(t=67.773,P<0.01).ConclusionAspirin can cause intestinal mucosal barrier damage in rats;the plasma D-lactate can refl ect the NSAIDs induced intestinal mucosal lesion in the early.
The Plasma D-lactate NSAIDs Occludin Protein Intestinal Damage
浙江省嘉興市科技計劃項目(2014AY21035-3)
314000 浙江省榮軍醫院(唐凱 吳長明 陳群 陳濤王彩平)
314000 浙江省嘉興學院醫學院(周新妹)

