短鏈酰基輔酶A脫氫酶在心臟成纖維細胞膠原表達和細胞增殖中的作用*
舒朝輝, 曾振華, 黃秋菊, 李忠洪, 劉培慶, 陳少銳, 蘭 天, 臧林泉, 周四桂△
(1廣東藥科大學臨床藥學系,廣東 廣州 510006; 2中山大學藥學院藥理與毒理學實驗室,廣東 廣州 510006)
短鏈酰基輔酶A脫氫酶在心臟成纖維細胞膠原表達和細胞增殖中的作用*
舒朝輝1, 曾振華1, 黃秋菊1, 李忠洪1, 劉培慶2, 陳少銳2, 蘭 天1, 臧林泉1, 周四桂1△
(1廣東藥科大學臨床藥學系,廣東 廣州 510006;2中山大學藥學院藥理與毒理學實驗室,廣東 廣州 510006)
目的: 研究短鏈酰基輔酶A脫氫酶(short-chain acyl-CoA dehydrogenase,SCAD)在心臟成纖維細胞膠原表達和細胞增殖中的作用,探討其與心肌纖維化之間的關系。方法:以血管緊張素II(angiotensin II,Ang II)刺激心臟成纖維細胞建立膠原表達和細胞增殖模型,并采用SCAD的最優干擾序列siRNA-1186進行干擾,檢測SCAD的mRNA、蛋白表達、酶活性、脂肪酸β氧化速率、ATP以及游離脂肪酸含量的變化;觀察其對心臟成纖維細胞膠原表達和細胞增殖的影響。結果:與對照組相比,在Ang II誘導的心臟成纖維細胞增殖和膠原表達模型中,SCAD的mRNA和蛋白表達均顯著下調。與陰性對照序列組相比,siRNA-1186干擾后心臟成纖維細胞的SCAD表達和酶活性明顯下降,心臟成纖維細胞脂肪酸β氧化速率以及ATP生成明顯降低,并且游離脂肪酸含量明顯增多。同時,心臟成纖維細胞出現明顯增殖,I、III型膠原的表達明顯增加。結論:SCAD表達失調可能導致了心臟成纖維細胞異常增殖、膠原分泌紊亂,上調 SCAD可能成為干預心肌纖維化的重要環節之一。
短鏈酰基輔酶A脫氫酶; 心臟成纖維細胞; 心肌纖維化; 能量代謝; 膠原
心臟主要由心肌細胞和間質細胞構成,而間質細胞中心臟成纖維細胞(cardiac fibroblasts)占到了40%~60%[1-2],心臟成纖維細胞不僅對心肌細胞有結構上的支持和保護作用,還具有自分泌和旁分泌功能,而且會影響心肌的結構和生理功能。目前認為,心肌肥厚是增加高血壓致殘率和致死率的一個重要獨立危險因素,并且心臟成纖維細胞的增殖是導致心肌肥厚重要的病理生理基礎[3]。在肥厚后期,心臟成纖維細胞增殖以及膠原分泌紊亂,進一步發展為心肌纖維化,最終導致心力衰竭。然而,誘發心臟成纖維細胞增殖和膠原表達紊亂的相關因素以及線粒體在心臟成纖維細胞增殖和膠原表達中的機制尚未完全闡明。
心肌是耗能最多的組織之一。哺乳動物胚胎期心臟主要以葡萄糖和乳酸作為能源,出生后則為以脂肪酸氧化為主;但在病理性心肌肥厚時脂肪酸氧化降低,糖酵解增加,心肌能量代謝發生“胚胎型轉換”[4]。短鏈酰基輔酶A脫氫酶(short-chain acyl-CoA dehydrogenase,SCAD)是酰基輔酶A脫氫酶家族中的一員,特異性地分解短鏈酰基輔酶A底物,是脂肪酸 β 氧化的第一個限速步驟,是脂肪酸氧化的關鍵酶[5]。我們采用定量蛋白質組學 DIGE技術比較16周齡自發性高血壓大鼠和血壓正常大鼠的心肌蛋白質組,首次發現SCAD 在自發性高血壓大鼠肥厚心肌中的表達明顯降低[6]。而在后續的研究中也發現,SCAD對病理性心肌肥厚和心肌細胞凋亡具有負性調控作用[7-9]。心肌纖維化是病理性心肌肥厚由代償向失代償轉化的重要病理過程,是引發心力衰竭的核心環節[10]。然而,SCAD在心肌纖維化中的作用尚不清楚。
本研究在細胞水平模擬心肌纖維化,以血管緊張素II(angiotensin II,AngⅡ)建立心臟成纖維細胞增殖和膠原表達模型,觀察SCAD在心臟成纖維細胞增殖和膠原表達中的作用,從心臟能量代謝方面探討心肌纖維化的發病機制,以期為心肌纖維化尋找新的分子標志物,并為心肌纖維化治療尋找新的藥物作用靶點。
材 料 和 方 法
1 材料
RT-PCR 測定試劑盒、TRIzol和 SYBR Green購于 TaKaRa; II型膠原酶購于Gibco;BCA 蛋白定量試劑盒和 Western blot發光液購于 Thermo;亞細胞結構線粒體提取試劑盒以及臺盼藍購于博士德生物;脂肪酸β氧化速率比色法檢測試劑盒和細胞 SCAD 活性比色法定量檢測試劑盒購于上海杰美基因;血管緊張素II和單克隆鼠抗 α-tubulin購于Sigma;單克隆兔抗 SCAD 購于 Abcam;I、III型膠原抗體購于Proteintech;羥脯氨酸和游離脂肪酸測定試劑盒購于南京建成生物工程研究所; CCK-8試劑盒購于Dojindo;ATP檢測試劑盒購于碧云天生物技術有限公司。
2 方法
2.1 SD大鼠原代心臟成纖維細胞培養 采用本實驗室已發表的方法分離及培養成年大鼠心臟成纖維細胞[9],取200~250 g雄性大鼠,頸椎脫臼法處死,在無菌條件下取出心臟,采用膠原酶-胰酶-膠原酶循環消化法,得到單細胞懸液,收集細胞后差速貼壁1 h去除心肌細胞,置于37 ℃、5% CO2培養箱中培養,隔天換液。按照上述分離制備的心臟成纖維細胞,經vimentin抗體的免疫細胞化學染色,純度可達98%以上。2.2 CCK-8法檢測細胞活力 細胞以每孔5×103個接種于96孔板,待細胞貼壁后,給予不同濃度Ang II(0.1、1、10、100、1 000 nmol/L)刺激細胞24 h或者濃度100 nmol/L的Ang II 作用細胞不同時間(6、12、24、36、48 h),每孔加入10 μL CCK-8溶液,4 h后用酶標儀于450 nm波長測定吸光度(A)值。
2.3 臺盼藍染色實驗 細胞以每孔1×104個接種于12孔板,待細胞貼壁后,給予不同濃度Ang II(0.1、1、10、100、1 000 nmol/L)刺激細胞24 h或者濃度100 nmol/L的Ang II 作用細胞不同時間(6、12、24、36、48 h),制備單細胞懸液,用濃度為0.1%的臺盼藍染色,3 min內,用計數板分別計數活細胞和死細胞。鏡下觀察,死細胞被染成藍色,而活細胞拒染。
2.4 Real-time PCR檢測 mRNA 的表達 按照TRIzol說明書步驟提取細胞總 RNA,紫外分光光度計檢測RNA樣品的260和280 nm波長下的A值,檢測純度并計算出 RNA的濃度。參照RT-PCR試劑盒說明書進行逆轉錄反應。按照SYBR Green說明書反應體系加入熒光染料、引物和RT 產物后在Bio-Rad CFX96 PCR儀中進行real-time PCR反應。反應程序為:95 ℃ 10 s; 95 ℃ 5 s, 60 ℃ 30 s,循環40次。引物由上海生工合成,具體引物序列見表1。
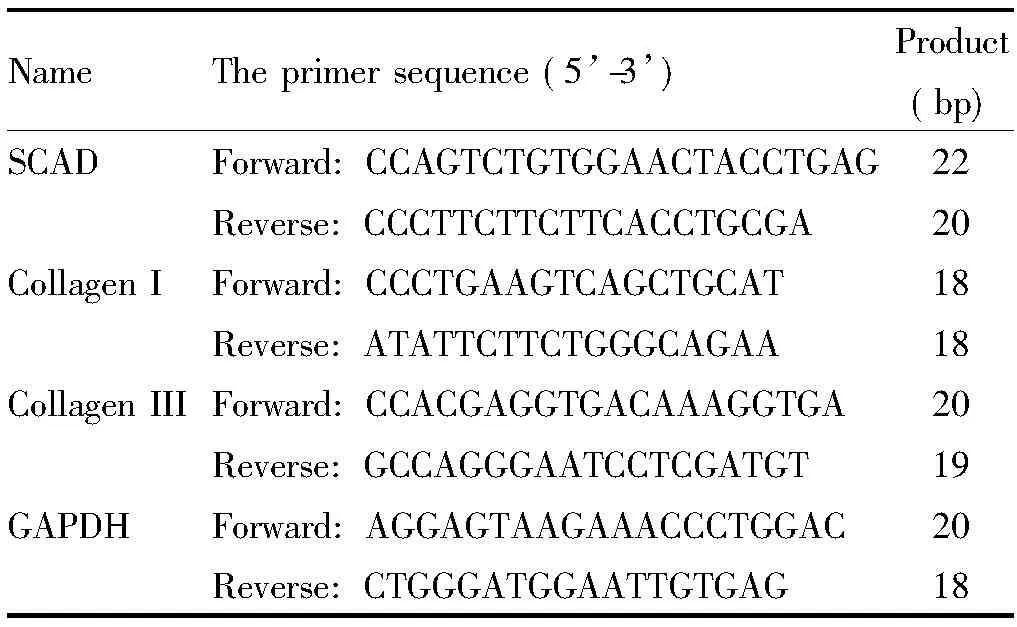
表 1 Real-time PCR實驗的引物序列
2.5 Western blot法檢測蛋白的表達 提取各組心臟成纖維細胞總蛋白, BCA試劑盒檢測細胞蛋白含量后調整上樣量,分裝、變性,配置10% SDS分離膠和5% 濃縮膠進行電泳,電泳結束后轉移至PVDF膜(Bio-Rad),室溫封閉1 h 后加入I抗(SCAD,1∶1 000;Collagen I, 1∶1 000; Collagen III, 1∶1 000; α-tubulin,1∶10 000),過夜。漂洗后加II抗,室溫孵育1 h,化學發光試劑增強反應, X線壓片曝光、顯影、定影,結果采用ImageJ 圖像分析系統對條帶進行分析。
2.6 SCAD 酶活性的檢測 按照實驗分組處理細胞,收集細胞后置于冰上裂解 30 min,取上清液用BCA蛋白定量試劑盒定量蛋白。酶活性檢測是基于 2,6-二氯靛酚鈉(2,6-dichlorophenol indophenol,DCPIP)作為人工電子受體,替代黃素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD),在 SCAD 的作用下,由短鏈酰基輔酶 A 提供的電子, 經過硫酸甲酯吩嗪(phenazine methosulphate,PMS)的傳遞,被還原為無色產物,通過分光光度儀的峰值變化(600 nm 波長)來定量分析 SCAD 的活性。嚴格按照說明書采用酶標儀法進行檢測。
2.7 siRNA干擾 siRNA干擾序列購于上海吉瑪制藥技術有限公司。采用本實驗室篩選出的最優干擾序列siRNA-1186進行實驗,其正義鏈序列為5’-CCGCAUCACUGAGAUCAUTT-3’,反義鏈序列為5’-AUAGAUCUCAGUGAUGCGGTT-3’。轉染方法按照公司提供的轉染試劑說明書進行。
2.8 膠原合成的檢測 通過測定細胞中羥脯氨酸的含量反映膠原合成情況。實驗嚴格按照說明書采用酶標儀法進行檢測。羥脯氨酸含量(mg/L)=(測定A值-空白A值)/(標準A值-空白A值)×標準品濃度×樣品測試前稀釋倍數。
2.9 脂肪酸β氧化速率的檢測 使用差速離心法提取細胞中的線粒體,嚴格按照亞細胞結構線粒體提取試劑盒說明書操作。比色法測定脂肪酸β氧化速率是一種通過底物棕櫚酰肉堿的氧化產生電子,由鐵氰化物捕獲而還原,其還原速率的檢測用來評價脂肪酸β氧化的速率,具體操作嚴格按照脂肪酸β氧化速率比色法檢測試劑盒說明書進行。
2.10 游離脂肪酸含量的測定 游離脂肪酸能與銅離子結合形成脂肪酸銅鹽而溶于氯仿中,其含量與游離脂肪酸含量成正比,用銅試劑測定其中的銅離子含量,即可推算出游離脂肪酸的含量。我們采用游離脂肪酸測定試劑盒(比色法)檢測心臟成纖維細胞中游離脂肪酸的含量,操作方法嚴格按照說明書進行。
2.11 ATP含量的測定 ATP檢測試劑盒根據螢火蟲螢光素酶催化螢光素發光時需要ATP提供能量的原理而設計。當螢火蟲螢光素酶和螢光素都過量時,發光強度與ATP濃度在一定范圍內成正比。操作方法嚴格按照說明書進行。
3 統計學處理
數據以均數±標準差(mean±SD)表示,采用SPSS 13.0統計軟件處理,組間比較采用單因素方差分析,運用Bonferronit檢驗進行組間兩兩比較,以P<0.05為差異有統計學意義。
結 果
1 Ang II對心臟成纖維細胞增殖的影響
CCK-8比色法檢測不同濃度Ang II (0.1、1、10、100、1 000 nmol/L)刺激心臟成纖維細胞 24 h后,細胞生長良好,細胞增殖呈濃度依賴性,且Ang II濃度為100 nmol/L和1 000 nmol/L時,二者無顯著性差異; 用100 nmol/L Ang II 處理不同時間(0、6、12、24、36、48 h)后,發現細胞增殖呈時間依賴性,且Ang II處理36 h和48 h時無顯著性差異 。此外,臺盼藍染色結果表明,心臟成纖維細胞數量在100 nmol/L Ang II處理不同時間(0、6、12、24、36、48 h)后,基本呈現時間依賴性,且在36 h和48 h無顯著性差異; 在不同濃度Ang II (0.1、1、10、100、1 000 nmol/L)刺激下表現出濃度依賴性,且在100 nmol/L時有顯著性差異。因此,我們選擇濃度為100 nmol/L的Ang II作用36 h作為后續實驗的條件,見圖1。
2 Ang II對心臟成纖維細胞中SCAD的mRNA和蛋白表達的影響
Real-time PCR實驗結果顯示,隨著Ang II 處理時間和濃度的增加,心臟成纖維細胞內SCAD的mRNA表達明顯下調。Western blot實驗結果與 real-time PCR結果呈現一致的趨勢,SCAD的蛋白表達均出現下調,以濃度100 nmol/L Ang II作用36 h和48 h時,SCAD的下調最為顯著(P<0.01),見圖2。

Figure 1.The cell proliferation in Ang II-treated cardiac fibroblasts detected by CCK-8 assay (A, B) or cell counting after Trypan blue staining (C, D). A, C: the cardiac fibroblasts were treated with 100 nmol/L Ang II for various incubation time periods; B, D: the cardiac fibroblasts were treated with different concentrations of Ang II for 36 h. Con: control. Mean±SD.n=3.*P<0.05,**P<0.01vsCon.
圖1 各組心臟成纖維細胞的增殖情況

Figure 2. The expression of SCAD at mRNA (A, B) and protein (C, D) levels in Ang II-treated cardiac fibroblasts. A, C:the cardiac fibroblasts were treated with Ang II for different time periods; B, D: the cardiac fibroblasts were treated with different concentrations of Ang II for 36 h. Con: control. Mean±SD.n=3.*P<0.05,**P<0.01vsCon.
圖2 Ang II 刺激后心臟成纖維細胞SCAD mRNA和蛋白表達的變化
3 Ang II和siRNA-1186對心臟成纖維細胞SCAD表達、SCAD酶活性、脂肪酸β氧化速率、ATP及游離脂肪酸含量的影響
用siRNA-1186干擾序列轉染心臟成纖維細胞, 可見siRNA可以明顯減少心臟成纖維細胞中SCAD的mRNA和蛋白表達量,降低SCAD的酶活性。此外,心臟成纖維細胞對脂肪酸的氧化能力下降,表現在脂肪酸β氧化速率的下降以及ATP生成的減少。與陰性對照組相比,siRNA-1186組的脂肪酸β氧化速率顯著下降,ATP生成也明顯減少,且心臟成纖維細胞內游離脂肪酸含量顯著增多,其程度與刺激因素Ang II作用于心臟成纖維細胞的結果一致,表明SCAD的表達下調可能導致了心臟成纖維細胞脂肪酸 β 氧化能力下降,見圖3。

Figure 3. The expression and activity of SCAD, fatty acid beta-oxidation rate, ATP content and free fatty acid content in the cardiac fibroblasts treated with Ang II (100 nmol/L, 36 h) or siRNA-1186 (72 h). Con: control; NC: negative control. Mean±SD.n=3. *P<0.05,**P<0.01vsCon;#P<0.05,##P<0.01vsNC.
圖3 siRNA-1186和Ang II對心臟成纖維細胞SCAD mRNA和蛋白表達、SCAD酶活性、脂肪酸β氧化速率、ATP和游離脂肪酸含量的影響
4 Ang II和siRNA-1186對心臟成纖維細胞增殖的影響
由圖4可見,與陰性對照序列組相比,siRNA-1186干擾序列通過瞬時轉染敲低SCAD基因的表達后,CCK-8結果表明心臟成纖維細胞的增殖明顯增強,其程度與刺激因素Ang II誘導的細胞增殖趨勢一致;此外,臺盼藍染色結果也表明,siRNA-1186干擾序列通過瞬時轉染敲低SCAD基因的表達后,心臟成纖維細胞的數量出現顯著性增長,與CCK-8結果一致。這表明SCAD表達量的降低可能是造成心臟成纖維細胞出現增殖的一個重要因素。

Figure 4.The cell proliferation was measured 72 h after transfection with siRNA-1186 or treated with Ang II for 36 h by CCK-8 assay(A) and Trypan blue staining (B). Con: control; NC: negative control. Mean±SD.n=3.**P<0.01vsCon;##P<0.01vsNC.
圖4 siRNA-1186和Ang II對心臟成纖維細胞增殖的影響
5 Ang II和siRNA-1186對心臟成纖維細胞羥脯氨酸含量的影響
由圖5可見,用siRNA-1186干擾序列敲低SCAD的表達后,心臟成纖維細胞內羥脯氨酸的含量顯著增加,與Ang II 誘導心臟成纖維細胞增殖導致的羥脯氨酸含量變化趨勢一致。這表明SCAD的下調可能導致了心臟成纖維細胞膠原合成能力的改變。

Figure 5. Collagen synthesis was determined by hydroxyproline assay in the cardiac fibroblasts treated with Ang II at 100 nmol/L for 36 h or transfected with siRNA-1186 for 72 h. Con:control; NC: negative control. Mean±SD.n=3.**P<0.01vsCon;##P<0.01vsNC.
圖5 siRNA-1186和Ang II 對心臟成纖維細胞羥脯氨酸含量變化的影響
6 Ang II和siRNA-1186對心臟成纖維細胞I、III型膠原mRNA和蛋白表達的影響
siRNA-1186干擾序列敲低SCAD的表達后,心臟成纖維細胞 I、III型膠原的表達較陰性對照組顯著上升,與Ang II 刺激心臟成纖維細胞導致的I、 III
型膠原表達趨勢一致,且real-time PCR與Western blot實驗的結果保持一致。這表明SCAD的下調可能導致了心臟成纖維細胞I、III型膠原的表達紊亂,見圖6。
討 論
心肌纖維化是由于心臟成纖維細胞過度增殖,導致膠原蛋白過量積聚,膠原成分發生改變或濃度增加所引起的病理過程。主要表現為各型膠原比例失衡,膠原蛋白含量增加及其結構重排,進而影響心臟功能,最終導致心力哀竭的發生。心肌纖維化是多種心臟疾病發展的共同結局,可導致心臟收縮功能障礙、心律失常及室顫的發生,最終演變成難以治療的充血性心力衰竭[11]。因此,防治心肌纖維化的研究具有重要臨床意義。
目前認為,心臟能量代謝有望成為治療心力衰竭的靶點[12-13],并且對心臟能量代謝的研究主要集中于心肌細胞。我們的前期研究首次發現,與能量代謝密切相關的SCAD參與調控病理性心肌肥厚與心肌細胞凋亡[7,14]。然而,心臟成纖維細胞也是心臟的重要組成部分,參與了心肌纖維化進程。此外,心肌纖維化是心肌肥厚由代償向失代償轉化的重要病理過程,是引發心力衰竭的核心環節[15]。在心肌肥厚中心肌細胞能量代謝異常已有大量報道[16-18],然而,心肌纖維化時心臟成纖維細胞的能量代謝是否發生變化鮮有報道。因此,從心肌能量代謝角度防治心肌纖維化,延緩心力衰竭進程,可能是一條新思路。

Figure 6. The expression of collagen I and collagen III in the cardiac fibroblasts treated with Ang II (100 nmol/L, 36 h) or siRNA-1186 (72 h). A: the mRNA expression of collagen I and collagen III by real-time PCR; B: the representative images and quantitative analysis of Western blotting for determining the protein levels of collagen I and collagen III. Con: control; NC: negative control. Mean±SD.n=3.**P<0.01vsCon;##P<0.01vsNC.
圖6 siRNA-1186和Ang II對心臟成纖維細胞I、III型膠原mRNA和蛋白表達的影響
線粒體的脂肪酸 β 氧化經過脫氫、水化、再脫氫和硫解4個步驟產生能量。SCAD是酰基輔酶A脫氫酶家族成員之一,直接參與脂肪酸β氧化第一步的脫氫過程。我們的前期研究發現,SCAD負性調控病理性心肌肥厚和心肌細胞凋亡[8, 14]。由于心臟成纖維細胞的增殖和膠原代謝失衡是引發心肌纖維化的重要環節,而SCAD是否參與心肌纖維化過程尚未見報道。因此,我們進一步探討了SCAD在心臟成纖維細胞增殖以及膠原表達中的作用。
在本研究中,我們采用Ang II誘導心臟成纖維細胞增殖模型,觀察不同濃度Ang II作用24 h或100 nmol/L Ang II作用不同時間對心臟成纖維細胞增殖的影響。CCK-8以及臺盼藍染色結果提示,Ang II誘導心臟成纖維細胞增殖具有一定的時間和濃度依賴性。此外,在心臟成纖維細胞增殖的時效和量效實驗中,SCAD的mRNA和蛋白表達均出現明顯下調,并且呈一定的時間和濃度依賴性。以上結果表明,SCAD表達下調可能與Ang II 誘導心臟成纖維細胞增殖密切相關。
為了進一步明確SCAD與心臟成纖維細胞增殖和膠原表達的關系,我們采用RNA干擾技術,觀察到siRNA沉默心臟成纖維細胞SCAD基因的同時,心臟成纖維細胞出現明顯增殖,膠原含量及其表達明顯增加,與Ang II誘導心臟成纖維細胞的趨勢一致,SCAD表達下調直接促進了心臟成纖維細胞增殖及膠原合成,表明SCAD表達下調在心肌纖維化中可能具有重要作用。此外,siRNA在引起心臟成纖維細胞SCAD表達下調的同時,SCAD酶活性也明顯下降,脂肪酸β氧化速率減小,ATP生成減少,游離脂肪酸含量顯著升高,與Ang II引起心臟成纖維細胞脂肪酸代謝的變化一致。表明SCAD的表達下調可能導致了心臟成纖維細胞脂質代謝障礙。以上結果提示,SCAD的表達下調可能導致了心臟成纖維細胞脂肪酸 β 氧化能力下降,從而引起ATP生成減少,游離脂肪酸含量增加,導致心臟成纖維細胞增殖及膠原表達增加。
綜上所述,SCAD在心臟成纖維細胞增殖和膠原表達中發揮了至關重要的作用,為我們進一步研究SCAD在心肌纖維化中的作用奠定了基礎。然而,SCAD在心肌纖維化中的具體作用機制還需進一步研究。
[1] Zhang P, Su J, Mende U. Cross talk between cardiac myocytes and fibroblasts: from multiscale investigative approaches to mechanisms and functional consequences[J]. Am J Physiol Heart Circ Physiol, 2012, 303(12):H1385-H1396.
[2] Jiang X, Zhang F, Ning Q. Losartan reverses the down-expression of long noncoding RNA-NR024118 and Cdkn1c induced by angiotensin II in adult rat cardiac fibroblasts[J]. Pathol Biol, 2015, 63(3):122-125.
[3] 黃志剛. IL-10 對血管升壓素誘導 SD 大鼠心臟成纖維細胞增殖和膠原合成的影響及其與心臟重構關系的研究[D]. 西安:第四軍醫大學, 2006.
[4] Kolwicz SC Jr, Tian R. Glucose metabolism and cardiac hypertrophy[J]. Cardiovasc Res, 2011, 90(2):194-201.
[5] Pena L, Angle B, Burton B, et al. Follow-up of patients with short-chain acyl-CoA dehydrogensae and isobutyryl-CoA dehydrogenase deficiencies identified through newborn screening: one center’s experience[J]. Genet Med, 2012,14(3):342-347.
[6] Zhou SG, Zhou SF, Huang HQ, et al. Proteomic analysis of hypertrophied myocardial protein patterns in renovascularly hypertensive and spontaneously hypertensive rats[J]. J Proteome Res, 2006, 5(11):2901-2908.
[7] Zeng Z, Huang Q, Shu Z, et al. Effects of short-chain acyl-CoA dehydrogenase on cardiomyocyte apoptosis[J]. J Cell Mol Med, 2016, 20(7):1381-1391.
[8] 曾振華, 黃秋菊, 黃金賢, 等. 短鏈酰基輔酶 A 脫氫酶在心肌細胞凋亡中的作用[J]. 中國病理生理雜志, 2015, 31(9): 1589-1594.
[9] Huang J, Xu L, Huang Q, et al. Changes in short-chain acyl-CoA dehydrogenase during rat cardiac development and stress[J]. J Cell Mol Med, 2015, 19(7):1672-1688.
[10]Wang P, Zhou S, Xu L, et al. Hydrogen peroxide-mediated oxidative stress and collagen synthesis in cardiac fibroblasts: blockade by tanshinone IIA[J]. J Ethnopharmacol, 2013, 145(1):152-161.
[11]Daskalopoulos EP, Janssen BJA, Blankesteijn WM. Myofibroblasts in the infarct area: concepts and challenges[J]. Microsc Microanal, 2012, 18(1):35-49.
[12]李 娜. PDE5 抑制劑 Sildenafil 對心梗后心衰線粒體能量代謝保護及機制研究[D]. 西安:第四軍醫大學, 2015.
[13]范 凡. 乙醛脫氫酶 2 缺失加重壓力超負荷誘導的心功能不全及心肌能量重構的機制研究[D]. 上海:復旦大學, 2014.
[14]黃秋菊, 黃金賢, 曾振華, 等. ERK1/2/PPARα/SCAD 信號途徑對生理性和病理性心肌肥大的調控[J]. 中國病理生理雜志, 2014, 30(8): 1427-1432.
[15]陸小龍. 拉西地平對心臟成纖維細胞增殖和膠原合成的影響及其信號轉導機制的研究[D]. 西安:第四軍醫大學, 2008.
[16]Duhaney TAS, Cui L, Rude MK, et al. Peroxisome proli-ferator-activated receptor α-independent actions of fenofibrate exacerbates left ventricular dilation and fibrosis in chronic pressure overload[J]. Hypertension, 2007, 49(5): 1084-1094.
[17]張 峰. 糖尿病性心肌病的發病機制及能量代謝干預對心肌保護作用的實驗研究[D]. 武漢:華中科技大學, 2007.
[18]Lal H, Ahmad F, Zhou J, et al. Cardiac fibroblast GSK-3β regulates ventricular remodeling and dysfunction in ischemic heart[J]. Circulation, 2014, 130(5):419-430.
(責任編輯: 林白霜, 羅 森)
Effects of short-chain acyl-CoA dehydrogenase on collagen expression and proliferation of rat cardiac fibroblasts
SHU Zhao-hui1, ZENG Zhen-hua1, HUANG Qiu-ju1, LI Zhong-hong1, LIU Pei-qing2, CHEN Shao-rui2, LAN Tian1, ZANG Lin-quan1, ZHOU Si-gui1
(1DepartmentofClinicalPharmacy,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;2DepartmentofPharmacologyandToxicology,SchoolofPharmaceuticalSciences,SunYat-senUniversity,Guangzhou510006,China.E-mail:zhousg201014@163.com)
AIM: To investigate the effect of short-chain acyl-CoA dehydrogenase (SCAD) on collagen expression and proliferation of rat cardiac fibroblasts and to explore the relationship between SCAD and cardiac fibrosis. METHODS: The model of proliferation and collagen expression of rat cardiac fibroblasts induced by angiotensin II was established. After treatment with siRNA-1186, the expression of SCAD at mRNA and protein levels, fatty acids beta oxidation rate, ATP, the enzyme activity of SCAD and free fatty acids in the rat cardiac fibroblasts were determined. RESULTS: The mRNA and protein expression of SCAD was decreased in the rat cardiac fibroblasts induced by angiotensin II compared with the control cells, and the expression of collagen I and collagen III was significantly upregulated. Compared with negative control group, SCAD expression and activity, fatty acid beta-oxidation rate and ATP significantly decreased in siRNA-1186 group, but the content of free fatty acids were obviously increased in the rat cardiac fibroblasts, and the expression of collagen I and collagen III was significantly up-regulated. CONCLUSION: The expression and synthesis disorder of collagen may be triggered by down-regulation of SCAD. SCAD may be a promising therapeutic target for myocardial fibrosis.
Short-chain acyl-CoA dehydrogenase; Cardiac fibroblasts; Myocardial fibrosis; Energy metabolism; Collagen
1000- 4718(2016)12- 2184- 08
2016- 04- 18
2016- 09- 13
國家自然科學基金資助項目(No. 81000072;No. 81670239);廣東省科技計劃(No. 2014A020212315);廣東省自然科學基金資助項目(No. 2016A030313729);廣東藥科大學“創新強校工程”研究生教育建設項目(No. 20140300);廣東省“十二五”醫學重點學科,依托廣東藥科大學附屬第一醫院、藥科學院。
R363
A
10.3969/j.issn.1000- 4718.2016.12.010
雜志網址: http://www.cjpp.net
△通訊作者 Tel: 020-39352123; E-mail: zhousg201014@163.com

