血管損傷對新生內膜增生的影響
袁吉祥,張亮,魏述軍
血管損傷對新生內膜增生的影響
袁吉祥,張亮,魏述軍
目的:研究血管損傷對新生內膜增生及核轉錄因子κb (NF-κb)、組織因子(TF)、內皮素-1(ET-1)、基質金屬蛋白酶3(MMP-3)的影響。
血管損傷;新生內膜;增生
(Chinese Circulation Journal, 2016,31:1210.)
盡管藥物洗脫支架的出現減少了支架內再狹窄(ISR)的發生,但ISR仍高達10%~15%。ISR是影響冠狀動脈介入手術效果的重要因素,極大地限制了經皮冠狀動脈介入治療(PCI)的獲益,特別是糖尿病或多支病變的冠心病患者[1]。從病理生理學角度看,ISR是機體對血管損傷的病理性修復反應,介入過程所導致的血管損傷和結構破壞導致新生內膜增生,新生內膜過度增生導致ISR。但是,目前血管損傷導致新生內膜增生的病理生理機制還不明確,內彈力膜在血管損傷中的作用還未揭示。本研究通過球囊擴張并拉傷兔子腹主動脈建立血管損傷模型,分析血管損傷對新生內膜增生及核轉錄因子κb (NF-κb)、組織因子(TF)、內皮素-1(ET-1)、基質金屬蛋白酶3(MMP-3)影響,探討血管損傷導致新生內膜增生的病理生理機制,為防治ISR提供生物學靶點。
1 材料與方法
實驗動物: 4~6個月齡雄性新西蘭大耳白兔32只,體重2.0~2.5 kg,由寧夏醫科大學實驗動物中心提供。
血管損傷模型的建立:分離右側股動脈,直視下穿刺并置入5F鞘管,經導絲引入后擴張球囊(3.5 mm×15 mm),以12 atm(1 atm=101.325 kPa)的壓力擴張并拉傷腹主動脈建立血管損傷模型[2]。
病理學切片的制作:術后28 d用注射空氣法處死兔子,開腹暴露腹主動脈,剝離拉傷的血管段,生理鹽水沖洗后固定于10%甲醛溶液。24 h后血管段常規石蠟包埋,間隔相同距離于血管段25%、50%、75%分位切片3次(切片厚度4 μm),行蘇木素伊紅(HE)染色,NF-κb免疫組化染色后光鏡下觀察。切片經鉛、鈾染色后透射電鏡下觀察。使用計算機圖像分析軟件測量血管標本新生內膜厚度,分析確定血管壁損傷積分。
根據內彈力膜損傷的情況血管壁損傷分級標準如下:1級,內皮損傷,內彈力膜無明顯損傷;2級,內彈力膜輕度損傷;3級,內彈力膜明顯損傷,未累及中膜;4級,內彈力膜破損,累及中膜;5級,內彈力膜破損,累及中膜、外彈力膜及外膜[3]。
血清檢驗:損傷術后1 min經股動脈鞘管采血,4周后經心臟采血,存放于-20℃冰箱。用酶聯免疫吸附法(ELISA)測定血清TF、ET-1和MMP-3含量。
統計分析:采用SPSS17.0統計軟件,正態分布計量資料用描述,相關性分析采用Pearson法,P<0.05為差異有統計學意義。
2 結果
兔腹主動脈損傷情況(圖1):術后4周,32只兔中30只順利完成實驗,共獲得30條受損血管段及相應切片。受損血管直徑為(3.40±0.16)mm,球囊/血管直徑比為1.12±0.06。光鏡下觀察內彈力膜,正常時為一條平緩的波浪線,損傷后表現為鋸齒狀的曲線,損傷越嚴重,鋸齒越密集且不規則。
透射電鏡下觀察新生內膜(圖2):可見新生內膜顯著增厚,損傷的內彈力膜呈現迂曲的波浪狀,平滑肌細胞穿過內彈力膜微孔及斷裂口向新生內膜遷移,新生內膜增生,線粒體、內質網、高爾基體以及溶酶體等細胞器顯著增多。
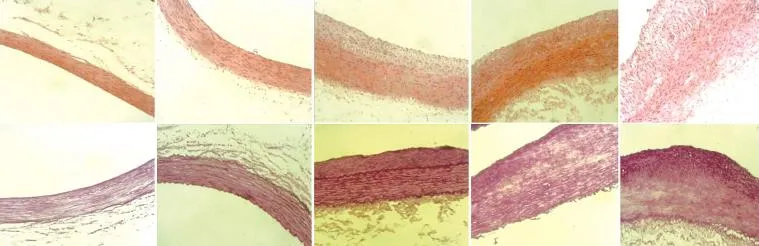
圖1 血管壁損傷分級情況(×100)

圖2 透射電鏡下觀察新生內膜(上排圖×500,下排圖×3000)
NF-κb免疫組化顯示(圖3):NF-κb主要在新生內膜中表達,血管損傷積分與NF-κb陽性細胞百分率呈正相關,Pearson相關系數為0.916(P<0.05)。
血管損傷積分與新生內膜厚度、TF、ET-1及MMP-3的相關性分析(圖4): 血管損傷積分與新生內膜厚度之間的最優擬合曲線是“S”形的三次曲線,曲線中間的部分增幅較大,它對應的橫坐標是3,也就是內彈力膜明顯損傷的部分。相關分析結果顯示:血管損傷積分與術后1 min TF,術后1 min和4周 后 的ET-1,術后1 min和4周后的MMP-3均呈正相關,Pearson相關系數分別為0.925、0.957、0.947、0.914和0.940( P均<0.05)。
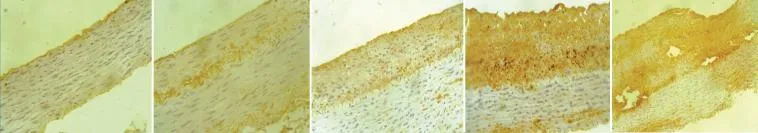
圖3 核轉錄因子-κb 免疫組化二甲基聯苯胺染色(DAB染色,×200)
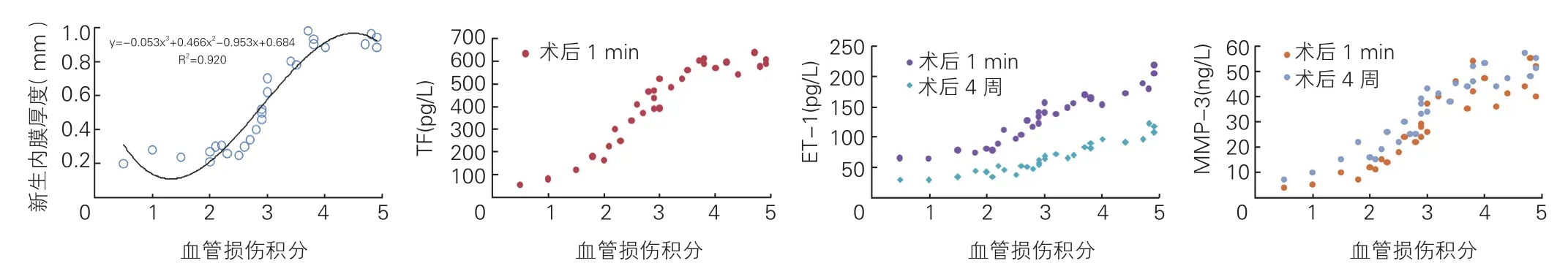
圖4 血管損傷積分與新生內膜厚度、TF、ET-1、MMP-3的相關性分析
3 討論
新生內膜形成和增生導致ISR是冠狀動脈支架置入后一個重要的病理生理事件,血管損傷或者結構破壞是導致新生內膜增生的重要原因[3]。但是PCI術中血管損傷是不可避免的,因為隨著膨脹的球囊或者支架把動脈粥樣硬化斑塊向外擠壓,內膜可能會撕裂,內彈力膜張力會不斷增大,當張力超過其代償范圍時內彈力膜就會損傷甚至斷裂,從而導致血管彈性降低。內彈力膜是由交叉排列的、密集的彈力纖維組成的,損傷或者斷裂后無法修復。為了維持正常的血管張力,機體會通過新生內膜增生來代償。在血管伴有鈣化、支架口徑偏大、擴張壓力過大等情況下,更容易出現內彈力膜的損傷。本實驗采用了曲線擬合的方法來體現血管損傷與新生內膜厚度之間的關系,最優擬合曲線是“S”形的三次曲線,表明血管壁各結構中內彈力膜是反映血管損傷的關鍵結構。
目前認為,血管損傷后新生內膜增生的機制主要是:內皮下組織暴露于血液后導致血小板在損傷局部的黏附、聚積,炎性細胞浸潤并釋放趨化、黏附、生長因子,刺激血管平滑肌細胞(VSMCs)通過內彈力膜遷移至內皮下,轉型為新生內膜并不斷增生,導致血管負性重構[4]。內彈力膜是阻礙上述過程發生的唯一屏障。內彈力膜損傷后,變形擴大的內彈力膜微孔或者斷裂的內彈力膜使VSMCs移行相對容易,因而加速了新生內膜的增厚。
TF是一種脂蛋白復合物,含有大量磷脂,是導致凝血系統激活的重要因素。在正常情況下TF不存在于循環中或不與循環血液接觸,只有當血管壁的完整性遭到破壞時,中膜膠原纖維暴露于血液,TF才會被組織細胞釋放于循環血液,通過外源性凝血途徑啟動凝血反應[5]。凝血反應導致血小板聚集和炎癥細胞浸潤并釋放趨化、黏附、生長因子,刺激中膜血管平滑肌細胞遷移至內皮下轉型為新生內膜。可見TF是血管損傷后導致新生內膜增生的始動因子。本實驗4周后血清TF未能檢測到,提示暴露的中膜膠原纖維已經被新生內膜所封閉。經皮冠狀動脈介入治療時球囊或支架擴張擠壓可引起內膜損傷或者撕裂,內皮下組織暴露,血管及血液細胞立即釋放TF,引起局部急性血栓形成,血栓可能被纖溶酶溶解或者逐漸被新生內膜機化。支架貼壁不良也容易導致血栓形成。血栓如果未造成急性缺血癥狀,可能會因為晚期機化而造成ISR。因此,支架內再狹窄也可能是支架內血栓機化的結果[6]。
NF-κb是一類特殊的蛋白質,具有和基因啟動子區的固定核苷酸序列結合而啟動基因轉錄的功能,參與調控許多與動脈粥樣硬化有關的靶基因的表達,在細胞增殖、分化中起重要作用[7]。本研究中免疫組化提示NF-κb主要在新生內膜中表達,提示血管損傷后細胞增生主要發生在新生內膜,另一方面提示內彈力膜的屏障作用。本實驗中血管損傷積分與新生內膜NF-κb陽性細胞率正相關提示血管損傷可激活新生內膜NF-κb途徑,繼而引發損傷修復相關靶基因的表達和活性因子的釋放,因而刺激新生內膜不斷增生。
ET-1是一種由21個氨基酸殘基組成的活性多肽,不僅存在于血管內皮,也廣泛存在于各種組織和細胞中,是一種內源性長效血管收縮調節因子,同時也是一種強效持久的促有絲分裂劑,可促進細胞增殖[8]。本研究血管損傷術后1 min ET-1釋放可能與內皮受到擠壓損傷有關,4周后ET-1持續表達可能與新生內膜不斷增生有關。血管損傷當時,由于內皮細胞受到擠壓刺激,立即釋放內皮素產生強烈的縮血管反應,同時NF-κb被激活與靶基因結合持續表達內皮素。隨著內皮細胞的壞死和剝脫,VSMC逐漸遷移至內皮下轉型為新生內膜。新生內膜持續表達內皮素可能是導致新生內膜增生的原因之一。
MMPs主要存在于溶酶體中,幾乎能降解細胞外基質中的各種蛋白成分。MMP-3屬于基質分解素,其作用底物廣泛,包括層粘連蛋白、纖連蛋白、彈性蛋白、蛋白聚糖等[9]。血管損傷后,膠原纖維暴露導致凝血系統激活,后者引發纖溶酶系統激活,繼而引起MMP-3釋放。MMP-3降解細胞外基質,從而有利于VSMC的遷移和新生內膜的增生,最后導致血管負性重構。本實驗通過透射電鏡觀察到血管損傷后新生內膜內溶酶體增多,可能是NF-κb活性增高導致MMP-3轉錄合成增多的表現。
總之,本實驗發現血管損傷可以通過激活NF-κb途徑,促進ET-1和MMP-3表達,從而促使新生內膜不斷增生,導致血管負性重構。TF是血管損傷后導致新生內膜增生的始動因子。內彈力膜是反映血管損傷的關鍵結構,是阻礙新生內膜增生的惟一屏障。因此內彈力膜損傷可以作為預測ISR的一項指標[10]。減少ISR的關鍵是PCI操作需細致謹慎,減少血管損傷,同時要求支架大小合適、緊密貼壁。血管內超聲或者光學相干斷層掃描有助于判斷血管直徑和支架貼壁情況,從而有助于減少ISR[11]。另外,本研究為防治ISR提供了生物學靶點,下調NF-κb 的活性、拮抗或者阻斷ET-1和MMP-3可能是防治ISR的新途徑。
本研究的不足之處:首先本研究結果是從兔腹主動脈血管損傷中獲得的,因此可能與人冠狀動脈的實際病理改變存在差別;第二,本研究中血管損傷模型是在非病變血管基礎上建立的,與PCI術中的血管損傷存在一定差距。
致謝:感謝寧夏醫科大學實驗中心的王潔、張琰老師,寧夏醫科大學總醫院病理科的馬愛玲、郭雅琪老師。
[1] 張文廣, 裴漢軍, 吳永健, 等. 藥物洗脫支架治療糖尿病合并冠狀動脈支架內再狹窄遠期療效及安全性觀察. 中國循環雜志, 2013, 28: 96-99.
[2] 王勇, 袁吉祥, 王磊. 牛磺酸抑制高脂合并高同型半胱氨酸血癥致兔動脈粥樣硬化的病理學改變. 中國老年學雜志, 2013, 33: 6227-6229.
[3] Swier VJ, Tang L, Krueger KD, et al. Coronary injury score correlates with proliferating cells and alpha-smooth muscle actin expression in stented porcine coronary arteries. PLoS One, 2015, 10: e0138539.
[4] Kashima Y, Takahashi M, Shiba Y, et al. Crucial role of hyaluronan in neointimal formation after vascular injury. PLoS One, 2013, 8: e58760.
[5] 黎娜, 李憲倫. 組織因子和組織因子途徑抑制物與心肌無復流. 中國循環雜志, 2011, 26: 317-319.
[6] Risheen R, Lotfi AS. Prevention of stent thrombosis: challenges and solutions. Vasc Health Risk Manag, 2015, 11: 93-106.
[7] Yoshida T, Yamashita M, Horimai C, et al. Smooth muscle-selective inhibition of nuclear factor-κb attenuates smooth muscle phenotypic switching and neointima formation following vascular injury. J Am Heart Assoc, 2013, 2: e000230.
[8] Kawanabe Y, Takahashi M, Jin X, et al. Cilostazol prevents endothelin-induced smooth muscle constriction and proliferation. PLoS One, 2012, 7: e44476.
[9] 黃捷, 馮艷, 韓凌, 等. 核糖核酸干擾基質金屬蛋白酶-3 基因對大鼠血管平滑肌細胞增殖的影響. 中國循環雜志, 2015, 30: 159-163.
[10] 李少君, 李寧, 李志韜, 等. 豬冠狀動脈內彈力板損傷對介入術后再狹窄的影響. 中國介入心臟病學雜志, 2010, 18: 340-344.
[11] 羅明華, 王賀, 關懷敏. 支架內新生動脈粥樣硬化研究進展. 中國循環雜志, 2014, 29: 848-851.
Impact of Vascular Injury on Neointimal Hyperplasia in Experimental Rabbit Model
YUAN Ji-Xiang, ZHANG Liang, WEI Shu-jun.
Department of Cardiology, People’s Hospital of Ningxia Hui Autonomous Region, Yinchuan (750001), Ningxia, China Corresponding Author: WEI Shu-jun, Email: weishujun1968@163.com
Objective: To study the impact of vascular injury on neointimal hyperplasia and the expressions of nuclear transcription factor-κb (NF-κb), tissue factor (TF), endothelin-1 (ET-1) and matrix metalloproteinase-3 (MMP-3) in experimental rabbit model.Methods:A total of 32 male New Zealand big-eared white rabbits were used to establish vascular injury model by femoral artery puncture, balloon was sent to abdominal aorta via the wire followed by balloon dilatation to strain abdominal aorta. Blood sample was taken from femoral artery sheath 1 minute after operation, and the rabbits were killed at 4 weeks after operation, meanwhile blood sample was taken from the heart. Injured arteries were isolated, fxed and embedded; slices were stained by HE, basic fuchsine and NF-κb immunohistochemical methods for light microscope observation; slices were also stained by lead and uranium for transmission electron microscope observation. Neointimal thickness was measured by computer analysis, vascular injury integral and NF-κb positive cell rate were determined, blood levels of TF, ET-1 and MMP-3 wereexamined by ELISA. The relationship between vascular injury integral and the contents of TF, ET-1, MMP-3 and NF-κb positive cell rate were analyzed by SPSS statistical software.Results: The optimal ftting curve between vascular injury integral and neointimal thickness was S-shaped cubic curve. NF-κb was mainly expressed in neointima, vascular injury integral was positively related to NF-κb positive cell percentage, Pearson correlation coefcient was 0.916, P<0.05. Vascular injury integral was positively related to the contents of 1 min post-operative TF; 1 min and 4 weeks post-operative ET-1; 1 min and 4 weeks post-operative MMP-3; Pearson correlation coefcients were 0.925, 0.957, 0.947, 0.914 and 0.940 respectively, all P<0.05.Conclusion: Vascular injury may activate NF-κb pathway, promote ET-1 and MMP-3 expression, therefore accelerating neointimal hyperplasia, leading negative vascular remodeling, TF was an initiating factor for neointimal hyperplasia. Internal elastic lamina was the key structure reflecting vascular injury, it is the only barrier hindering neointimal hyperplasia in experimental rabbit model.
Vascular injury; Neointima; Hyperplasia
2016-04-20)
(編輯:王寶茹)
寧夏自然科學基金(NZ14174)
750001 銀川市,寧夏回族自治區人民醫院(西北民族大學第一附屬醫院) 心內科
袁吉祥 副主任醫師 碩士 研究方向為冠心病基礎與介入技術 Email: 34232762@qq.com 通訊作者:魏述軍Email:weishujun1968@163.com
R54
A
1000-3614(2016)12-1210-05
10.3969/j.issn.1000-3614.2016.12.014
方法:對32只雄性新西蘭大耳白兔進行穿刺股動脈,經導絲送入球囊,球囊擴張并拉傷腹主動脈建立血管損傷模型。損傷術后1 min經股動脈鞘管采血,4周后經心臟采血,處死兔子,分離損傷血管,進行固定、包埋,切片行蘇木素伊紅(HE)染色、堿性品紅染色及NF-κb免疫組化染色后光鏡下觀察。切片經鉛、鈾染色后透射電鏡下觀察。使用計算機圖像分析軟件測量新生內膜厚度,分析確定血管壁損傷積分及NF-κb陽性細胞率,采用酶聯免疫吸附法(ELISA)測定血清TF、ET-1和MMP-3含量,利用SPSS統計軟件對血管損傷積分與血清TF、ET-1、MMP-3含量及NF-κb陽性細胞率進行相關性分析。
結果:血管損傷積分與新生內膜厚度之間的最優擬合曲線是“S”形的三次曲線。NF-κb主要在新生內膜中表達,血管損傷積分與NF-κb陽性細胞百分率呈正相關,Pearson相關系數為0.916(P<0.05)。血管損傷積分與術后1 min TF,術后1 min及4周ET-1,術后1 min及4周MMP-3含量均呈正相關,Pearson相關系數分別為0.925、0.957、0.947、0.914和0.940(P均<0.05)。
結論:血管損傷可以通過激活NF-κb途徑,促進ET-1和MMP-3表達,從而促使新生內膜不斷增生,導致血管負性重構。TF是血管損傷后導致新生內膜增生的始動因子。內彈力膜是反映血管損傷的關鍵結構,是阻礙新生內膜增生的唯一屏障。

