簡析化學實驗方案的設計與評價在高考中的考查
寧小進

化學實驗方案的設計與評價是高考中的高頻考點,主要考查中學化學實驗基礎知識、基本技能和實際實驗中的常識,涉及到物質的制備、混合物的分離與提純、物質及離子的檢驗、化學反應原理等知識點的考查。只有掌握了物質的性質和相關化學反應原理,側重分析和實驗技能的積累,才能更準確地解決此類問題,以達到題中的目的和要求。
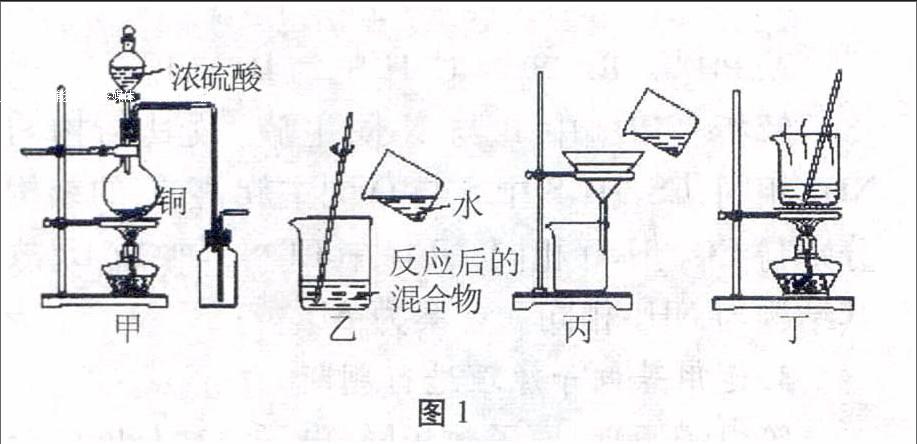
例1圖1所示實驗裝置應用于銅與濃硫酸反應制取二氧化硫和硫酸銅晶體,能達到實驗目的的是()。
圖1
A.用圖1甲裝置制取并收集二氧化硫
B.用圖1乙裝置向反應后的混合物中加水稀釋
C.用圖1丙裝置過濾出稀釋后混合物中的不溶物
D.用圖1丁裝置將硫酸銅溶液蒸發濃縮后冷卻結晶
解析本題以銅與濃硫酸反應制取二氧化硫和硫酸銅晶體為題材,結合圖示,考查了反應制備裝置、氣體收集原理及反應后物質的分離原理等。二氧化硫比空氣重,瓶口向上,又在密閉系統收集,故收集時進氣管應伸到瓶底,出口管在瓶口,故選項A錯誤。反應后的混合物有濃硫酸,濃硫酸密度比水大,稀釋放出大量的熱,圖1乙裝置是向反應后的混合物中加水稀釋,會導致水沸騰向外飛濺傷人,存在安全隱患,應把反應后的混合物慢慢加入水中并不斷攪拌,故選項B錯誤。圖1丙是考查了過濾操作,未用玻璃棒引流,故選項C錯誤。選項D是從硫酸銅溶液蒸發濃縮后冷卻結晶獲得硫酸銅晶體,故選項D正確。
答案:D
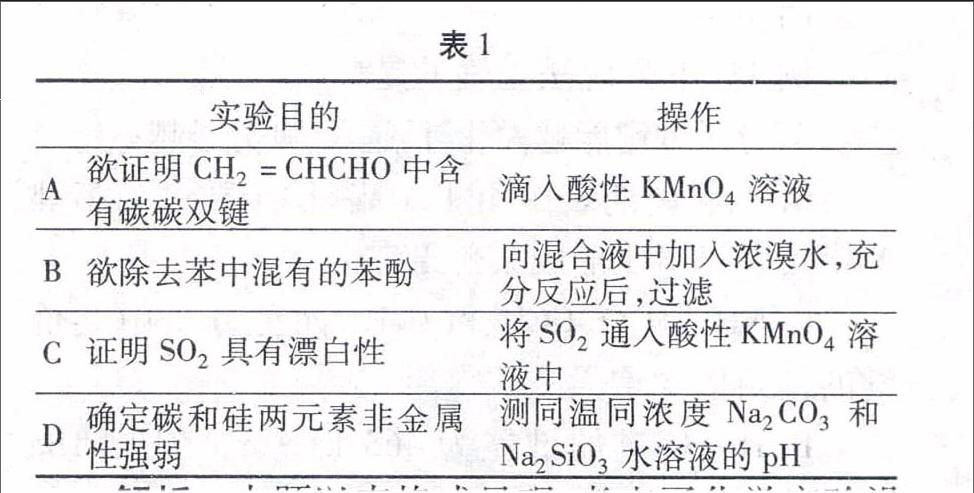
實驗目的操作
A欲證明CH2=CHCHO中含有碳碳雙鍵滴入酸性KMnO4溶液
B欲除去苯中混有的苯酚向混合液中加入濃溴水,充分反應后,過濾
C證明SO2具有漂白性將SO2通入酸性KMnO4溶液中
D確定碳和硅兩元素非金屬性強弱測同溫同濃度Na2CO3和Na2SiO3水溶液的pH
解析本題以表格式呈現,考查了化學實驗設計方案正誤判斷的知識。選項A的實驗目的用酸性KMnO4溶液來證明CH2=CHCHO中含有碳碳雙鍵,而CH2=CHCHO中含有碳碳雙鍵和醛基,酸性KMnO4溶液可以把兩者氧化而褪色,達不到證明CH2=CHCHO中含有碳碳雙鍵,故選項A錯誤。選項B的實驗目的是欲除去苯中混有的苯酚,苯酚與濃溴水反應生三溴苯酚不溶于水,但能溶于苯,所以除去了苯酚又引進了新的三溴苯酚雜質,故選項B錯誤。選項C欲證明SO2具有漂白性,SO2的漂白原理是SO2與某些有色物質溶液發生化學反應生成無色不穩定的物質量具有漂白性,而本題的操作是將SO2通入酸性KMnO4溶液中,是因為SO2的還原性,將酸性KMnO4還原而使酸性KMnO4溶液褪色,故選項C錯誤。選項D是利用了非金性越強,其對應的最高價含氧酸的酸性越強,形成的最高價含氧酸鈉鹽的水解程度就越弱的原理,因非金屬最高價含酸鈉鹽水解呈堿性,所以可利用測定溶液的pH大小來比較碳和硅兩元素非金屬性強弱,方案可行且好操作,故選項D正確。答案:D
例3圖2所列各裝置能夠達到相應實驗目的的是()。
圖2
A.用裝置甲除去乙酸乙酯中混有的少量乙酸
B.用裝置乙除去氯氣中的少量氯化氫
C.用裝置丙制取無水MgCl2
D.用裝置丁制取乙烯
解析圖2甲中NaOH濃溶液除去乙酸乙酯中混有的少量乙酸,乙酸乙酯在NaOH濃溶液中會發生水解而影響乙酸乙酯的產量,方案設計不嚴密,故選項A錯誤。圖2乙中的目的是用AgNO3溶液除去氯氣中的少量氯化氫,氯氣能與水反應生成鹽酸和次氯酸,與AgNO3反應生成AgCl沉淀,促進氯氣與水反應, AgNO3溶液也能吸收氯氣,所以選項B方案設計錯誤。MgCl2·2H2O在加熱時發生促進Mg2+的水解,生成Mg(OH)2, Mg(OH)2受熱分解生成MgO,所以在氯化氫氣流保護下抑制裝置Mg2+的水解,并以氯化氫氣流帶走結晶水,故選擇項C正確。圖2丁是用濃硫酸與乙醇在170℃條件下反應備乙烯,該反應對溫度控制要求較高,否則副反應較多,乙烯的產率低,溫度控制不好就得不到乙烯,若反應溫度在140℃時主要生成乙醚,所以要用溫度計來調控反應液的溫度,溫度計的水銀球應插入液面以下,故選項D錯誤。
答案:C
(收稿日期:2016-06-25)

