高血壓對大鼠腦基底動脈收縮和鈉泵活性的影響
王海燕,郝 亮,郭宇松,王永利,郭 煒
(1. 石家莊市第三醫(yī)院藥劑科,2. 河北醫(yī)科大學藥學院,河北 石家莊 050017)
高血壓對大鼠腦基底動脈收縮和鈉泵活性的影響
王海燕1,郝 亮1,郭宇松1,王永利2,郭 煒2
(1. 石家莊市第三醫(yī)院藥劑科,2. 河北醫(yī)科大學藥學院,河北 石家莊 050017)
目的 探討高血壓對大鼠腦血管收縮性的影響及其與鈉泵活性的關系。方法 取♂ Wistar大鼠(WR)和自發(fā)性高血壓大鼠(SHR)基底動脈環(huán),通過Multi Myograph張力換能系統(tǒng)記錄血管張力變化,比較兩種大鼠離體腦動脈對KCl和5-羥色胺(5-HT)的收縮反應,分析高血壓病變對腦血管收縮性和鈉泵活性的影響。結果 與WR基底動脈相比,SHR基底動脈的KCl和5-HT量效曲線明顯右移,再復K+所致血管舒張作用減弱,提示高血壓病變可明顯降低腦血管鈉泵活性及KCl和5-HT的收縮反應;哇巴因(Ouabain,OUA)濃度依賴性收縮SHR腦血管,其量效關系曲線可經兩點結合模型進行最佳擬合,Kd分別為:1.7×10-8mol·L-1和1.6×10-5mol·L-1,表明SHR腦基底動脈上存在高、低親和力兩種不同功能的鈉泵。用5×10-7mol·L-1和10-4mol·L-1的OUA分別抑制高、低親和力鈉泵,僅能在SHR而非WR腦血管明顯左移KCl和5-HT量效曲線,表明OUA可明顯增強KCl和5-HT對腦血管的收縮作用,且OUA增強5-HT收縮SHR腦血管的作用呈明顯的濃度依賴性(r=0.9393,P<0.05);在SHR腦血管,這兩個濃度OUA對KCl量效曲線的左移幅度無明顯差別,而對5-HT收縮量效曲線的左移幅度卻有明顯不同,提示僅高親和力鈉泵介導了SHR腦血管對KCl的收縮反應,而SHR腦血管對5-HT的收縮反應則由高、低親和力兩種鈉泵共同參與。結論 高血壓病變可明顯降低腦血管對血管收縮劑的反應性,其機制可能與高血壓所致鈉泵活性降低或鈉泵對OUA敏感性增加有關。
高血壓;基底動脈;血管收縮;KCl;5-HT;哇巴因;鈉泵
鈉泵,即Na+/K+-ATP酶,是目前所知哇巴因(ouabain,OUA)類藥物和內源性OUA類物質的唯一受體,鈉泵活化可通過超極化膜電位激活鈉鈣交換體(NCX)的正向轉運,減少細胞內Ca2+而舒張血管平滑肌[1-2],鈉泵抑制可通過胞質中Na+蓄積激活NCX的反向轉運,增加細胞內Ca2+而收縮血管平滑肌[3-4],因此,血管鈉泵活性的改變在調節(jié)血管收縮性方面具有重要作用。眾多研究已發(fā)現(xiàn),高血壓及其相關疾病發(fā)生后不僅可明顯降低其血管鈉泵活性[5],也往往伴隨著腦血管結構的改變[6]。抑制鈉泵活性可使細胞內Na+潴留,通過激活NCX的反向轉運,升高細胞質內Ca2+濃度,進而增強血管對血管收縮劑的反應,引起血管進一步收縮[7-9];而腦血管結構改變可通過增加血管壁/腔比例和血管壁僵硬度、縮小平滑肌細胞體積及減少平滑肌細胞內肌凝蛋白含量等,改變腦血管對血管收縮劑的反應性[10-12]。
目前已證實,在原發(fā)性高血壓、腦缺血和充血性心衰病人以及幾種高血壓動物模型血漿中內源性OUA的水平明顯升高[13-18],而OUA抑制劑PST2238可明顯降低鹽依賴性高血壓大鼠和部分原發(fā)性高血壓病人的血壓[19]。這些不僅提示內源性OUA升高可能與哺乳動物高血壓的發(fā)病、維持和發(fā)展密切相關,也表明這種高血壓所致的內源性OUA水平升高能夠改變腦血管對血管收縮劑的反應。本文旨在通過觀察高血壓狀態(tài)下大鼠腦基底動脈對經典血管收縮劑KCl和5-HT收縮反應的變化及OUA對二者的影響,探討OUA、鈉泵與血管收縮劑間的相互關系,為進一步尋找治療高血壓相關疾病的新策略提供實驗依據(jù)。
1 材料與方法
1.1 材料
1.1.1 儀器 MultiMyograph System-610M(Danish Myo Technology A/S);AG135電子天平(Metter Toled公司);解剖顯微鏡(日本Olympus公司);Millipore純水機(法國Millipore公司);LE5001型清醒大鼠鼠尾血壓心率測定儀(西班牙Panl.s.l公司)。
1.1.2 試劑 OUA(美國Sigma公司);乙酰膽堿(美國Sigma公司);5-HT(ALEXIS);KCl(天津化學試劑廠)。
1.1.3 實驗動物 Wistar大鼠(WR)為正常血壓對照鼠,體質量250 g~300 g,♂,由河北醫(yī)科大學實驗動物中心提供(冀醫(yī)動字第712065號);自發(fā)性高血壓大鼠(SHR)為高血壓模型鼠,6月齡,♂,由北京維通利華實驗動物中心提供(許可證號:SCXK(京)2007-0001)
1.2 實驗方法
1.2.1 鼠尾血壓測定 用LE5001型清醒大鼠鼠尾血壓心率測定儀分別測定WR和SHR的收縮壓(SYS)、舒張壓(DIA)和平均動脈壓(MED),連續(xù)測定3次,取平均值做為實驗數(shù)據(jù)。
1.2.2 血管張力的測定
1.2.2.1 標本的制備 取250 g~300 g ♂大鼠,腹腔注射戊巴比妥鈉45 mg·kg,待動物麻醉后斷頭處死,迅速取出全部腦組織,浸泡于預冷的4℃ PSS溶液中,除去軟腦膜,分離基底動脈。剪取2 mm左右的動脈環(huán)放入浴槽內,將兩根直徑為40 μm的鎢絲穿入環(huán)腔,固定血管環(huán)在Multi Myograph浴槽內傳感器的觸角上,給予最適前負荷。持續(xù)向浴槽液體內通入95%O2+5% CO2混合氣,浴槽內液體溫度保持在(37±0.5) ℃恒定,平衡60 min,平衡期間每15~20 min用預熱的PSS溶液(37℃)更換浴槽內液體1次,血管張力變化通過Myograph的張力換能系統(tǒng)描計在計算機上。
1.2.2.2 血管環(huán)的標準化 為了使血管環(huán)處于最佳反應狀態(tài),在正式實驗前對血管進行標準化。通過旋轉Myograph的螺旋測微尺逐步牽拉血管環(huán),測得每個直徑下血管環(huán)的張力變化值,通過與Myograph連接的Powerlab的內置軟件計算出每根血管環(huán)的最適前負荷,最后將螺旋測微尺旋至該位置。
1.2.2.3 血管活性檢測 為使血管環(huán)處于激活狀態(tài),在開始正式實驗前,按儀器說明書進行初始化操作,當最終使10-2mmol·L-1去甲腎上腺素所致2次血管收縮幅度的差別小于10%時,則認為血管收縮已穩(wěn)定,可用于后面實驗。收縮活性不好的血管棄置不用。
1.2.2.4 血管內皮完整性的檢測 血管活性檢測完畢后,平衡15 min,用終濃度10-6mmol·L-1的去甲腎上腺素預收縮血管環(huán),再加入終濃度為10-6mmol·L-1的乙酰膽堿,使預收縮的血管環(huán)產生60%~80%的舒張,則證明血管環(huán)內皮完整性較好,可進行以后的實驗。
1.2.2.5 高血壓對KCl收縮基底動脈量效曲線的影響 將內皮完整的WR和SHR基底動脈環(huán)固定于Multi Myograph浴槽內,待各項檢測合格后,分別向浴槽內加入KCl溶液,使其終濃度分別為20、30、40、60、80、100和120 mmol·L-1的。記錄兩種腦血管在各濃度KCl溶液下的收縮幅度,并以KCl濃度為橫坐標,以動脈環(huán)收縮幅度為縱坐標繪制量效曲線,比較高血壓病變對KCl收縮腦血管作用的影響。
1.2.2.6 高血壓對5-HT收縮基底動脈量效曲線的影響 將內皮完整的WR或SHR基底動脈環(huán)固定于Multi Myograph浴槽內,待各項檢測合格后,分別向浴槽內加入5-HT溶液,使其灌流濃度分別為10-9、10-8、3×10-8、10-7、3×10-7、10-6、3×10-6、10-5mol·L-1的。記錄兩種腦血管在5-HT溶液各濃度下的收縮幅度,并以5-HT對數(shù)濃度為橫坐標,以動脈環(huán)收縮幅度為縱坐標繪制量效曲線,比較高血壓病變對5-HT收縮腦血管作用的影響。
1.2.2.7 OUA對SHR基底動脈張力的影響 將內皮完整的SHR腦血管固定于Multi Myograph浴槽內,待各項檢測合格后,分別向浴槽內加入OUA溶液,使其灌流濃度分別為10-9、10-8、10-7、10-6、10-5、10-4、10-3mol·L-1的OUA溶液。記錄血管在各個濃度OUA作用下的收縮幅度。以10-3mol·L-1的OUA引起血管收縮的幅度為100%,計算各濃度OUA作用下的收縮百分率。以OUA對數(shù)濃度為橫坐標,以血管收縮百分率為縱坐標,繪制OUA量效曲線圖,并用Sigmaplot繪圖軟件按照2個結合位點模式進行曲線擬合,從而分析SHR腦基底動脈鈉泵高、低2個不同親和力α-亞基分布的特性,為鈉泵可能參與高血壓影響腦血管收縮作用提供實驗依據(jù)。
1.2.2.8 OUA對SHR腦血管K+-依賴性舒張的影響 K+-依賴性舒張是指將K+再加入到無K+溶液中時,可引起已被收縮的動脈環(huán)舒張。由于動脈環(huán)上的鈉泵活性在K+溶液中被完全抑制,當再加入K+時鈉泵被逐步激活而舒張血管,因此人們常把有無OUA存在時K+誘發(fā)的血管舒張程度差異作為評價鈉泵活性的指標[20]。將內皮完整的WR或SHR基底動脈環(huán)固定于Multi Myograph浴槽內,待各項檢測合格后,分別將浴槽內正常的PSS液替換為無K+的PSS液以抑制鈉泵活性,孵育30 min后再向浴槽內加入新福林,使浴槽內新福林的終濃度為3×10-6mol·L-1,待血管收縮至平臺期,再以濃度遞增方式依次向浴槽內加入KCl溶液,使其終濃度分別為1、2、4、6、8和10 mmol·L-1來激活鈉泵,記錄各濃度KCl溶液所致新福林收縮幅度的變化,以血管在無K+的PSS液存在情況下新福林的收縮幅度為100%,計算各濃度KCl溶液對新福林收縮幅度的影響。另取WR或SHR基底動脈環(huán),以含10-4mol·L-1的OUA溶液的無K+的PSS液孵育血管30 min,其他步驟同上,記錄并計算在OUA存在情況下各濃度KCl對新福林收縮幅度的影響。實驗結束后,分別以K+濃度為橫坐標,以各濃度KCl作用下的新福林收縮幅度為縱坐標繪制各處理組的量效曲線,分別計算WR和SHR腦血管有無OUA處理兩組間的曲線下面積差,并以此作為鈉泵活性指標比較高血壓對腦血管鈉泵活性的影響[21]。
1.2.2.9 OUA對KCl收縮SHR基底動脈量效曲線的影響 將內皮完整的WR或SHR腦血管固定于Multi Myograph浴槽內,待各項檢測合格后,向浴槽內加入終濃度為5×10-7mol·L-1(僅抑制高親和力鈉泵)或10-4mol·L-1(可抑制高、低親和力鈉泵)的OUA溶液,孵育30 min后,再向浴槽內加入KCl溶液,使其終濃度依次為20、30、40、60、80、100和120 mmol·L-1。記錄其在KCl各濃度下的收縮幅度,并以KCl濃度為橫坐標,以動脈環(huán)收縮幅度為縱坐標繪制量效曲線,從而分析參與高血壓影響KCl收縮腦血管作用的鈉泵亞型。
1.2.2.10 OUA對5-HT收縮 SHR基底動脈量效曲線的影響 將內皮完整的WR或SHR腦血管固定于Multi Myograph浴槽內,待各項檢測合格后,向浴槽內加入終濃度為5×10-7mol·L-1(僅抑制高親和力鈉泵)或10-4mol·L-1(可抑制高、低親和力鈉泵)的OUA溶液,孵育30 min后,再向浴槽內加入5-HT溶液,使其終濃度依次為10-9、10-8、3×10-8、10-7、3×10-7、10-6、3×10-6和10-5mol·L-1,記錄其在5-HT各濃度下的收縮幅度,并以5-HT對數(shù)濃度為橫坐標,以動脈環(huán)收縮幅度為縱坐標繪制量效曲線,從而分析參與高血壓影響5-HT收縮腦血管作用的鈉泵亞型。
1.2.2.11 不同濃度OUA對5-HT收縮SHR基底動脈作用的影響 將內皮完整的WR或SHR基底動脈環(huán)固定于Multi Myograph浴槽內,待各項檢測合格后,向浴槽內加入OUA溶液,使其終濃度分別為10-9、10-8、10-7、10-6、10-5、10-4、10-3mol·L-1,孵育30 min后,再向浴槽內灌流5×10-7mol·L-1的5-HT,分別記錄兩種腦血管在不同濃度OUA作用下5-HT所致動脈環(huán)收縮幅度的變化,并以OUA濃度為橫坐標,以各濃度OUA作用下5-HT所致動脈環(huán)收縮幅度為縱坐標繪制量效曲線,進一步比較高血壓病變對5-HT收縮腦血管作用的影響,并初步探討鈉泵是否參與高血壓對5-HT收縮腦血管作用的影響。
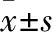
2 結果
2.1 大鼠血壓的測定 經LE5001型清醒大鼠鼠尾血壓心率測定儀測定,SHR的收縮壓(SYS)、舒張壓(DIA)和平均動脈壓(MED)分別為:(208.5±27.0)、(154.8±36.2)、(172.8±36.0) mmHg,明顯高于WR的收縮壓(117.0±6.8) mmHg、舒張壓(88.5±5.6) mmHg和平均動脈壓(96.5 ±4.09) mmHg(P<0.05)(Fig 1),1 mmHg=0.133 kPa,提示比較WR和SHR基底動脈對血管收縮劑的反應,可用于分析高血壓病變對腦血管收縮作用的影響及其機制。
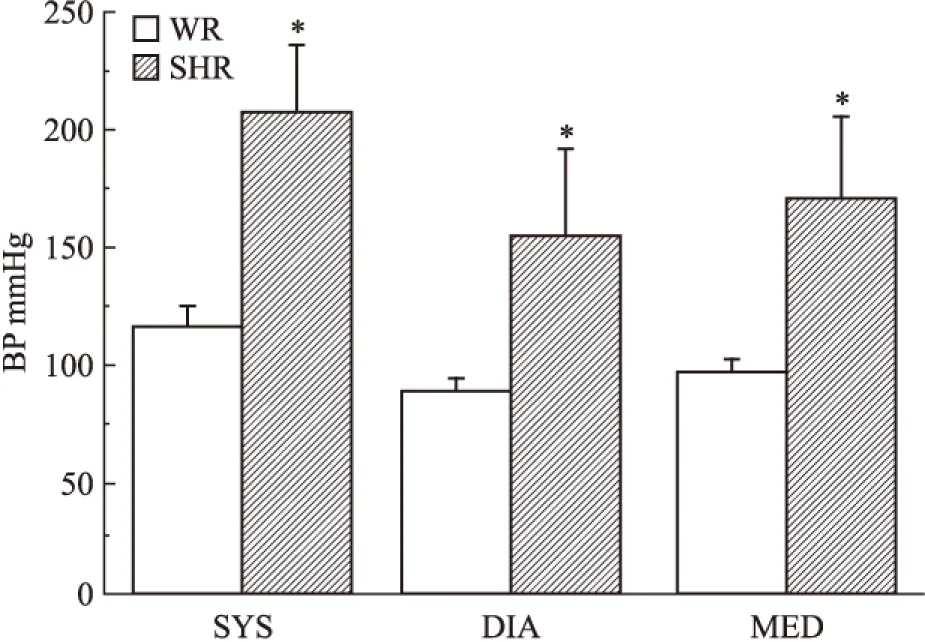
Fig 1 Comparison of blood pressure(BP) between Wistar rats(WR) and spontaneously hypertensive rats(SHR,n=6)
*P<0.05vsWR
2.2 高血壓對KCl收縮基底動脈量效曲線的影響 與WR基底動脈的KCl量效曲線相比,除了20 mmol·L-1的KCl溶液外,30、40、60、80、100和120 mmol·L-1的 KCl溶液在SHR腦血管產生的收縮力依次為0.17±0.02、0.32±0.08、0.48±0.08、0.64±0.08、0.67±0.08和0.73±0.08 mN,均明顯低于相應濃度KCl在WR腦血管產生的收縮力(0.42±0.152、0.84±0.19、1.19±0.23、1.49±0.24、1.50±0.22、1.46±0.22 mN)(P<0.05),使基底動脈的KCl量效曲線明顯右移(Fig 2),提示高血壓病變可明顯降低腦血管對KCl的收縮反應,最大降低幅度可達50%。
2.3 高血壓對5-HT收縮基底動脈量效曲線的影響 與WR基底動脈的5-HT量效曲線相比,除了10-9和10-8mol·L-1的5-HT溶液外,3×10-8、10-7、3×10-7、10-6和3×10-6mol·L-1的5-HT溶液在SHR腦血管產生的收縮力依次為0.14±0.02、0.41±0.06、0.89±0.16、1.90±0.25、2.05±0.29、1.78±0.24 mN,均明顯低于相應濃度的5-HT在WR產生的血管收縮作用(0.37±0.09、1.50±0.21、2.78±0.40、4.41±0.55、5.35±0.38、4.90±0.98 mN)(P<0.05),使基底動脈的5-HT量效曲線明顯右移(Fig 3),提示高血壓病變也可明顯降低腦血管對5-HT的收縮反應,最大降低幅度可達64%。
Fig 2 The effects of hypertension on cumulative concentration-response curves for contraction of isolated basilar artery rings induced by KCl in WR and SHR(n=6)
*P<0.05vsWR
2.4 OUA對SHR基底動脈張力的影響 已知鈉泵在調節(jié)血管張力方面具有關鍵作用,且OUA為經典的鈉泵抑制劑,為了探討鈉泵與血管收縮之間的關系,我們進一步觀察了OUA對SHR基底動脈張力的影響。實驗結果表明,10-9~10-3mol·L-1的OUA溶液可濃度依賴性引起基底動脈的收縮,且其量效關系曲線可經兩點結合模型進行最佳擬合(Fig 4),提示SHR腦基底動脈存在高親和力和低親和力兩種功能不同的鈉泵,其Kd值分別為1.7×10-8mol·L-1和1.6×10-5mol·L-1,故在以后的實驗中將5×10-7mol·L-1和10-4mol·L-1的OUA溶液分別用于抑制高、低親和力鈉泵亞基。
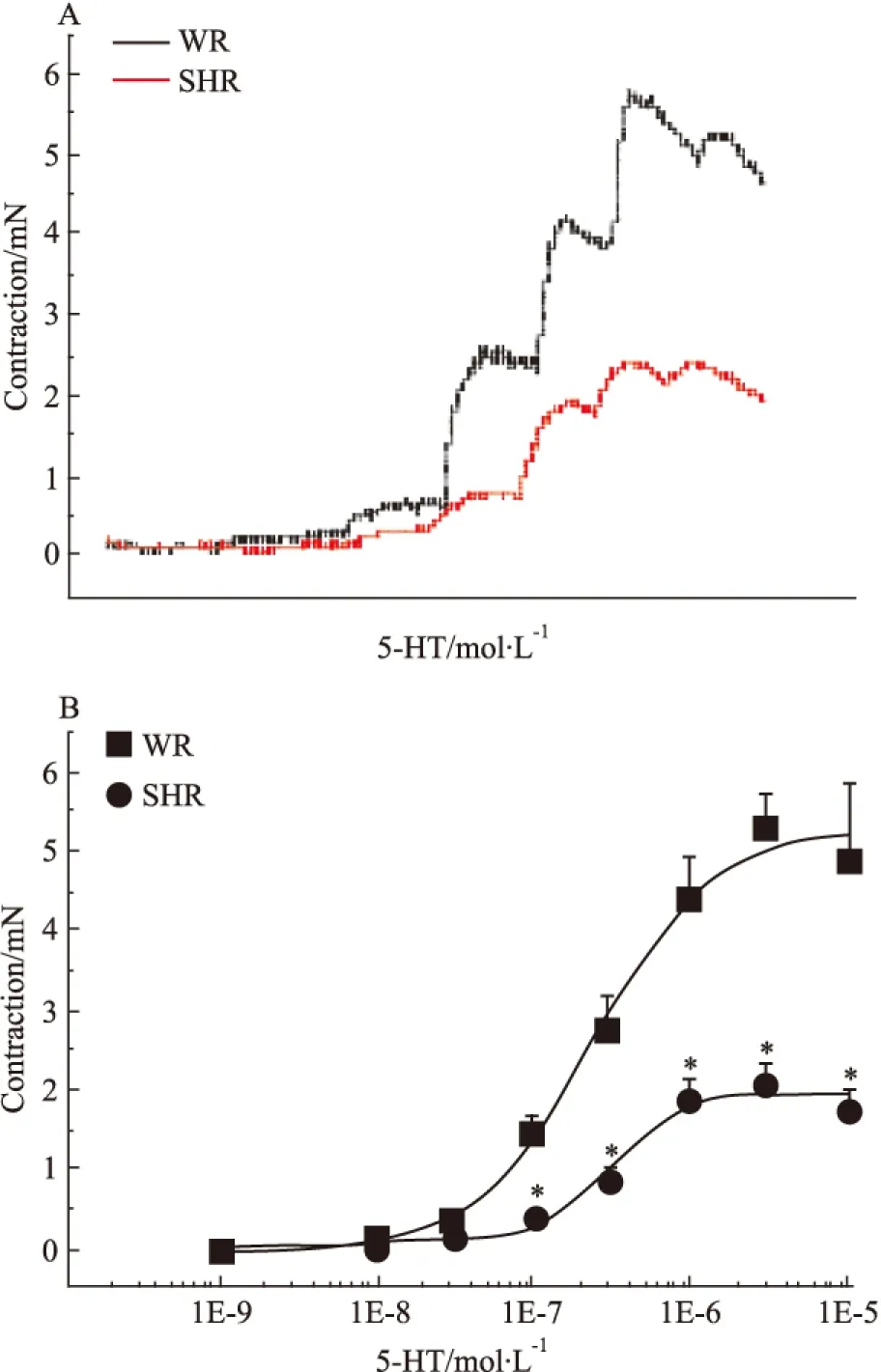
Fig 3 Effects of hypertension on cumulativ concentration-response curves for contraction of isolated basilar artery rings induced by 5-HT in WR and SHR(n=6)
*P<0.05vsWR

Fig 4 Cumulative concentration-response curves for contraction of isolated basilar artery rings induced by OUA in SHR
2.5 OUA對SHR基底動脈K+-依賴性舒張的影響 當去除灌流液中K+時鈉泵被抑制,當再加入K+時鈉泵被激活,導致膜超極化而關閉電壓依賴性鈣通道,進而降低細胞內鈣,松弛血管,這種K+誘發(fā)的血管舒張可被用作一種間接評價血管鈉泵活性的方法[20]。本實驗結果表明,當新福林使基底動脈環(huán)在無K+的PSS溶液中收縮至最大值時,再以濃度遞增方式依次向浴槽內加入KCl激活鈉泵,計算在不同濃度KCl溶液中基底動脈環(huán)收縮幅度與最大收縮的比值。在WR血管環(huán),此比值分別為1、0.53±0.06、0.21±0.05、0.14±0.03、0.12±0.04、0.12±0.04和0.14±0.04;在OUA預處理的WR血管環(huán),此比值分別為1、0.94±0.02、0.82±0.03、0.53±0.08、0.26±0.08、0.18±0.04和0.18±0.04;在SHR血管環(huán),此比值分別為1、0.78±0.07、0.53±0.07、0.23±0.06、0.14±0.03、0.15±0.03和0.17±0.05;在OUA預處理的SHR血管環(huán),此比值分別為1、0.91±0.01、0.91±0.02、0.90±0.03、0.73±0.03、0.63±0.06和0.58±0.06。這些結果表明,各血管對K+-依賴性舒張程度依次為WR血管>SHR血管>OUA處理WR血管>OUA處理SHR血管(Fig 5A)。這些舒張結果提示,鈉泵活性無論有無OUA存在,在SHR基底動脈均明顯低于WR基底動脈;而根據(jù)曲線下面積(AUC)計算的鈉泵活性變化值(Fig 5B)表明,OUA可明顯抑制鈉泵活性,10-4mol·L-1的 OUA溶液對SHR血管鈉泵活性的抑制程度(4.60±0.25)明顯大于其對WR血管鈉泵活性的抑制程度(2.54±0.25)(P<0.05),提示高血壓病變在降低腦血管鈉泵活性的同時可能會提高腦血管鈉泵對OUA敏感性。
2.6 OUA對KCl收縮SHR基底動脈量效曲線的影響 當用5×10-7mol·L-1的OUA溶液分別抑制WR和SHR腦血管高親和力鈉泵后,20、30、40、60、80、100及120 mmol·L-1的KCl溶液對這兩種腦血管產生的收縮力依次為0、0.39±0.07、0.85±0.11、1.39±0.16、1.63±0.18、1.57±0.16、1.53±0.15 mN和0、0.48±0.12、0.91±0.21、1.53±0.22、1.69±0.28、1.56±0.31、1.56±0.31 mN,二者之間無顯著性差異(P>0.05),與OUA未處理前KCl溶液對WR腦血管產生的收縮力相似,表明用OUA抑制腦血管高親和力鈉泵并不影響經典血管收縮劑KCL對正常血壓大鼠基底動脈的收縮作用,但可明顯增加KCl對高血壓大鼠基底動脈的收縮作用(P<0.05),使SHR腦血管的KCl量效曲線明顯左移(Fig 6A)。當用10-4mol·L-1的OUA溶液分別抑制WR和SHR腦血管高、低親和力兩種鈉泵后,上述濃度的KCl溶液對這兩種腦血管產生的收縮力依次為0、0.61±0.19、1.15±0.35、1.39±0.34、1.57±0.36、1.49±0.29、1.35±0.21 mN和0、0.54±0.28、0.96±0.22、1.46±0.34、1.60±0.30、1.65±0.30、1.69±0.29 mN,二者之間無顯著性差異(P>0.05),抑制幅度不僅與5×10-7mol·L-1的OUA溶液的抑制幅度相似,且也與OUA未處理前KCl對WR腦血管產生的收縮力相似,但可明顯增加KCl對高血壓大鼠基底動脈的收縮作用(P<0.05),提示抑制兩種親和力鈉泵對KCl所致兩種大鼠腦血管收縮作用的影響與僅抑制高親和力鈉泵的影響相似(Fig 6B)。從以上結果我們不難看出,無論抑制哪種鈉泵對KCl所致WR腦血管收縮力增加均無明顯影響(Fig 7A),但卻可明顯增強KCl所致的SHR腦血管收縮力增加,使其KCl量效曲線明顯左移,且兩個濃度OUA的影響并無明顯差別(Fig 7B),提示僅鈉泵高親和力α-亞基介導了KCl在高血壓大鼠腦血管誘發(fā)的收縮反應。
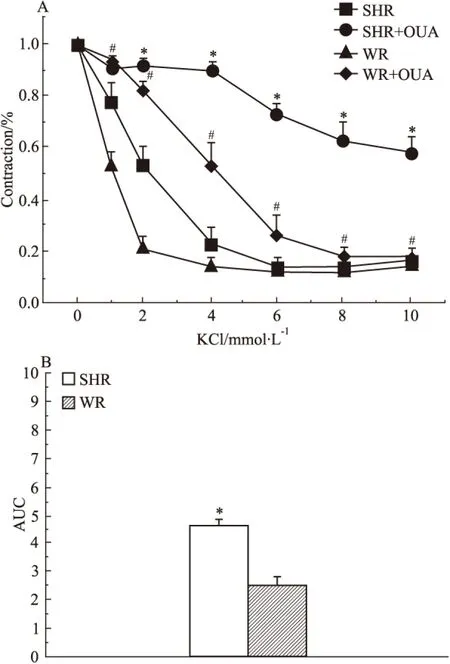
Fig 5 Effect of 0.1 mmol L-1OUA on cumulative concentration-response curves of isolated basilar artery and area under concentration response curve(AUC) contracted by KCl in WR and SHR(n=7)
A:*P<0.05vsSHR;#P<0.05vsWR;B:*P<0.05vsWR
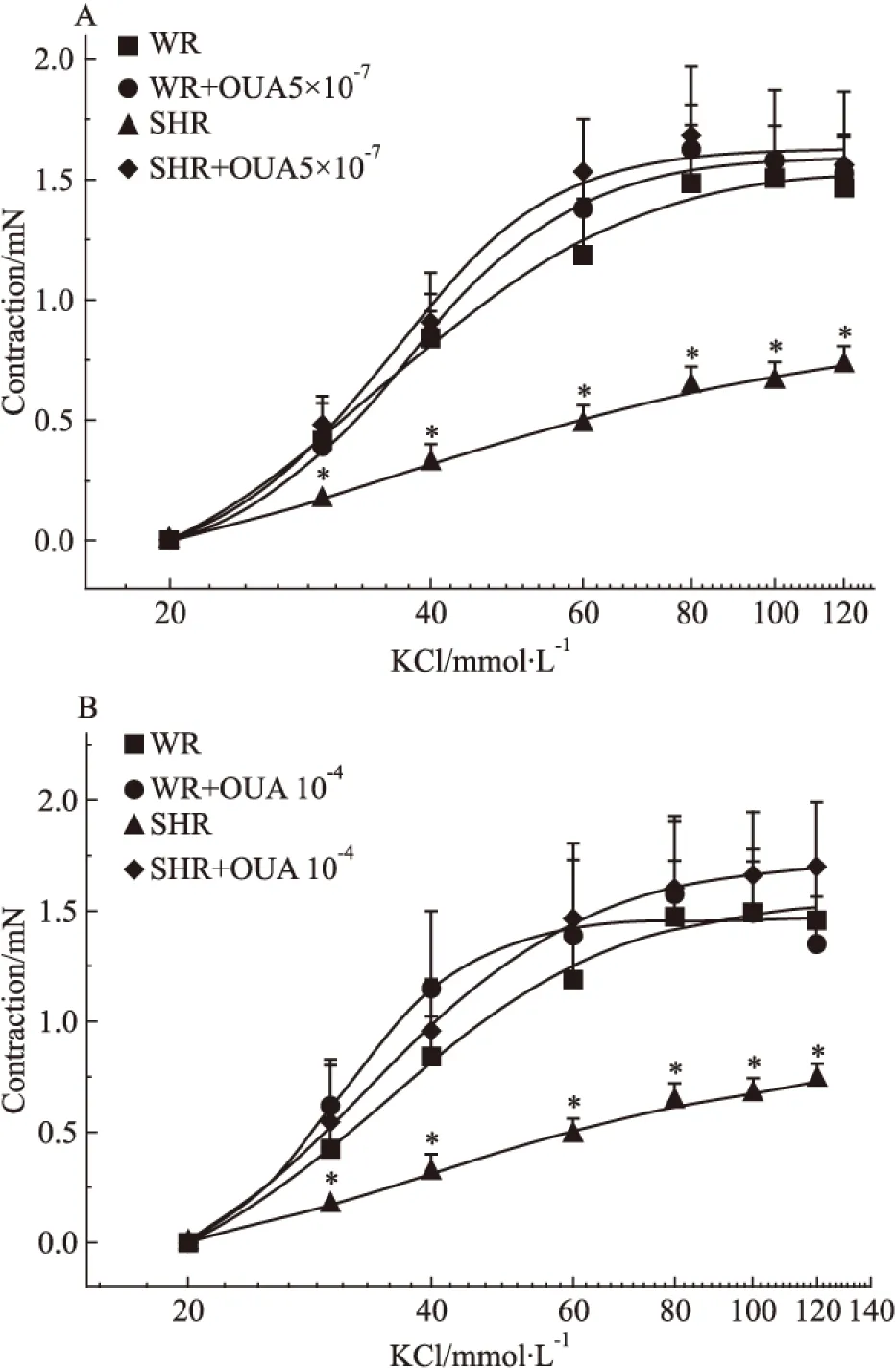
Fig 6 Effects of OUA on cumulative concentration-response curves of isolated basilar rings contracted by KCl in WR and SHR rats(n=6)
*P<0.05vsWR.A:SHR+OUA 5×10-7mol·L-1;B:SHR+OUA 10-4mol·L-1
2.7 OUA對5-HT收縮SHR基底動脈量效曲線的影響 當用5×10-7mol·L-1的OUA溶液預處理分別抑制WR和SHR腦血管高親和力鈉泵后,10-9、10-8、3×10-8、10-7、3×10-7、10-6、及3×10-6mol·L-1的5-HT溶液產生的收縮力依次為0、0.06±0.02、0.29±0.07、1.00±0.05、2.46±0.37、4.12±0.46、5.37±0.23、4.37±0.29 mN和0、0.06±0.01、0.17±0.02、0.69±0.06、1.44±0.22、2.66±0.23、3.10±0.27、2.81±0.22 mN;而用10-4mol·L-1的OUA溶液預處理分別抑制WR和SHR腦血管高、低兩種親和力鈉泵后,上述濃度的5-HT溶液產生的收縮力依次為0、0.09±0.03、0.30±0.06、1.05±0.13、2.88±0.36、4.84±0.40、5.56±0.29、4.87±0.28 mN和0、0.04±0.01、0.34±0.05、0.74±0.06、1.49±0.17、3.19±0.44、4.00±0.26、3.65±0.20 mN。無論用OUA抑制高親和力鈉泵(Fig 8A),還是抑制高、低兩種親和力鈉泵(Fig 8B),均不影響5-HT 所致的WR腦血管收縮(P>0.05),但卻明顯增強5-HT所致的SHR腦血管產生的收縮(P<0.05)。在WR腦血管,無論5×10-7mol·L-1還是10-4mol·L-1的OUA溶液預處理均對5-HT產生的收縮力無明顯影響(P>0.05)(Fig 9A),但在SHR腦血管卻能濃度依賴性提高5-HT產生的收縮力(P<0.05)(Fig 9B)。上述結果表明:抑制鈉泵并不影響5-HT所致正常大鼠腦血管收縮,只可明顯增強5-HT所致的高血壓大鼠腦血管的收縮力,使其5-HT量效曲線不同程度明顯左移,而且進一步提示高、低親和力兩種鈉泵α-亞基均參與了5-HT在高血壓大鼠腦血管誘發(fā)的收縮反應。
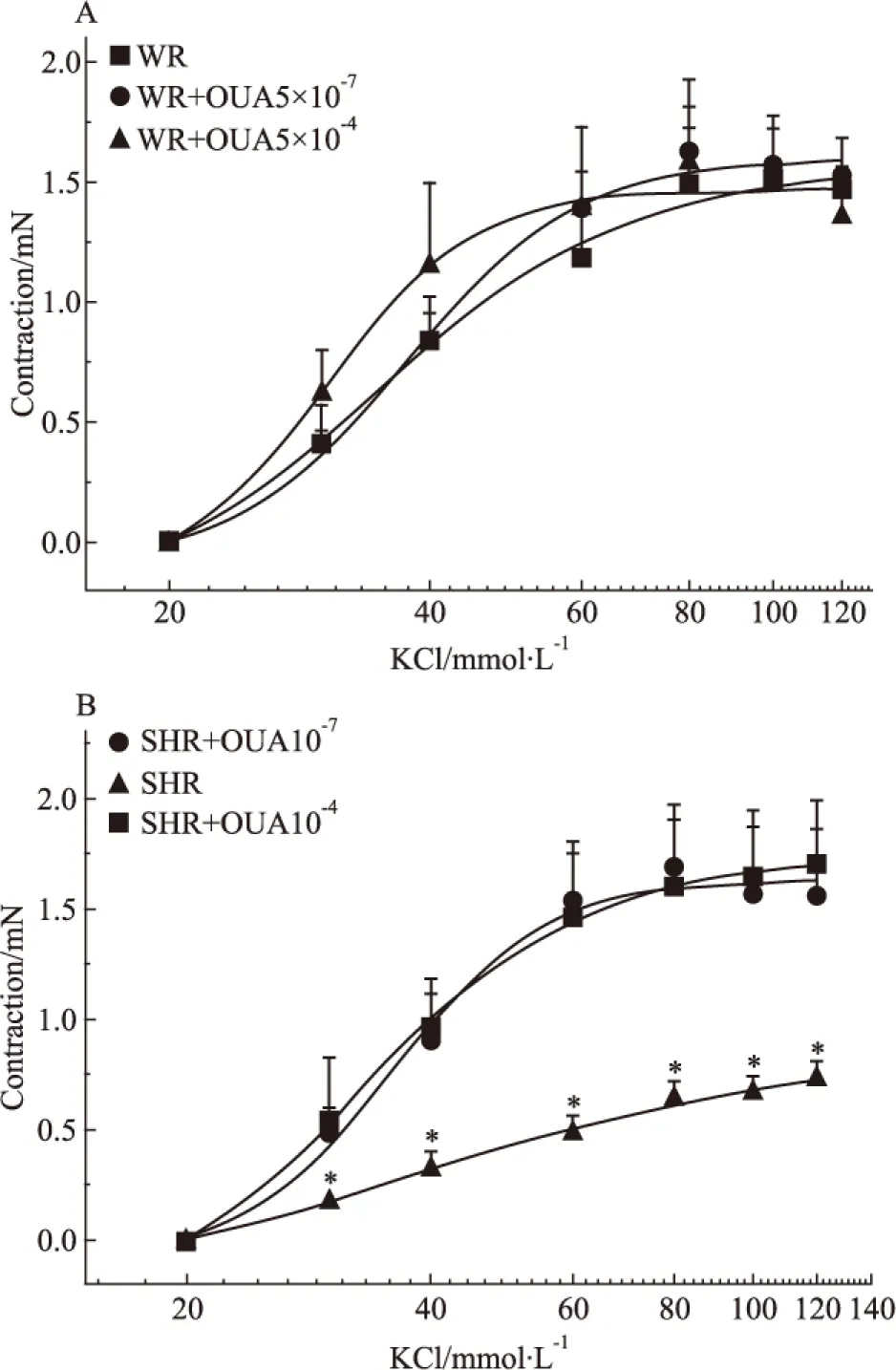
Fig 7 Effects of OUA on cumulative concentration-response curves for contraction of isolated basilar rings induced by KCl in WR and SHR rats(n=6)
*P<0.05vsWR.A:SHR+OUA 5×10-7mol·L-1;B:SHR+OUA 10-4mol·L-1
2.8 不同濃度OUA對5-HT收縮SHR基底動脈作用的影響 OUA為鈉泵抑制劑,5×10-7mol·L-1和10-4mol·L-1濃度的OUA溶液不影響正常大鼠,只增強高血壓大鼠腦血管對5-HT的收縮反應的原因是否為鈉泵抑制的結果呢?我們分別用10-9、10-8、10-7、10-6、10-5、10-4、10-3mol·L-1的OUA溶液孵育血管30 min后,再加入5×10-7mol·L-1的5-HT溶液,比較了其在WR或SHR對5-HT收縮基底動脈作用的影響。實驗結果表明,其在WR基底動脈產生的血管收縮力依次為3.95±0.47、4.04±0.49、4.51±0.48、4.64±0.40、4.40±0.43、4.64±0.43、4.19±0.38 mN,不同濃度OUA溶液對5-HT所致WR基底動脈收縮作用無明顯影響;而在SHR基底動脈產生的血管收縮力依次為2.01±0.19、2.38±0.09、3.15±0.24、3.17±0.19、3.52±0.38、3.67±0.50、3.66±0.56mN,明顯低于5-HT在WR基底動脈產生的收縮作用,且隨著OUA濃度的增高,5-HT收縮SHR基底動脈作用逐漸增強,且呈明顯的OUA濃度依賴關系(r=0.9393,P<0.05)(Fig 10)。這些結果不僅再次表明高血壓病變可明顯降低5-HT對腦血管的收縮作用,及鈉泵可選擇性參與高血壓大鼠腦血管對5-HT的收縮反應,而且進一步提示高血壓病變可能會增加腦血管對OUA的敏感性。
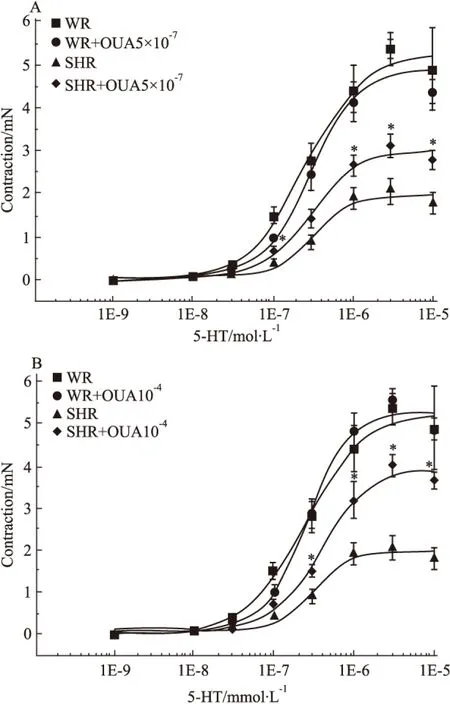
Fig 8 Effects of OUA on cumulative concentration-response curves for contraction of isolated basilar rings induced by 5-HT in WR and SHR(n=6)
*P<0.05vsSHR.A:WR+OUA 5×10-7mol·L-1;B:10-4mol·L-1
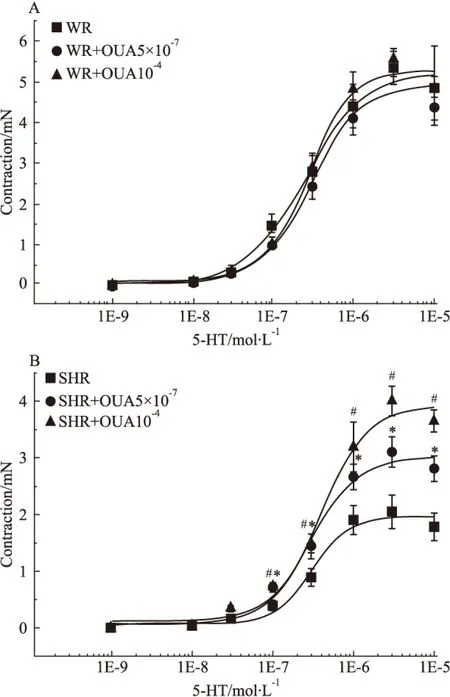
Fig 9 Effects of OUA on cumulative concentration-response curves for contraction of isolated basilar rings induced by 5-HT in WR and SHR(n=6)
#P<0.05,*P<0.05vsSHR
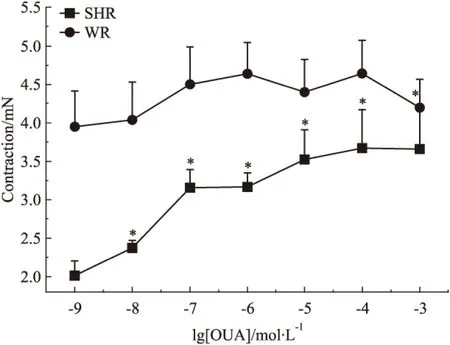
Fig 10 Cumulative concentration-response curves of isolated basilar rings induced by OUA in WR and SHR(n=6)
*P<0.05vsWR
3 討論
某些病理狀態(tài),如高血壓、腦缺血、缺氧及動脈粥樣硬化等可以損傷血管,導致血管功能障礙。本實驗發(fā)現(xiàn)高血壓可使內皮完整的大鼠腦基底動脈對KCl和5-HT的量效曲線明顯右移,明顯降低腦血管對縮血管物質的反應性。但無論在高血壓動物(SHR)還是正常血壓動物(WR)的基底動脈,5-HT引起的收縮明顯高于KCl引起的收縮,表明腦血管對5-HT收縮反應比對KCl的更敏感。鑒于KCl和5-HT引起血管收縮的機制分別與電壓依賴性鈣通道和受體操縱性鈣通道的鈣內流有關,且KCl和5-HT在去內皮的SHR和WR基底動脈誘發(fā)的收縮幅度幾乎相同[22],所以我們推測導致這種差別的主要原因可能與兩種鈣通道在血管內皮細胞不同分布有關。
已知鈉泵是目前所知OUA類藥物和內源性OUA類物質的唯一受體,是維持細胞基本生理功能的關鍵酶,并在血管緊張度的維持和血管收縮中起著重要作用[23]。鈉泵由α、β和γ 3個亞基構成,其中α亞基為催化亞基,目前發(fā)現(xiàn)有α1、α2、α3、α44種,其包含ATP、Na+、K+和OUA結合點[24]。在嚙齒類動物,不同的α亞基對OUA的親和力、離子通道動力學、以及鈣的敏感性均有所不同,故分為高親和力鈉泵和低親和力鈉泵,其中α1為低親和力鈉泵α亞基,而α2、α3屬于高親和力鈉泵α亞基。本研究結果也從功能學角度進一步表明,在SHR基底動脈上同時存在高親和力和低親和力α亞基,其Kd分別為1.7×10-8mol·L-1和1.6×10-5mol·L-1,與文獻報告的高親和力α2、α3亞基的Kh為3.8×10-8mol·L-1和低親和力α1亞基的Kl為1.4×10-5mol·L-1基本相符[25],提示本實驗所采用的5×10-7mol·L-1的OUA能抑制腦血管上高親和力鈉泵活性,而10-4mol·L-1的OUA能抑制腦血管的總泵(高親和力鈉泵+低親和力鈉泵)活性。OUA可通過抑制血管平滑肌細胞膜上的鈉泵提高局部的[Na+],而局部的[Na+]累積則可通過血管的NCX促進Ca2+進入細胞,提高血管的張力,進而導致高血壓的產生。
新福林在無K+溶液中誘發(fā)的血管收縮幾乎可以被再加入K+引起的濃度依賴性舒張完全翻轉,因為無K+時鈉泵可由于其對細胞外K+的敏感性而被完全抑制,當K+再被加入時可激活鈉泵而使細胞膜超極化,進而隨著Ca2+的外排觸發(fā)血管平滑肌舒張。這種K+誘發(fā)的血管舒張可被用作一種間接評價血管鈉泵活性的方法[20-21]。在無K+溶液中再加入K+可濃度依賴性舒張由新福林收縮的基底動脈環(huán),而且在本研究所用的所有K+濃度,這種K+誘發(fā)的腦血管舒張程度在SHR均明顯低于WR,提示高血壓病變可降低腦血管鈉泵的活性;但10-4mol·L-1的OUA在SHR抑制這種K+誘發(fā)的基底動脈舒張程度明顯大于其在WR的程度,這與文獻報道的10-3mol·L-1的OUA在SHR可完全抑制,而在WR僅部分抑制K+誘發(fā)的腦血管舒張程度的結果相一致[26],提示高血壓病變在降低腦血管鈉泵活性的同時可能會提高腦血管鈉泵對OUA敏感性。
當我們采用5×10-7mol·L-1和10-4mol·L-1的OUA溶液分別抑制腦血管的高親和力鈉泵和總泵活性后,再用不同濃度的5-HT或KCl灌流,發(fā)現(xiàn)2個濃度的OUA雖然對KCl和5-HT收縮正常血壓大鼠腦血管的量效關系曲線無明顯影響(Fig 7A,F(xiàn)ig 9A),但均能使KCl和5-HT收縮高血壓大鼠腦血管的量效關系曲線左移,可完全或部分對抗高血壓降低的KCl(Fig 6,F(xiàn)ig 7)或5-HT(Fig 8,F(xiàn)ig 9)對腦血管的收縮作用。這些結果提示,鈉泵只參與了高血壓大鼠腦血管對5-HT和KCl兩個血管收縮劑的收縮反應,而與正常血壓大鼠腦血管對這兩個血管收縮劑的收縮反應無關。對于高血壓降低的腦血管對KCl收縮反應,5×10-7mol·L-1的OUA可使之恢復至正常血壓腦血管對KCl的收縮反應水平(Fig 6A),且隨著OUA濃度增加至10-4mol·L-1后,KCl收縮高血壓大鼠腦血管的量效關系曲線也不再進一步左移(Fig 6B,F(xiàn)ig 7B),表明只抑制高親和力鈉泵即可以完全阻斷高血壓降低的KCl收縮腦血管的作用,即僅高親和力鈉泵α亞基參與了高血壓引起的腦血管對KCl收縮性的降低作用。對于高血壓降低的腦血管對5-HT收縮反應,其量效關系曲線雖然可被5×10-7mol·L-1和10-4mol·L-1的 OUA左移(Fig 9B),但二者均不能恢復至其在正常血壓腦血管對5-HT的收縮反應水平(Fig 8)。而且,當用不同濃度OUA分別孵育血管30 min后再灌流5×10-7mol·L-1的5-HT溶液,可以看到所有濃度的OUA均不影響正常血壓大鼠腦血管對5-HT的收縮反應,而在高血壓大鼠腦血管則不同,OUA可濃度依賴性(r=0.9393,P<0.05)增加5-HT所致的血管收縮力。這些結果提示,鈉泵不僅參與了高血壓所致腦血管對5-HT反應性的降低,而且是高、低親和力鈉泵共同參與了5-HT在高血壓腦血管的收縮反應。鈉泵抑制可通過胞質中Na+蓄積激活NCX反向轉運而收縮血管平滑肌[3-4]。腦血管對5-HT的敏感性增加可能在于OUA改變了腦血管對血管收縮劑的反應[6],也可能在于OUA對血管平滑肌的直接收縮作用[27-28]。
綜上所述,本研究表明高血壓病變可明顯降低腦血管對KCl和5-HT的收縮反應,而OUA卻可增強高血壓腦血管對KCl和5-HT的收縮反應,其機制可能與高血壓降低鈉泵活性或鈉泵對OUA敏感性增加有關。且僅高親和力鈉泵介導了SHR腦血管對KCl的收縮反應,而SHR腦血管對5-HT的收縮反應則由高、低親和力兩種鈉泵共同參與,也能增加腦血管鈉泵對OUA的敏感性。
(致謝:本實驗在河北省新藥藥理毒理研究實驗室完成,感謝河北醫(yī)科大學藥學院的王永利和郭煒兩位老師的指導,以及石家莊市第三醫(yī)院的郝亮和郭宇松兩位同志的幫助。)
[1] Mccarron J G,Halpern W. Potassium dilates rat cerebral arteries by two independent mechanisms[J].AmJPhysiol, 1990, 259(3 Pt 2): H902-8.
[2] Paulson O B, Newman E A. Does the release of potassium from astrocyte endfeet regulate cerebral blood flow[J].Science, 1987, 237(4817): 896-8.
[3] Fernández-Alfonso M S, Sánchez-Ferrer C F, Hernández M C, Marín J. Na+/Ca2+exchange mediation in the ouabain-induced contraction in human placental vessels[J].GenPharmacol, 1992, 23(3): 439-44.
[4] 孟 巖,羅 紅,任曉華,王永利. Na+/K+泵參與缺氧誘發(fā)的大鼠腦血管收縮的體外研究[J]. 中國藥理學通報, 2013, 29(9): 1307-12.
[4] Meng Y,Luo H,Ren X H, Wang Y L. Na+, K+-ATPase involes in contraction of rat cerebral artery induced by anoxia[J].ChinPharmacolBull, 2013, 29(9): 1307-12.
[5] Marín J, Redondo J. Vascular sodium pump: endothelial modulation and alterations in some pathological conditions[J].PharmacolTher, 1999, 84(3): 249-71.
[6] Winquist R J, Bohr D F. Structural and functional changes in cerebral arteries from spontaneously hypertensive rats[J].Hypertension, 1983, 5(3): 292-7.
[7] Leenen F H. The central role of the brain aldosterone-“ouabain” pathway in salt-sensitive hypertension[J].BiochimBiophysActa, 2010, 1802(12): 1132-9.
[8] Blaustein M P, Zhang J, Chen L, et al. The pump, the exchanger, and endogenous ouabain signaling mechanisms that link salt retention to hypertension[J].Hypertension, 2009, 53(2): 291-8.
[9] Blaustein M P, Hamlyn J M. Signaling mechanisms that link salt retention to hypertension: Endogenous ouabain, the Na+pump, the Na+/Ca2+exchanger and TRPC proteins[J].BiochimBiophysActa, 2010, 1802(12): 1219-29.
[10]Payne R A, Webb D J. Arterial blood pressure and stiffness in hypertension: is arterial structure important[J].Hypertension, 2006, 48(3): 366-7.
[11]Schiffrin E L. Remodeling of resistance arteries in essential hypertension and effects of antihypertensive treatment[J].AmJHypertens, 2004, 17(12 Pt 1): 1192-200.
[12]蓋祥云,林鵬程,何彥峰,才讓南加.低氧性肺動脈高壓中低氧性肺血管收縮的作用[J]. 中國藥理學通報, 2016, 32(6): 768-72.
[12]Gai X Y, Lin P C, He Y F, Cai R N J. Effect of hypoxic pulmonary vasoconstriction on hypoxic pulmonary hypertension[J].ChinPharmacolBull, 2016, 32(6):768-72.
[13]Hamlyn J M, Ringel R, Schaeffer J, et al. A circulating inhibitor of (Na/K) ATPase associated with essential hypertension[J].Nature, 1982, 300(5893): 650-2.
[14]Gottlieb S S, Rogowski A C, Weinberg M, et al. Elevated concentration of endogenous ouabain in patients with congestive heart failure[J].Circulation, 1992, 86(2): 420-5.
[15]Hamlyn J M, Hamilton B P, Manunta P. Endogenous ouabain, sodium balance and blood pressure: a review and a hypothesis[J].JHypertens, 1996, 14(2): 151-67.
[16]Manunta P, Stella P, Rivera R, et al. Left ventricular mass, stroke volume, and ouabain-like factor in essential hypertension[J].Hypertension, 1999, 34(3): 450-6.
[17]Schoner W. Endogenous cardiac glycosides, a new class of steroid hormones[J].EurJBiochem, 2002, 269(10): 2440-8.
[18]Saunders R, Scheiner-Bobis G. Ouabain stimulates endothelin release and expression in human endothelial cells without inhibiting the sodium pump[J].EurJBiochem, 2004, 271(5): 1054-62.
[19]Ferrari P. Rostafuroxin: an ouabain-inhibitor counteracting specific forms of hypertension[J].BiochimBiophysActa,2010, 1802(12):1254-8.
[20]Rossoni L V,Salaices M,Marín J, et al. Alterations in phenylephrine-induced contractions and the vascular expression of Na+, K+-ATPase in ouabain-induced hypertension[J].BrJPharmacol, 2002, 135(3): 771-81
[21]Webb R C, Bohr D F. Potassium-induced relaxation as an indicator of Na+-K+ATPase activity in the vascular smooth muscle[J].BloodVessels,1978, 15(1-3):198-207.
[22]Yokota Y, Imaizumi Y, Asano M, et al. Endothelium-derived relaxing factor released by 5-HT: distinct from nitric oxide in basilar arteries of normotensive and hypertensive rats[J].BrJPharmacol, 1994, 113(1): 324-30.
[23]Marín J, Redondo J. Vascular sodium pump: endothelial modulation and alterations in some pathological processes and aging[J].PharmacolTher, 1999, 84(3): 249-71.
[24]Blanco G,Mercer R W. Isozymes of the Na-K-ATPase: heterogeneity in structure, diversity in function[J].AmJPhysiol, 1998, 275(5 Pt 2):F633-50.
[25]劉 倩,郭會彩,張麗男,王永利. Na+,K+-ATP酶參與大鼠皮層神經元NMDA電流的調節(jié)[J].中國藥理學通報, 2011, 27(1): 117-21.
[25]Liu Q, Guo H C, Zhang L N, Wang Y L. Comprehensive study of N-methyl-D-aspartate current involving Na+, K+-ATPase in rat cortical neuron[J].ChinPharmacolBull, 2011, 27(1):117-21.
[26]Arvola P,P?rsti I,Vuorinen P, et al. Contractions induced by potassium-free solution and potassium relaxation in vascular smooth muscle of hypertensive and normotensive rats[J].BrJPharmacol, 1992, 106(1): 157-65.
[27]Marín J,Sánchez-Ferrer C F,Salaices M. Effects of ouabain on isolated cerebral and femoral arteries of the cat: a functional and biochemical study[J].BrJPharmacol, 1988, 93(1): 43-52.
[28]Rodríguez-Maas L,Sánchez-Ferrer C F,Pareja A, et al. Neurogenic component of ouabain-evoked contractions is modulated by the endothelium[J].Hypertension, 1994, 23(1): 10-7.
Effect of hypertension on vascular contraction and sodium pump activity in rat cerebral basilar artery
WANG Hai-yan1, HAO Liang1, GUO Yu-song1, WANG Yong-li2, GUO Wei2
(1.DeptofPharmacy,theThirdHospitalofShijiazhuang, 2.SchoolofPharmacy,HebeiMedicalUniversity,Shijiazhuang050017,China)
Aim To explore the effects of hypertension on the contractibility of rat basilar artery and its interactions with the sodium pump activity.Methods The basilar artery was respectively isolated from Wistar and SHR rats,and the isometric tension of arterial rings was measured by Multi Myograph System-610M. The contractibilities of arterial rings induced by KCl or 5-HT were compared between the basilar arteries of the two groups of rats to analyze the effect of hypertension on the cerebral vascular tension and the activity of sodium pump. Results In SHR rats, the concentration-response curves of the contraction of isolated basilar artery rings induced by KCl and 5-HT were significantly shifted to right, and the relaxation of vascular tone induced by K+which was reintroduced from the external was attenuated compared with those in the WR. These results suggested that hypertension could significantly decrease the activity of the sodium pump and the contractile responses of KCl and 5-HT. OUA could contract the basilar artery in a concentration-dependent manner, and its concentration-response curve was optimally fitted by a two-site binding model: Kd was 1.7×10-8and 1.6×10-5mol·L-1, respectively. The results indicated that the two different function sodium pumps existed in the rat basilar artery: one with the high OUA affinity and the other with the low OUA affinity. If the high and low affinity sodium pumps were inhibited by 5×10-7and 10-4mol·L-1OUA, respectively, the concentration-response curves of KCl and 5-HT would shift to left in SHR rats but not in WR rats. It suggested that OUA could enhance the contraction induced by KCl and 5-HT significantly, and a concentration-dependent effect was observed in the SHR vascular contraction induced by 5-HT(r=0.9393,P<0.05). When the two concentrations of OUA were applied, there was no significant difference in the shift left of the concentration-response curves induced by KCl in the SHR cerebral vessels. However, the marked difference was shown in the shift left induced by 5-HT. The results implied that only the high affinity sodium pump was involved in the contractile response of SHR cerebral vascular to KCl, whereas, the contractile response of SHR cerebral vascular to 5-HT was induced by both high and low affinity sodium pumps.Conclusion Hypertension could lower the contractile response of the basilar artery to vasoconstrictors, and the mechanism might relate to the decreased sensitivity of the sodium pump induced by hypertension or the increased sensibility of the sodium pump to OUA.
hypertension; basilar artery; vascular contraction; KCl; 5-HT; OUA; sodium pump
時間:2016-12-27 16:13
http://www.cnki.net/kcms/detail/34.1086.R.20161227.1613.028.html
2016-09-06,
2016-11-27
王海燕(1982-),女,碩士,主管藥師,研究方向:藥理學,E-mail: carinawang@163.com; 郭 煒(1979-),女,博士,副教授,研究方向:藥代動力學,通訊作者,E-mail: guowei8043586@sina.com
10.3969/j.issn.1001-1978.2017.01.014
A
1001-1978(2017)01-0074-10
R-332;R322.121;R329.2;R331.32;R544.1;R972.1;R977.3