在體測量大鼠缺血性腦損傷引起的腦組織電阻抗變化及組織形態學對照研究
宋佳麗,楊琳,亢君君,李昊庭,董秀珍,付峰
1.第四軍醫大學 生物醫學工程系,西安 陜西 710032;2.第四軍醫大學 基礎部,西安 陜西 710032
在體測量大鼠缺血性腦損傷引起的腦組織電阻抗變化及組織形態學對照研究
宋佳麗1,楊琳1,亢君君2,李昊庭1,董秀珍1,付峰1
1.第四軍醫大學 生物醫學工程系,西安 陜西 710032;2.第四軍醫大學 基礎部,西安 陜西 710032
目的用電阻抗的變化趨勢區分缺血腦卒中及其繼發性腦水腫。方法 采用兩電極法連續在體測量腦缺血大鼠腦組織的電阻抗,觀察分析卒中后腦組織電阻抗隨時間的變化規律,并用Image-Pro Plus分析微觀形態學參數,作為腦卒中后電阻抗變化的對照和驗證。結果大鼠腦組織在缺血6~8 h后,電阻抗達到峰值,與正常腦組織的電阻抗相比高10%~20%,隨后大鼠缺血腦組織的電阻抗降低,同時缺血腦組織電阻抗的變化與微觀形態學參數的變化有良好的相關性。結論大鼠缺血腦組織電阻抗隨大鼠腦缺血時間的變化趨勢表明,生物電阻抗測量技術有望用于區分缺血性腦卒中和卒中后的腦水腫。
心腦血管疾病;缺血性腦卒中;腦水腫;生物電阻抗測量;微觀形態學分析
引言
中國作為全世界腦卒中致死致殘率最高的國家,每年有250萬新發腦卒中患者,有140萬人死于腦卒中[1-2]。腦卒中分為缺血性腦卒中和出血性腦卒中,其中缺血性腦卒中占75%~90%[3]。腦卒中會引起繼發性腦水腫,腦卒中和腦水腫的治療方案不同,因此這兩種腦損傷的診斷和區分、腦卒中的實時監測極為重要。現有的X-CT和MRI技術無法診斷早期的缺血性腦卒中、區分缺血性腦卒中和腦水腫、監測腦卒中。因此,臨床上急需診斷監測腦卒中的新技術。
生物電阻抗測量技術是一種新型測量技術,早在1926 年Fricke H和 Morse S就提出將電阻抗測量技術用于乳腺癌的檢測[4],由于生物電阻抗測量技術具有無創、無輻射、廉價等優勢[5],這些優勢吸引很多學者探索了生物電阻抗測量技術檢測診斷顱腦損傷[6-8]、宮頸癌[9]、膀胱癌[10]、肺功能障礙[11]等疾病的途徑。我們研究小組致力于研究生物電阻抗測量技術在顱腦損傷監測方面的應用,同時還有很多國內外研究小組致力于此方向的研究。
1972年,Fujita等將貓腦冷凍引起腦水腫,采用四電極法在體測量腦部電阻抗,腦損傷組織的阻抗值與正常腦相比下降了25%[12]。2002年,Lingwood等報道稱缺氧引起小豬腦損傷后的6 h內腦部電阻抗增加,并證明電阻抗測量技術對腦水腫的敏感性比顱內壓監測技術高[13]。2008年,Harting等在體測量外傷性腦損傷大鼠的腦組織的阻抗值,發現外部撞擊損傷60 h后的大鼠的損傷腦組織相比于正常腦組織有明顯的下降[14]。2013年,達特摩斯大學的Manwaring等在家豬的腦白質中注入新鮮血液,測得注血后的腦組織的電導率升高(19.5±11.5)mS/m[15]。2015年,Holder研究小組分別用兩電極法和四電極法在體測量大鼠的正常腦組織和缺血腦組織的電阻抗,離體測量血塊的電阻抗,發現在0~3 kHz的頻率范圍,缺血腦組織的阻抗值高于正常腦組織阻抗值[16]。這些研究明確地表明腦損傷的生物物理學變化會引起腦組織生物電阻抗的變化,因此,生物電阻抗測量技術有望成為診斷監測腦損傷的新技術。然而,不同研究小組模型制備方法不同,導致腦損傷的種類不同,其后形成繼發性腦水腫的生物物理學機制也不同;再者,不同研究小組測量的時間點也不同,測得的電阻抗的變化規律都是腦損傷某個階段的電阻抗的變化規律,由于從初期的腦損傷到其后的繼發性腦水腫,腦組織的生物物理變化并不相同,宏觀上自然表現出電阻抗變化的不同。這些不同導致目前研究結果的不一致,使生物阻抗測量技術距離顱腦疾病的臨床監測還有一定差距,因此,探究腦損傷發展過程中電阻抗的變化趨勢是生物電阻抗技術應用于顱腦損傷臨床監測的必經之路。本研究試圖利用腦組織在不同狀態下阻抗值不同的特性,用生物電阻抗技術來診斷、區分缺血性腦卒中和腦水腫。
1 實驗材料及方法
1.1 實驗方案
1.1.1 動物準備
從第四軍醫大學實驗動物中心領取體重為250~300 g的雄性大鼠22只,飼養溫度為23~25°C,飼養時不控制大鼠的飲食。實驗過程嚴格遵守動物倫理委員會的管理條例,所有動物實驗方案經第四軍醫大學動物倫理委員會批準。
1.1.2 腦缺血動物模型制備
大鼠用10%水合氯醛(3.5 mg/kg)腹腔注射麻醉,仰臥固定,頸正中線偏右1 mm切口1.5~2 cm,沿胸鎖乳突肌方向分離右側頸總動脈(CCA)、頸外動脈(ECA)和頸內動脈(ICA),結扎CCA和ECA的近心端,在ICA近心端繞細線備用。在距離CCA分叉口1~2 mm處剪一個小口,將拴線插入到ICA中,插入深度為18 mm,梗阻右腦中動脈,然后用之前繞在ICA近心端的細線扎緊系牢,最后縫合傷口。
1.1.3 腦缺血動物模型驗證、腦缺血體積及腦水腫程度測定從領取的22只大鼠中隨機選取4只梗阻中動脈,分別在手術后2、6、10和12 h處死,取出新鮮腦組織,將其置于-20°C冰箱10 min后取出,在腦槽中切成約2 mm
厚的均勻腦組織切片。腦片放入1%TTC溶液中染色,在
37°C溫箱中孵育20~30 min,缺血腦組織被染成白色,正常腦組織被染成紅色。用高清照相機拍照,并用Image-Pro Plus軟件計算缺血體積及腦水腫程度。參照文獻[17-18]的計算公式:
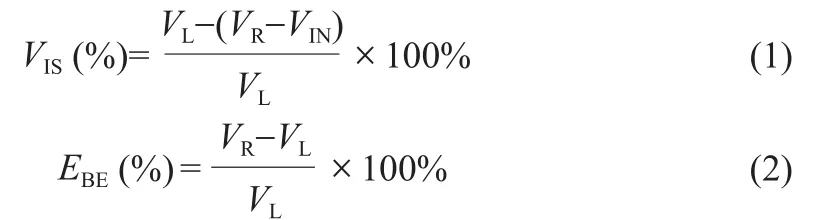
其中,VIS為腦缺血體積,VIN為腦梗死體積,VL為左半腦的體積,VR為右半腦的體積,EBE為腦水腫的程度。1.1.4 電阻抗值的測量
從領取的大鼠中隨機選取10只,其中7只梗阻右腦中動脈,并在大鼠右腦上方的顱骨打兩個直徑1 mm的小孔,不破壞硬腦膜,插入牙科釘并固定,將以Solartron1260電阻抗分析儀和1294生物電阻抗測量接口為核心的電阻抗頻譜測量平臺與牙科釘連接,采用兩電極法連續測量大鼠右腦電阻抗12 h,測量頻率為50 kHz,毎分鐘一個點,作為實驗組。其余3只大鼠麻醉后,不進行中動脈梗阻,直接在大鼠右腦上方顱骨打孔并以上述方法連續測量右腦電阻抗,作為對照組。
1.1.5 組織形態學對照
領取的大鼠中最后8只大鼠,將其中7只大鼠的右腦中動脈梗阻,分別在1、2、4、6、8、10和12 h后處死并灌注,然后取左右腦組織樣本經石蠟包埋、切片(2~4 μm)、HE染色,在200倍光學顯微鏡下觀察分析,并使用Image-Pro Plus軟件提取微觀形態學參數。剩下的1只大鼠不做任何處理,直接處死灌注,并用上述方法觀察分析。
1.2 數據分析
數據以均值±標準差(mean±SD)的形式表示,用SPSS 14.0處理數據。
2 結果
2.1 動物模型驗證結果
TTC染色結果,見圖1,圖中被染成紅色的腦組織為正常腦組織,白色腦組織為缺血腦組織。因此,本研究使用的模型制作方法成功的使大鼠的右腦形成了局部缺血。
將圖1中的各個圖片分別用Image-Pro Plus軟件處理,計算得到的缺血腦組織的體積分別為25.91%、15.54%、22.05%和53.76%。軟件計算的腦水腫的程度如下:模型建立2、4、6和12 h后的缺血腦組織的體積,腦水腫的程度分別為6.39%、6.82%、8.49%和22.30%。

圖1 大鼠腦缺血不同時段TTC染色結果
2.2 電阻抗測量結果
測得的對照組3只大鼠的腦阻抗值,見圖2,阻抗值都沒有明顯變化,阻抗值變化不超過5%。
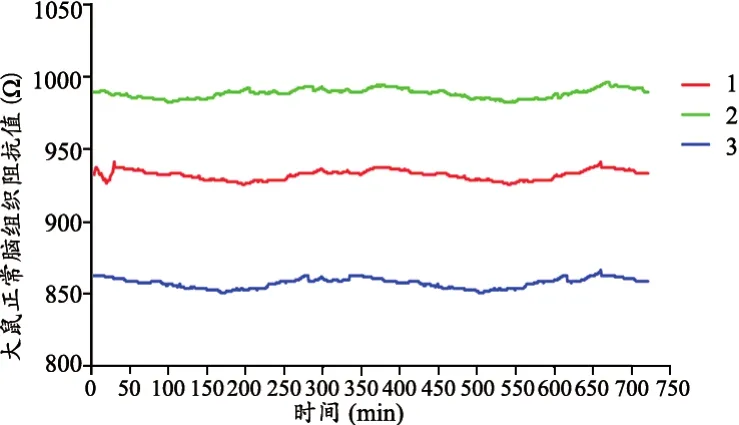
圖2 大鼠正常腦組織阻抗值隨時間的變化
在體測得的實驗組7只大鼠的腦阻抗值隨時間的變化規律,見圖3。圖3顯示了缺血腦組織的阻抗值先升高后降低,并在腦缺血6~8 h腦組織的阻抗值達到峰值,此時組織電阻抗相對于腦梗初期升高10%~15%。
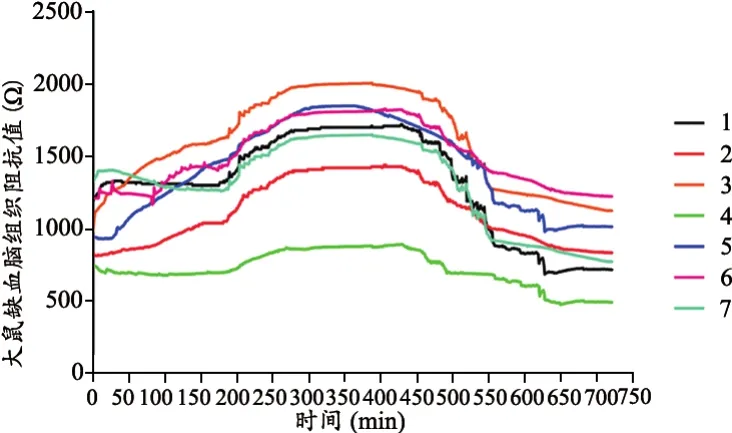
圖3 大鼠缺血腦組織阻抗值隨時間的變化
2.3 微觀形態對照結果
在200倍光學顯微鏡下觀察腦組織的形態學結構,見圖4,在中動脈梗阻2 h后,缺血缺氧造成神經細胞嗜酸性增強,同時水在細胞內的潴留導致細胞體積膨大;中動脈梗阻6 h后,血管內皮細胞與腦實質之間間隙增大,腦細胞染色質固縮,而且腦實質中水分增加;10 h后,血管的管腔閉塞,小膠質細胞逐漸增多,部分神經細胞壞死。
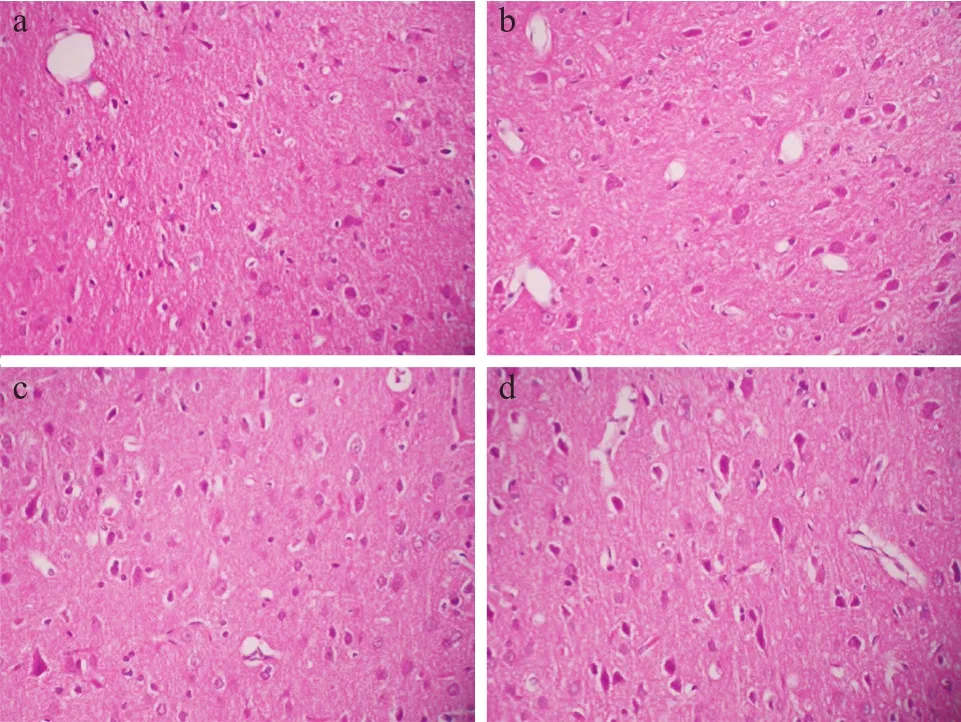
圖4 大鼠缺血腦組織不同時段腦組織形態結構結果
細胞核個數和細胞面積隨缺血時間的變化,見圖5,在缺血2 h時,大鼠腦組織細胞個數減少,同時細胞面積增大;在缺血6 h時,在單位視野內大鼠腦組織細胞相對于缺血2 h的腦組織細胞個數幾乎不變而細胞的體積增大;動物腦組織缺血10 h的細胞個數及細胞面積都有下降趨勢。
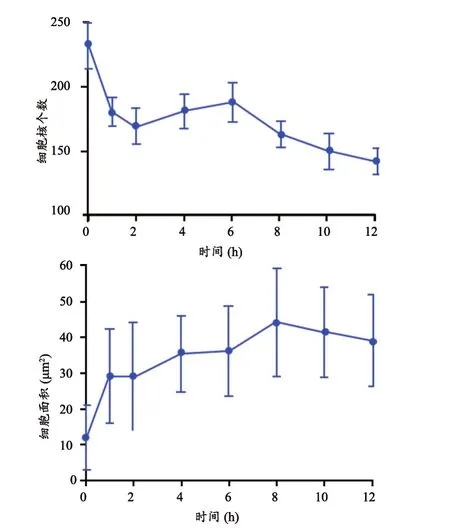
圖5 腦組織微觀形態學指標:細胞核個數、細胞面積
3 討論
在本研究中,動物模型的制作較成功,大鼠的右腦形成缺血區,并且腦水腫的程度也隨時間遞增。同時,本研究發現,大鼠腦缺血的12 h中大腦的電阻抗先升高后降低,在腦缺血6 h左右大腦的電阻抗達到峰值,比缺血初期高10%~15%。對照微觀形態學的分析結果,缺血性腦卒中占主導地位時,腦組織的電阻抗呈現上升趨勢;腦繼發性腦水腫開始占據主導地位是,腦組織的電阻抗開始下降。
本研究在腦組織缺血6 h內腦損傷組織的阻抗值升高,與Lingwood等報道的缺氧后的6 h內腦組織的阻抗值持續升高一致[13],但與達特摩斯大學的Manwaring等報道的在腦白質中注入新鮮血液后腦組織電導率升高有所出入[14],可能是損傷模型不同,導致損傷組織的電阻抗變化趨勢不同。D Holder研究小組動物模型與本研究相似[16],測得的損傷早期電阻抗值的變化趨勢也一致。
在本研究中,結果顯示缺血后的大鼠腦組織的電阻率在12 h內呈現出先升高后降低的變化趨勢,這種變化趨勢的出現可能與缺血后腦組織的微觀形態的變化有關。腦缺血初期損傷組織的電阻抗的升高,可能與腦組織中血流量的減少以及細胞體積的膨大有關,細胞的膨大導致細胞間隙的減小,使組織電阻抗升高[19];當腦損傷進一步加重時,細胞外液中的水分雖然增加,但同時細胞間隙也在擴大,細胞間隙的增大使得在相同激勵下經過組織的電流密度增大,導致組織電阻抗下降[19]。在腦損傷的發展過程中,當細胞間隙的增大占據主導地位時,腦組織的電阻抗值就會出現下降趨勢;當腦損傷發展為重度腦損傷時,神經細胞壞死或破裂,細胞膜通透性增加[20],組織的電阻抗可能會進一步下降。上述變化的示意圖,見圖6。腦缺血的前6 h,缺血性腦卒中占主導地位,腦組織的電阻抗呈現上升趨勢;腦缺血8 h后,繼發性腦水腫開始占據主導地位,導致腦組織電阻抗的下降。
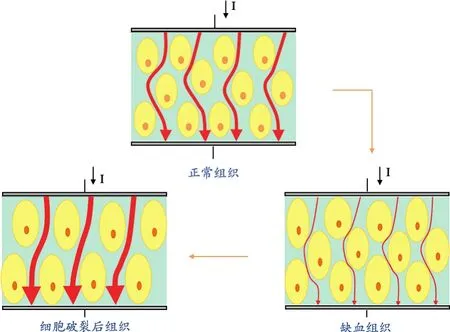
圖6 腦組織缺血后微觀形態變化引起電阻抗變化的示意圖
本研究初步探索了缺血性腦損傷在發生發展過程中,腦組織電阻抗值變化的規律。如果能在此研究的基礎上進一步延長在體測量的時間,研究腦水腫發展過程中電阻抗的變化規律,可使研究更加完善。在本研究的基礎上,可進一步探索其他類型的腦損傷(如出血性腦損傷)在發生發展過程中電阻抗值的變化規律,以及不同類型腦損傷的電阻抗變化之間的區別。這些研究結果可以作為電阻抗斷層成像的基礎,來診斷不同類型的腦損傷以及不同階段的腦損傷。
4 結論
本研究用生物電阻抗測量技術和組織微觀形態學對照的研究方法,證明了生物電阻抗測量技術可以用于區分缺血性腦卒中及其繼發性腦水腫。本研究小組計劃下一步研究出血性腦損傷的電阻抗變化規律,并通過電阻抗的變化區分缺血性腦損傷和出血性腦損傷。
[1] 晏正輝,王興元.老年人急性腦血管疾病的腦電圖特征[J].醫學研究生學報,2013,26(6):615-617.
[2] 陳昕,郭志良,葉瑞東,等.一種改進的卒中溶栓出血轉化的大鼠血栓栓塞模型[J].醫學研究生報,2015,28(11):1171-1174.
[3] 張赫娛,何志義.缺血性腦卒中的影像學診斷[J/CD].中華腦科疾病與康復雜志,2016,6(1):1-4.
[4] Kerner TE.Electrical impedance spectroscopy of the breast clinical imaging results in 26 subjects[J].IEEE Trans Med Imaging, 2002,21(6):638-644.
[5] Dai M,Wang L,Xu CH,et al.Real-time imaging of subarachnoid hemorrhage in piglets with electrical impedance tomography[J]. Physiol Meas,2010,31(9):1229-1239.
[6] Fu F,Li B,Dai M,et al.Use of electrical impedance tomography to monitor regional cerebral edema during clinical dehydration treatment[J].PLoS One,2014,9(12):e113202.
[7] Xu CH,Wang L,Shi XT,et al.Real-time Imaging and Detection of Intracranial Haemorrhage by Electrical Impedance Tomography in a Piglet Model[J].J Int Med Res,2010,38:1596-1604.
[8] Liu LX,Dong WW,Ji XM,et al.A new method of noninvasive brain-edema monitoring in stroke: cerebral electrical impedance measurement[J].Neurol Res,2006,28:31-37.
[9] Trokhanova OV,Chijova YA,Okhapkin MB,et al.Using of electrical impedance tomography for diagnostics of the cervix uteri diseases[J].J Phys:Conf Ser,2010,224(1):012068.
[10] Wan Y,Borsic A,Heaney J,et al.Transrectal electrical impedance tomography of the prostate: spatially coregistered pathological findings for prostate cancer detection[J].Med Phys, 2013,40(6):063102.
[11] You FS,Shi XT,Shuai WJ,et al.Applying electrical impedance tomography to dynamically monitor retroperitoneal bleeding in a renal trauma patient[J].Intensive Care Med,2013,39(6):1159-1160.
[12] Fujita S,Ueda T,Yagi M.Detection of experimental and clinical brain edema using an electrical impedance method[J].J Neurosurg,1972,37:156-163.
[13] Lingwood BE,Dunster KR,Colditz PB,et al.Noninvasive measurement of cerebral bioimpedance for detection of cerebral edema in the neonatal piglet[J].Brain Res,2002,945:97-105.
[14] Harting MT,Smith CT,Radhakrishnan RS,et al.Regional differences in cerebral edema after traumatic brain injury identified by impedance analysis[J].J Surg Res,2010,159(1):557-564.
[15] Manwaring PK,Moodie KL,Hartov A,et al.Intracranial Electrical Impedance Tomography[J].Anesth Analg,2013,117(4):866-875.
[16] Dowrick T,BlochetC,Holder D.In vivo bioimpedance measurement of healthy and ischaemic rat brain: implications for stroke imaging using electrical impedance tomography[J]. Physiol Meas,2015,36(6):1273-1282.
[17] O’Donnell ME,Tran L,Lam TI,et al.Bumetanide inhibition of the blood-brain barrier Na-K-Cl cotransporter reduces edema formation in the rat middle cerebral artery occlusion model of stroke[J].J Cereb Blood Flow Metab,2004,24(9):1046-1056.
[18] Strbian D,Karjalainen-Lindsberg ML,Tatlisumak T,et al. Cerebral mast cells regulate early ischemic brain swelling and neutrophil accumulation[J].J Cereb Blood Flow Metab,2006, 26(5):605-612.
[19] Gersing E.Impedance spectroscopy on living tissue for de termination of the state of organs[J].Bioelectrochem Bioenerg,1998, 45:145-149.
[20] Unterberg AW,Stover J,Kress B,et al.Edema and brain trauma[J]. Neuroscience,2004,129(4):1021-1029.
本文編輯 張丹妮
Electrical Impedance Variation Measurement of Rat Ischemic Brain Injuries and Tissue Morphology Control Study
SONG Jia-li1, YANG Lin1, KANG Jun-jun2, LI Hao-ting1, DONG Xiu-zhen1, FU Feng1
1. Faculty of Biomedical Engineering, Fourth Military Medial University, Xi’an Shaanxi 710032, China; 2. School of Basic Medical Sciences, Fourth Military Medial University, Xi’an Shaanxi 710032, China
ObjectiveTo study the impedance variation of ischemic stroke and its’ secondary brain edema to distinguish the two types of brain injuries. Methods Two-electrode method was used to measure impedance of rats’ brain in vivo continuously. Then we analyzed the impedance variation over time, and the microscopic morphology parameters were analyzed by Image-Pro Plus as comparison and verification of the impedance variation.ResultsElectrical impedance of rat ischemic brain has risen 10%~20% after 6~8 h of brain ischemia, where the peak of the electrical impedance shows out. Then the impedance reduced over time. And there was a good correlation between the impedance variation and the microscopic morphology parameters.ConclusionBioelectrical impedance measurement technique can be used to distinguish ischemic stroke and secondary brain edema, as indicated by the impedance variation of rat ischemic brain over time.
cardiac-cerebral vascular disease; ischemic stroke; brain edema; bioelectrical impedance measurement; microscopic morphology analysis
TM934.7;R743
A
10.3969/j.issn.1674-1633.2017.01.005
1674-1633(2017)01-0018-04
2016-10-09
2016-11-09
國家自然科學基金(51477176);軍隊重大項目(AW S14C006)。
付峰,教授,主要研究方向為顱腦損傷的電阻抗成像研究。
通訊作者郵箱:fengfu@fmmu.edu.cn

