水稻土Fe(II)氧化耦合NO3-還原的微生物變化
陳鵬程,李曉敏,李芳柏*(1.中國科學院廣州地球化學研究所,廣東 廣州 510640;.廣東省生態環境與土壤研究所,廣東 廣州 510650;3.中國科學院大學,北京 100049)
水稻土Fe(II)氧化耦合NO3-還原的微生物變化
陳鵬程1,2,3,李曉敏2,李芳柏2*(1.中國科學院廣州地球化學研究所,廣東 廣州 510640;2.廣東省生態環境與土壤研究所,廣東 廣州 510650;3.中國科學院大學,北京 100049)
利用不同馴化條件(Soil、Soil+Fe(II)、Soil+NO3-和Soil+Fe(II)+NO3-)對華南水稻土進行中性厭氧條件下的富集培養, 探究淹水期水稻土亞鐵(Fe(II))氧化和硝酸鹽(NO3-)還原過程,及此過程中微生物群落的變化.結果表明,在 Soil+Fe(II)處理中,亞鐵不能發生自然氧化.只有在Soil+Fe(II)+NO3-處理中,Fe(II)才能被氧化成Fe(III);同時,Fe(II)的存在減慢了NO3-的還原.利用高通量測序技術表征微生物群落組成隨培養時間的變化,結果表明, Soil+Fe(II)和Soil處理的微生物群落組成沒有顯著差異.在Soil+NO3-處理中,Pseudogulbenkiania、Flavobacterium和Rhodocyclus屬成為優勢菌群.在Soil+Fe(II)+NO3-處理中,Zoogloea、Geothrix、Sunxiuqinia和Vulcanibacillus等屬成為優勢菌群,主要包括硝酸鹽還原菌、Fe(II)氧化菌和Fe(III)還原菌.
亞鐵氧化;硝酸鹽還原;微生物群落;水稻土;中性pH
-and Soil+Fe(II)+NO3-) at circumneutral pH under anoxic conditions. The objectives were to investigate the transformations of Fe(II) and nitrate as well as the shifts of composition and diversity of microbial communities during these processes. The results revealed that Fe(II) could not be oxidized in the treatment of Soil+Fe(II), but only be oxidized in the treatment of Soil+Fe(II)+NO3-. Meanwhile, the presence of Fe(II) slowed down the NO3
-reduction. Illumina high throughput sequencing was used to profile the diversity and abundance of microbial communities over time. The results showed that no significant difference of microbial communities between treatments of Soil+Fe(II) and Soil. Pseudogulbenkiania, Flavobacterium and Rhodocyclus gradually became the dominant genera in the treatment of Soil+NO3
-. Zoogloea, Geothrix, Sunxiuqinia and Vulcanibacillus were the most abundant genera in the treatment of Soil+Fe(II)+NO3-, which was a mixture of nitrate reducers, Fe(II) oxidizers and Fe(III) reducers. Key words:Fe(II) oxidation;nitrate reduction;microbial community;paddy soil;circumneutral pH
鐵元素是地殼中含量第 4高的變價金屬元素[1].鐵的生物地球化學循環過程耦合其他元素的氧化還原過程,對碳、氮和重金屬等元素的轉化有重要的影響[2-4].鐵在天然環境中多數以不溶態 Fe(III)氧化物的形式存在.微生物驅動的Fe(II)氧化和 Fe(III)還原可以發生在厭氧環境中[5].厭氧環境中鐵氧化還原過程主要是由鐵相關微生物群落所驅動的,包括Fe(II)氧化菌和Fe(III)還原菌[6].其中,硝酸鹽依賴型亞鐵氧化微生物可以利用厭氧環境中的硝酸鹽作為電子受體,在有機物質存在的情況下氧化 Fe(II),從而影響著環境中Fe元素和N元素的循環[7].
目前,大部分關于 Fe(II)氧化耦合硝酸鹽還原過程及其微生物的研究,主要關注從環境中分離純化出來的純菌,并探究其亞鐵成礦機制[8].混合培養主要集中在淡水底泥環境中[9],這個過程是由多種不同微生物共同完成的.然而,關于稻田環境中的 Fe(II)氧化耦合硝酸鹽還原過程,以及其中的微生物群落組成的研究還很少[10-11].
水稻土是一個由干濕交替引起的好氧-厭氧反復交替的生態系統,水稻土含鐵量高達100~200 μmol/cm3[12],因此在淹水期時 Fe(III)還原和 Fe(II)氧化過程均能發生[13].此外,水稻土系統受人為活動干擾大,碳和氮的輸入與積累量高,因此厭氧條件下Fe(II)氧化耦合硝酸鹽還原過程也是有可能發生的.最近,關于水稻土在厭氧條件下發生的Fe(II)氧化和硝酸鹽還原過程及其微生物群落組成變化初有報道,并發現 Azospira、Zoogloea和 Dechloromonas 等屬是此過程中的優勢微生物[14].深入了解由水稻土微生物引起的Fe(II)氧化耦合硝酸鹽還原過程,有利于揭示此過程中的微生物機制,并可為調控水稻土環境中鐵-氮循環提供科學依據.本研究采用花崗巖發育的華南水稻土作為研究對象,分別添加Fe(II)、NO3
-以及Fe(II)+NO3-對其富集培養.研究水稻土在中性 pH厭氧條件下 Fe(II)氧化耦合NO3
-還原的動力學變化過程,探討不同富集處理中微生物群落組成的動態變化.
1 材料與方法
1.1 采樣點和樣品處理
實驗用的水稻土于2014年采集自廣州市中國 科 學 院 華 南 植 物 園 (23°10'38.26"N, 113°21'10.12"E).水稻土樣品采集自表層以下10cm深度,放置于冰盒0℃保存帶回實驗室進行富集培養,水稻土pH值為5.8,總鐵含量為23g/kg,有機碳量為35g/kg,水解N為287mg/kg.
本次的孵育水稻土所采用的培養基配方如下:緩沖液采用 1,4-piperazinediethanesulfonic acid (PIPES)-buffer(30mmol/L, pH 7.0),含有10mmol/L硝酸鹽作為電子受體,5mmol/L乙酸鹽作為電子供體,中性鹽(0.68mmol/L CaCl2, 1.03mmol/L KH2PO4, 2.03mmol/L MgCl2和5.14mmol/L NaCl),微量元素(1mL/L,)維生素溶液(1mL/L)和硒-鎢溶液(1mL/L).孵育體系分裝于125mL西林瓶,參照之前的報道[10]100mL緩沖液體系加入 1g水稻土.培育試驗開始前,所有西林瓶都采用高壓蒸汽滅菌(121℃, 20min).為了最大限度的防止氧氣對FeCl2氧化,FeCl2溶液的配置方式如下:10mL的去離子水用氮氣(99.99%)鼓吹25min,加入 9.9g FeCl2配成 1mol/L濃度的母液.500μL 1mol/L FeCl2溶液轉移至每個 125mL西林瓶(西林瓶培養基預先鼓吹氮氣15min除氧),繼續鼓吹氮氣 10min后,壓橡膠蓋和鋁蓋封緊,Fe2+離子的終濃度為 5mmol/L.樣品模擬采樣實際溫度置于厭氧培養箱中(30±0.5)℃避光靜置培養,每個實驗處理設置3個重復.每隔2d取樣,西林瓶搖勻后吸取2mL懸濁液用于Fe濃度測定,再取約5mL上清液用于硝酸鹽、亞硝酸鹽、銨的含量測定、余下的樣品經 10000r/min離心后收集沉淀用于DNA提取.實驗設計分為4個處理組:(1) Soil; (2) Soil+NO3-; (3) Soil+Fe(II); (4) Soil+Fe(II)+NO3-. Soil+Fe(II)+NO3
-體系第2d開始有氣泡從沉積在瓶底的水稻土中逐漸滲出,水稻土的顏色也由黑色逐漸轉化為棕黃色,表明經過2d的Fe-N富集,反應體系中的Fe2+發生氧化,并釋放出氣體產物,這也表明了反應體系中的優勢微生物經過調整之后開始發揮作用.
1.2 檢測方法
硝酸鹽和亞硝酸鹽用離子色譜進行定量檢測(ICS-90, Dionex, US),陰離子交換柱的型號是IonPac AS14A 4×250mmol/L.為了防止Fe2+離子進入陰離子柱與淋洗液(濃度8:1的碳酸鈉/碳酸氫鈉)發生反應生成 Fe(III)沉淀而堵塞了陰離子柱,樣品在打入機器前必須經過以下處理.樣品取出后經過離心(10000r/min),上清液經過鈉離子交換柱,去除所有殘留的 Fe2+或者 Fe3+,再用0.22μm濾膜過濾.
N2O 用氣相色譜儀進行檢測(GC-7900, Techcomp, China).用1mL注射器吸取西林瓶頂空氣體1mL直接注射進氣相色譜儀的進樣口進行檢測[15].銨的檢測,采用納氏試劑比色法,檢測的波段在420nm[16].HCl浸提態Fe(III)和溶解態Fe(II)的檢測,使用 1,10-鄰菲洛林比色法在510nm波段進行比色檢測[17].1.3 DNA的提取和PCR擴增
對于水稻土各個處理的總DNA提取采用土壤試劑盒(PowerSoilTM, MO BIO)按照說明書的使用步驟操作,提取出來的DNA儲存在-45℃冰箱.細菌和古細菌的16S rRNA V4區的特異性擴增使用515F正向引物,806R反向引物(帶有一個12bp的標簽).每個DNA樣品都是用50μL體系進行擴增,設置 3個平行樣.擴增條件如下:95 ℃5min,變性(94℃ 0.5min),退火(50 ℃ 1min),延伸(72 ℃ 1min),最終的延伸溫度72 ℃ 7min.最終得到一個約470bp長度的片段,并用一個QIA快速膠回收試劑盒(Qiagen, Chatsworth, CA, US)進行純化.所有的PCR產物都按照均一的分子比例混合成為一管樣品.樣品采用 IIluminaMiseq PE(paired end)250bp進行測序.每個樣品均做 3個重復.
1.4 高通量測序分析方法
由于IIlumina測序技術在序列末端(3’端)呈現明顯的質量下降,為了保持數據的準確性,必須對數據進行評價并進行質量篩選.對測序序列(成對.fastq)使用 fastqc軟件評價數量和質量,并利用perl腳本進行質量控制,去除低質量的堿基.用 Mothur將兩端拼成一個完整片段后,利用Mothur和 Quantitative Insights Into Microbial Ecology(QIIME)進行流程化分析.利用 Uclust在16S的 97%序列相似度水平上分類 Operational taxonomic units (OTUs).在每個OTUs所屬的序列里,抽取出一條作為代表序列.將代表序列和已知的比對好的原核生物16S rRNA基因進行匹配,并用 FastTree做以 OTU為單位的系統發育樹.使用Ribosomal Database Project(RDP)數據庫在80%的可信度水平上進行分類,并進行物種注釋,了解物種來源.建立 OTU表格后,根據序列信息和物種分類信息,將樣品中的序列劃分到不同的分類等級,即門(phylum),綱(class),目(order),科(family),屬(genus).相對豐度用 R語言的 Scale Function功能進行標準化.即一個樣品在某個分類水平上的標準化值為該樣品在某個分類上的相對豐度和所有樣品在該分類的相對豐度平均值的差除以所有樣品在該分類上的標準差所得到的值,本文的結果在標準化以后的值在-1~3之間.序列被隨機挑取用來計算 alpha 多樣性和beta多樣性.
2 結果和討論
2.1 Fe元素的轉化
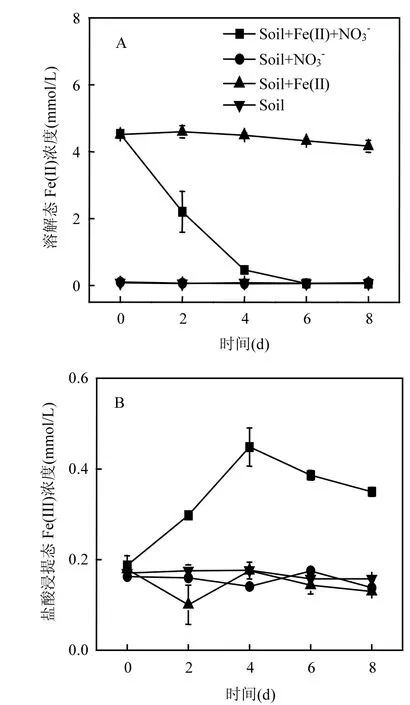
圖1 (A)溶解態Fe(II)和(B)鹽酸浸提態Fe(III)濃度變化Fig.1 Transformations of (A) dissolved Fe(II), (B) HCl-extractable Fe(III)
如圖 1所示,土壤自身含有<0.2mmol/L的Fe(III)背景值(即Soil處理),且溶解態Fe(II)和鹽酸浸提態Fe(III)濃度隨培養時間的推移沒有發生明顯的變化.Soil+NO3-處理中溶解態Fe(II)和鹽酸浸提態 Fe(III)與 Soil處理相比沒有明顯差異.在Soil+Fe(II)處理中,溶解態 Fe(II)濃度沒有發生明顯變化,這說明土壤中原有的成分在厭氧條件下不能引發 Fe(II)氧化.在 Soil+Fe(II)+NO3-體系里,培養前2d就有60%的溶解態Fe(II)被氧化,在第4d時有 90%的 Fe(II)被氧化;同時,檢測到0.5mmol/L的鹽酸浸提態Fe(III),說明大部分生成的Fe(III)轉化成礦物,而沒辦法被0.5M鹽酸溶解.
2.2 N元素的轉化
如圖 2所示,在 Soil和 Soil+Fe(II)處理中, NO3-、NO2-和N2O的含量均低于儀器檢測限,但可以檢測到約0.08mmol/L的NH4+背景值.NH4+濃度在Soil和Soil+Fe(II)處理中隨時間逐漸降低,表明NH4+可能被土壤中的微生物吸收利用.
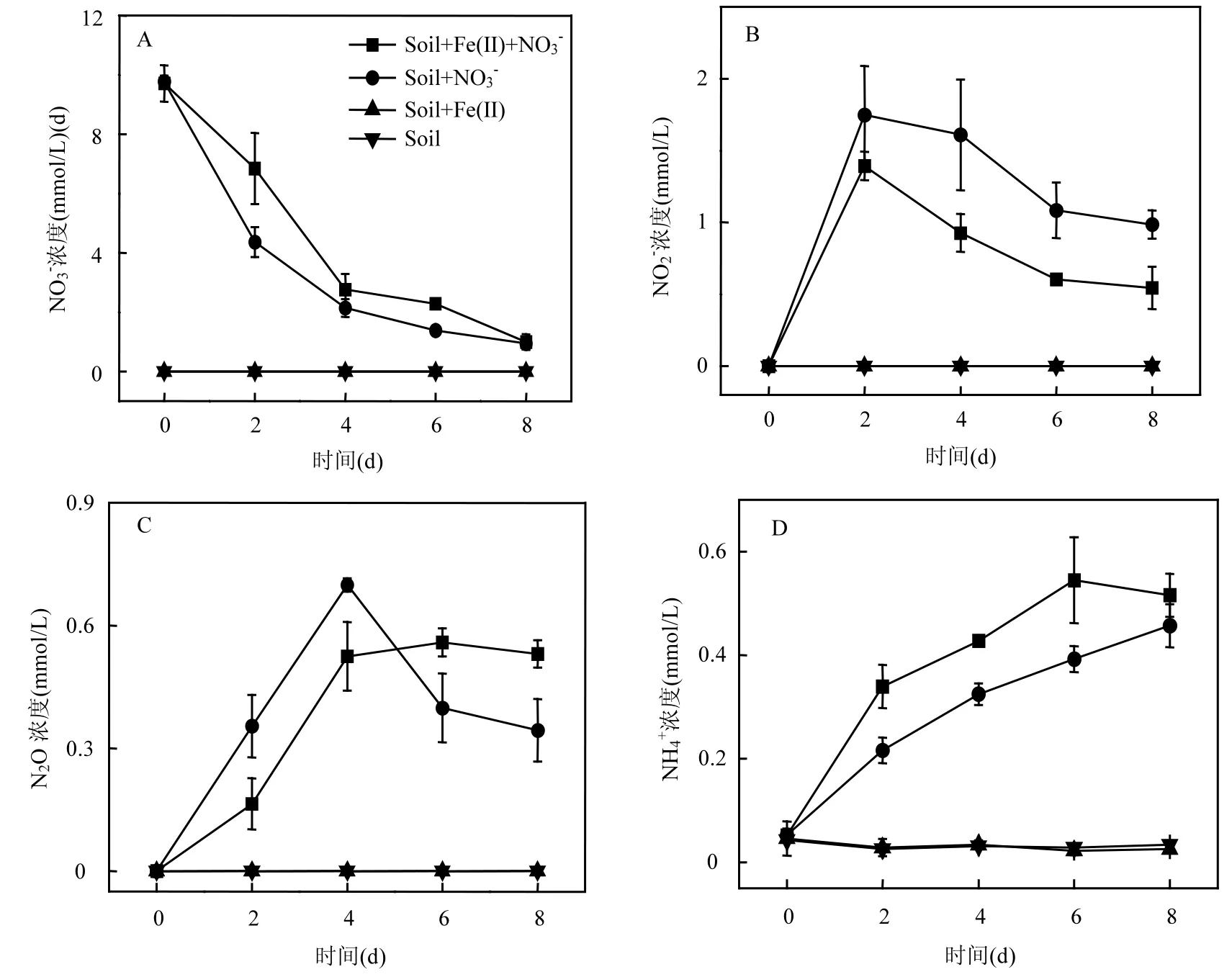
圖2 (A) NO3-, (B)NO2-, (C)N2O和(D)NH4+的濃度變化Fig.2 Transformations of (A)NO3-, (B)NO2-, (C) N2O and (D)NH4+
在 Soil+Fe(II)+NO3-和 Soil+NO3-體 系里,NO3-的濃度均隨時間推移而逐步減少,Fe(II)的存在減慢了硝酸鹽的還原.這可能和 Fe(II)生成 Fe(III)后,和 NO-產生競爭效應有關[18].NO-33在厭氧條件下的還原主要是硝酸鹽還原菌的作用[10],其對 NO3-的還原代謝可以分為 2條途徑:反硝化途徑(NO3-→NO2-→NO→N2O→N2)和異化硝酸鹽還原途徑(NO3-→NO2-→NH4+)[12],其中NO2-均是這2個途徑的第一個中間產物.培養第2d時,在Soil+Fe(II)+NO3-和Soil+NO3-體系里,分別檢測到約1.4mmol/L和1.7mmol/L的NO2-,隨后這2個處理的NO2-濃度均逐漸減少.在Soil+ Fe(II)+NO3-體系里,在微生物的作用下,Fe(II)除了可以跟NO3-發生反應(如方程(1)所示)以外,還可以和NO2-發生化學反應,如方程(2)所示.
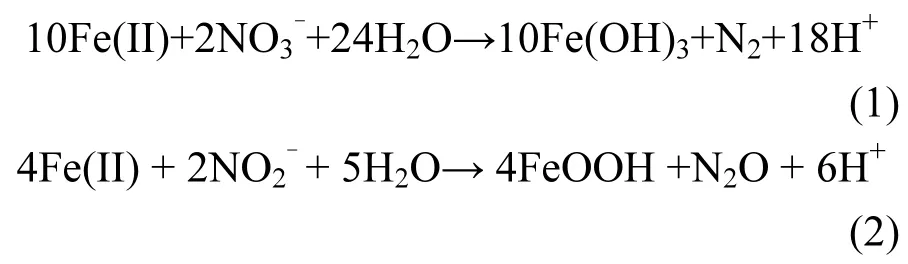
在培養的前4d里,Soil+Fe(II)+NO3-和Soil+NO3-的 N2O生成量的上升趨勢幾乎一致.第 4d之后,在 Soil+NO3-體系中,N2O濃度在達到峰值后隨時間逐漸減少,N2O是微生物反硝化過程的中間產物,其濃度的減少有可能是反硝化過程的進一步進行導致的.而在Soil+Fe(II)+NO3-體系里,培養第4d后N2O濃度則保持一個平穩的狀態,根據反應式(1),這有可能是Fe(II)與NO2-的化學反應生成N2O所導致的.
在 Soil+NO3-和 Soil+Fe(II)+NO3-體系里, NH4+濃度隨培養時間的推移逐步提高,表明異化硝酸鹽還原成銨(DNRA)過程的發生.在Soil+NO3-體系里,與 N2O的生成量相比,NH4+的生成量較低,推測反硝化途徑在硝酸鹽還原過程中的貢獻要大于異化硝酸鹽還原途徑,這和之前的實驗結果相類似[9].根據已測得的 NO-、3NO2-、N2O和NH4+結果進行簡單的氮平衡加減計算,可推算出 Soil+NO-和 Soil+Fe(II)+NO-體33系分別最多可生成6.51mmol/L和5.72mmol/L的NX(包括:NO和N2),再加上已測到的N2O生成量,可推測 Fe(II)的存在減慢了反硝化途徑.此外,NH4+是自然環境中較易被生物吸收利用的氮素,DNRA過程是土壤氮儲存的過程[19].在 Soil+ Fe(II)+NO-體系里,NH+的生成量比 Soil+NO-343體系里的要高,表明 Fe(II)的存在促進了 DNRA過程的發生,也增加了氮的儲存.
2.3 微生物群落在門水平上的動態變化
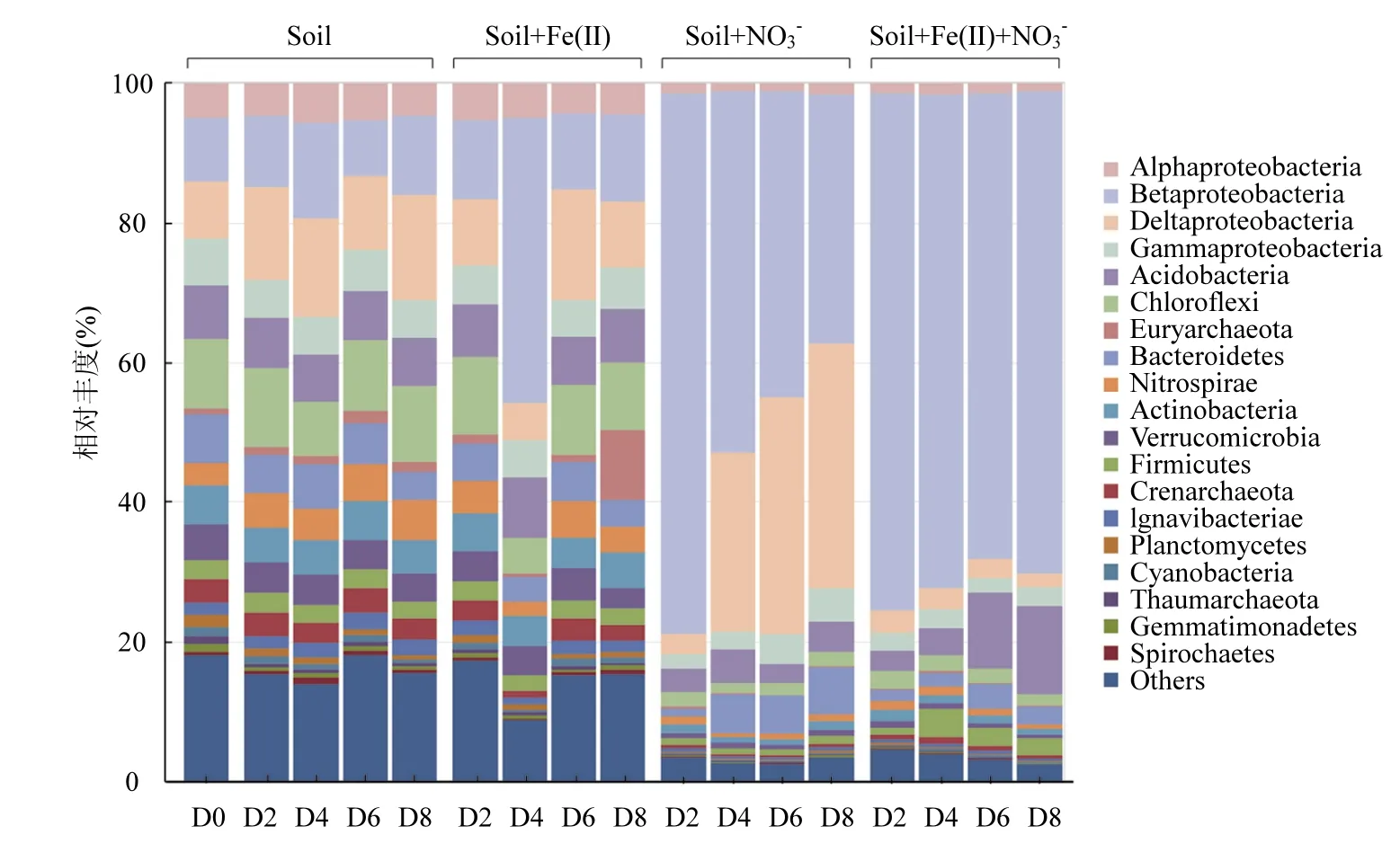
圖3 基于16S rDNA高通量測序的不同處理微生物群落在門水平上相對豐度隨反應時間的變化情況(>1%)(D表示天數)Fig.3 Relative abundance (%) of the dominant microbial phyla (>1%) with time dependence in different treatments revealed by 16S rDNA Illumina high-throughput sequencing (D means day)
如圖3所示,原始土壤中(D0),Chloroflexi的相對豐度最高(10%),其相對豐度在Soil處理中隨時間推移波動很小(7.5%~11%),此外 Deltaproteobacteria (11%~15%)和 Betaproteobacteria(7.9%~14%)的相對豐度也較高.在 Soil+Fe(II)體系中,門水平的變化趨勢(除了 D2以外)和 Soil處理區別不大, Deltaproteobacteria(9.4%~16%)、Betaproteobacteria (11%~12%)和 Chloroflexi (5.1%~11%)等幾個優勢門類同樣處于一個比較穩定的水平.這說明,在不添加 NO3-作為電子受體的條件下,添加 Fe(II)并不能改變水稻土微生物門水平上的群落組成.
在 Soil+NO3-和 Soil+Fe(II)+NO3-體系中, Betaproteobacteria的相對豐度在培養第2d就上升到74%以上,成為絕對的優勢群落,且其變化趨勢在2個處理中也幾乎一致(圖3).除此之外,在Soil+NO3-和 Soil+Fe(II)+NO3-體系中的優勢菌群分別是Deltaproteobacteria(26%~35%)和 Acidobacteria (2.7%~13%).這說明 NO3-的添加會促進Betaproteobacteria和Deltaproteobacteria這2個門的微生物的生長,而 Fe(II)的加入還能刺激Acidobacteria這個門的微生物的生長.
2.4 微生物群落在屬水平上的動態變化
在 Soil體系,相對豐度較高的屬有: Belliinea、Thermodefovibrio、Geobacter和Pseudobenkiania等屬,其含量隨培養時間推移保持相對穩定,含量分別在4.1%~6.6%、4.0%~ 5.2%、2.7%~6.3%,0.9%~1.4%之間波動(圖 4).由此可見,自然土壤在沒有人為添加 Fe(II)或 NO3-的厭氧體系里,其微生物群落的組成結構沒有發生明顯的變化.其中,Geobacter[20]和Pseudogulbenkiania等屬[21]分別屬于Fe(III)還原菌和硝酸鹽依賴型Fe(II)氧化菌,由此可見,在碳酸鹽發育的富含鐵的華南水稻土中,鐵相關細菌的相對豐度處于一個較高的水平.在 Soil+Fe(II)體系,優勢微生物群落同樣以Geobacter (1.1%~7.6%)、 Bellilinea(2.9%~6.7%)、 Thermodesulfovibrio(1.9%~4.8%)和Pseudogulbenkiania(1.1%~2.2%)等屬為主(圖 4).這說明,水稻土在淹水期時,如果沒有有效的電子受體(如:NO3-)存在,即使存在高濃度 Fe(II),微生物群落也不會發生明顯的變化.
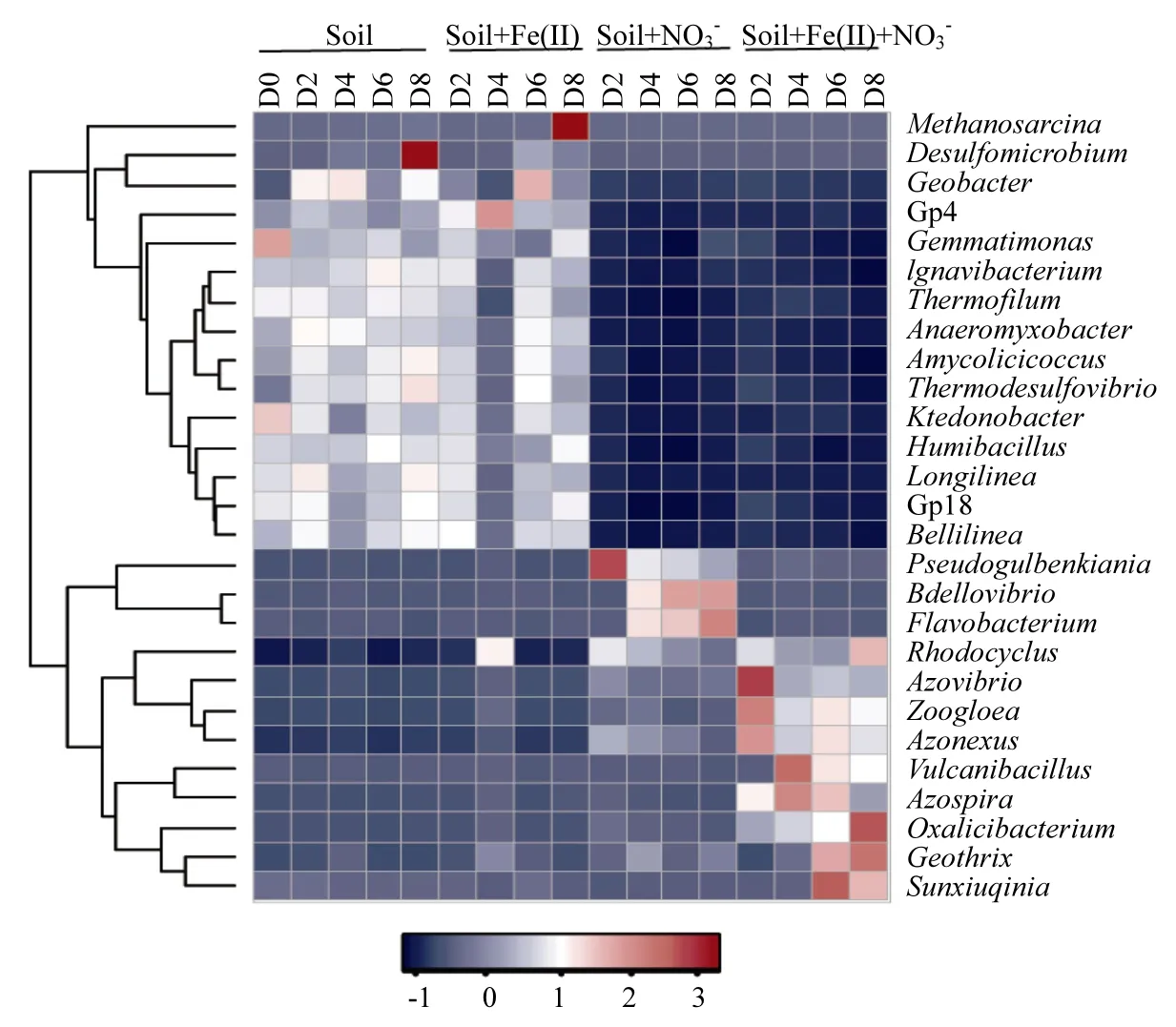
圖4 基于16S rDNA高通量測序的不同處理的微生物群落在屬水平上相對豐度隨反應時間的變化情況 (D表示天數)Fig.4 Relative abundance (%) of the dominant microbial genera (>1%) with time dependence in different treatments revealed by 16S rDNA Illumina high-throughput sequencing (D means day)
在 Soil+NO3-體 系,培 養 第 2d 時Pseudogulbenkiania和Rhodocyclus 等屬成為優勢菌群,其相對豐度分別提高到34.5%和17.2%.隨后,Bdellovibrio和Flavobacterium 等屬的相對豐度隨時間推移逐漸增加,到培養第8d時,其相對豐度分別為32.8%和3.9%.其中, Pseudogulbenkiania、 Rhodocyclus和Flavobacterium等屬均具有硝酸鹽還原功能[22],這與體系中存在較高濃度NO3-有關.盡管 Soil+NO3-處理中相對豐度較高的細菌和Soil+Fe(II)+NO3-的處理有一定的重合性,但優勢菌群還是存在明顯的區別,表明 Fe(II)的存在對優勢菌群仍然起到一定的篩選作用.
在Soil+Fe(II)+NO3-體系,第2d時Azovibro、Azonexus和Zoogloea 等屬的相對豐度分別增加到4%、4%和20.7%,其中Azovibro和Azonexus屬于固氮菌屬[23],而 Zoogloea等屬于亞鐵氧化菌
[10].在第4d時,這3種細菌的相對豐度有所下降,但 Azospira(1.4%)和 Vulcanibacillu(2.6%)等屬的相對豐度逐漸上升,前者是硝酸鹽依賴型亞鐵氧化菌[10].后者屬于硝酸鹽還原菌[24].硝酸鹽還原菌還原硝酸鹽所生成的亞硝酸根,可以跟 Fe(II)發生非生物的化學氧化反應(反應式1)[25-26].所以,在 Soil+Fe(II)+NO3-體系中所檢測到的硝酸鹽還原菌對亞鐵的氧化也存在潛在的貢獻.在第6d時,盡管2株硝酸鹽依賴型亞鐵氧化菌Zoogloea和Azospira等屬仍處于較高相對豐度(分別為 14.0%和 1.2%),但 Fe(III)還原菌Geothrix[27]、硝酸鹽還原菌 Rhodocyclus[28]和Sunxiuqinia[29]等屬已成為優勢菌群,其相對豐度分別達到9.1%,11.1%和1.9%.到第8d時,優勢菌群分別是 Rhodocyclus(24.1%)、Zoogloea (12.2%)和 Geothrix(11.2%)等屬.由于培養第 4d時,約 90%的 Fe(II)已經被氧化(圖 1),因此推測Fe(III)的積累有可能激活了鐵還原菌,發生Fe(III)的還原溶解,導致培養第6、8d時Fe(III)濃度有所下降.在本研究的 4個處理中,均沒有檢測到相對豐度超過 1%的厭氧氨氧化菌(如:Candidatus Scalindua和Candidatus kuenina stuttgartiensis等屬),所以可以排除厭氧氨氧化作用的存在.
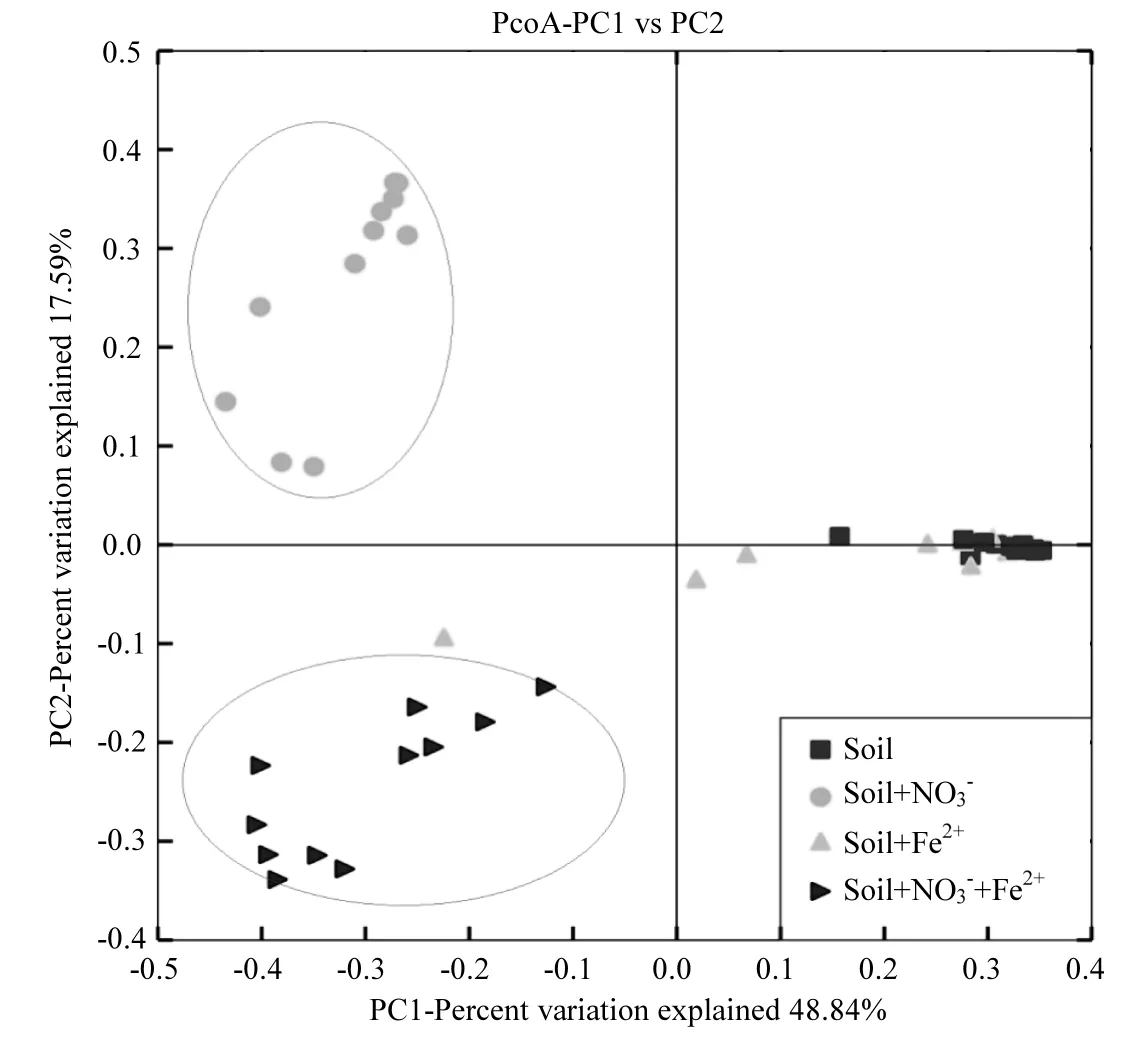
圖5 根據不同處理16S rRNA高通量測序所獲得的微生物群落的Beta多樣性Fig.5 Beta diversities of microbial communities from different treatments based on 16S rRNA Illumina high-throughput sequencing
2.5 Beta多樣性分析
如圖5所示,Soil+Fe(II)和Soil處理相比,微生物群落結構的差異不明顯,表明單純添加Fe(II)不能有效改變土壤的微生物群落結構.Soil+ Fe(II)+NO3
-、Soil+NO3-和Soil+Fe(II) 3種不同處理所富集的微生物群落組成在物種水平上呈現出明顯的差異,尤其是 Soil+Fe(II)+NO3-和 Soil+ NO3-2個處理之間的差異,說明 Fe(II)的加入能有效改變硝酸鹽還原菌的群落結構組成.在人為添加NO3-的 2個體系中(即 Soil+NO3-和 Soil+ Fe(II)+NO3-),優勢微生物均為硝酸鹽還原菌.盡管硝酸鹽還原菌是廣泛存在于自然界中,并且其可以通過反應式(1~2)間接地耦合 Fe(II)氧化過程,使人無法確認微生物直接介導的亞鐵氧化過程的貢獻[30].然而 Fe(II)的加入還是能夠顯著改變硝酸鹽還原菌的種類和豐度,表明這些具有Fe(II)氧化功能(不管是直接或者間接介導)的硝酸鹽還原菌是有區別于其他的硝酸鹽還原菌的.以上結果,加深了人們對厭氧中性水稻土中驅動硝酸鹽還原與亞鐵氧化耦合過程的優勢微生物的了解,有助于理解整個水稻生態系統中鐵循環和氮循環之間的關系.
3 結論
3.1 在中性厭氧水稻土中,Fe(II)在 Soil+Fe(II)體系中不能發生氧化,只有在Soil+Fe(II)+NO3-體系中 Fe(II)才能發生氧化;在 Soil+NO3-體系中, NO3-可以在 4d內被還原 72%,在 Soil+Fe(II)+ NO3-處理中 Fe(II)的存在減緩了 NO3-的還原.NO3-的還原主要經過反硝化途徑完成,少部分經過異化硝酸鹽還原途徑生成NH4+. 3.2 Soil+NO3-和 Soil+Fe(II)+NO3-體系的優勢微生物,在門水平上差異不明顯,但在屬水平上差異顯著.
3.3 Soil+ NO3-體系中的優勢菌群以Pseudogulbenkiania、Flavobacterium和Rhodocyclus等屬為主.
3.4 Soil+ Fe(II)+NO3-體系中優勢微生物群落由第0~2d的Azovibro、Azonexus和Zoogloea等屬逐漸變成第 6~8d的 Zoogloea、Geothrix、Sunxiuqinia和Vulcanibacillus等屬.
[1] Hauck S, Benz M, Brune A, et al. Ferrous iron oxidation by denitrifying bacteria in profundal sediments of a deep lake (Lake Constance) [J]. FEMS Microbiology Ecology, 2001,37(2):127–134.
[2] Kendall B, Anbar A D, Kappler A, et al. The global iron cycle [J]. Fundamentals of Geobiology, 2012:65–92.
[3] Lovley D R, Holmes D E, Nevin K. P. Dissimilatory Fe(III) and Mn (IV) reduction [J]. Advances in microbial physiology, 2004,49:219–286.
[4] 李芳柏,王旭剛,周順桂,等.紅壤膠體鐵氧化物界面有機氯的非生物轉化研究進展 [J]. 生態環境, 2006,15(6):1343–1351.
[5] Ding L J, Su J Q, Xu H J, et al. Long-term nitrogen fertilization of paddy soil shifts iron-reducing microbial community revealed by RNA-(13)C-acetate probing coupled with pyrosequencing [J]. Isme Journal, 2014,9(3):721–734.
[6] Posth N R, Canfield D E, Kappler A. Biogenic Fe(III) minerals: From formation to diagenesis and preservation in the rock record [J]. Earth-Science Reviews, 2014,135(4):103–121.
[7] Kappler A, Straub K L. Geomicrobiological cycling of iron [J]. Reviews in Mineralogy and Geochemistry, 2005,59(1):85–108.
[8] Miot J, Benzerara K, Morin G, et al. Iron biomineralization by anaerobic neutrophilic iron-oxidizing bacteria [J]. Geochimica et Cosmochimica Acta, 2009,73(3):696–711.
[9] Coby A J, Picardal F, Shelobolina E, et al. Repeated anaerobic microbial redox cycling of iron [J]. Applied and Environmental Microbiology, 2011,77(17):6036–6042.
[10] Straub K L, Sch?nhuber W A, Buchholz-Cleven B E, et al. Diversity of ferrous iron-oxidizing, nitrate-reducing bacteria and their involvement in oxygen-independent iron cycling [J]. Geomicrobiology Journal, 2004,21(6):371–378.
[11] Weber K A, Achenbach L A, Coates J D. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction [J]. Nature Reviews Microbiology, 2006,4(10):752–764.
[12] Ratering S, Schnell S. Nitrate-dependent iron(II) oxidation in paddy soil [J]. Environmental Microbiology, 2001,3(2):100–109.
[13] 易維潔,曲 東,黃婉玉,等.淹水培養時間對水稻土中 Fe( )Ⅲ異化還原能力的影響 [J]. 農業環境科學學報, 2010,29(9):1723–1729.
[14] Li X, Zhang W, Liu T, et al. Changes in the composition and diversity of microbial communities during anaerobic nitrate reduction and Fe(II) oxidation at circumneutral pH in paddy soil [J]. Soil Biology and Biochemistry, 2016,94:70–79.
[15] Rhoderick G C, Dorko W D. Standards development of global warming gas species: Methane, nitrous oxide, trichlorofluoromethane, and dichlorodifluoromethane [J]. Environmental Science & Technology, 2004,38(9):2685–2692.
[16] Paul T, Miller P L, Strathmann T J. Visible-light-mediated TiO2photocatalysis of fluoroquinolone antibacterial agents [J]. Environmental Science & Technology, 2007,41(13):4720–4727.
[17] Fadrus H, Maly J. Rapid extraction-photometric determination of traces of iron (II) and iron (III) in water with 1,10-phenanthroline [J]. Analytica Chimica Acta, 1975,77:315–316.
[18] 張 偉,劉同旭,李芳柏,等.鐵還原菌介導的氧化鐵還原與硝酸鹽還原的競爭效應研究 [J]. 生態環境學報, 2013,1:123–128.
[19] Wolfe J P, Wagaw S, Marcoux J F, et al. Nitrogen fixation and dissimilatory nitrate reduction to ammonium (DNRA) support nitrogen dynamics in Texas estuaries. Limnol Oceanogr [J].Limnology & Oceanography, 2006,51(1):558–568.
[20] Mahadevan R, Bond D R, Butler J E, et al. Characterization of metabolism in the Fe(III)-reducing organism Geobacter sulfurreducens by constraint-based modeling [J]. Applied and Environmental Microbiology, 2006,72(2):1558–1568.
[21] Zhao L, Dong H, Kukkadapu R, et al. Biological oxidation of Fe(II) in microbially reduced nontronite coupled with nitrate reduction by Pseudogulbenkiania sp. Strain 2002: Implications for remediation of nitrate contamination in the environment [J]. Geochimica et Cosmochimica Acta, 2013,119:231–247.
[22] Horn M A, Ihssen J, Matthies C, et al. Dechloromonas denitrificans sp. nov., Flavobacterium denitrificans sp. nov., Paenibacillus anaericanus sp. nov. and Paenibacillus terrae strain MH72, N2O-producing bacteria isolated from the gut of the earthworm Aporrectodea caliginosa [J]. International Journal of Systematic and Evolutionary Microbiology, 2005,55(3):1255–1265.
[23] Reinhold-Hurek B, Hurek T. The genera Azoarcus, Azovibrio, Azospira and Azonexus [M]. The prokaryotes. Springer, 2006: 873–891.
[24] L'Haridon S, Miroshnichenko M, Kostrikina N, et al. Vulcanibacillus modesticaldus gen. nov., sp. nov., a strictly anaerobic, nitrate-reducing bacterium from deep-sea hydrothermal vents [J]. International Journal of Systematic and Evolutionary Microbiology, 2006,56(5):1047–1053.
[25] Carlson H K, Clark I C, Blazewicz S J, et al. Fe(II) oxidation is an innate capability of nitrate-reducing bacteria that involves abiotic and biotic reactions [J]. Journal of Bacteriology, 2013, 195(14):3260–3268.
[26] Picardal F. Abiotic and microbial interactions during anaerobic transformations of Fe(II) and NOx?[J]. Frontiers in Microbiology, 2012,3(3):112.
[27] Nevin K P, Lovley D R. Mechanisms for accessing insoluble Fe(III) oxide during dissimilatory Fe(III) reduction by Geothrix fermentans [J]. Applied and Environmental Microbiology, 2002,68(5):2294–2299.
[28] Kong Y, Nielsen J L, Nielsen P H. Microautoradiographic study of Rhodocyclus-related polyphosphate-accumulating bacteria in full-scale enhanced biological phosphorus removal plants [J]. Applied and Environmental Microbiology, 2004,70(9):5383–5390.
[29] Takai K, Abe M, Miyazaki M, et al. Sunxiuqinia faeciviva sp. nov., a facultatively anaerobic organoheterotroph of the Bacteroidetes isolated from deep subseafloor sediment [J]. International Journal of Systematic and Evolutionary Microbiology, 2013,63(5): 1602–1609.
[30] 胡曉婷,程 呂,林賢彪,等.沉積物硝酸鹽異化還原過程的溫度敏感性與影響因素——以長江口青草沙水庫為例 [J]. 中國環境科學, 2016,36(9):2624–2632.
Shifts of microbial communities during Fe(II) oxidation coupled to nitrate reduction in paddy soil.
CHEN Peng-cheng1,2,3*, LI Xiao-min2, LI Fang-bai2*
(1.Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China;2.Guangdong Institute of Eco-Environmental and Soil Sciences, Guangzhou 510650, China;3.Graduate University of Chinese Academy of Sciences, Beijing 100049, China). China Environmental Science, 2017,37(1):358~366
A paddy soil which was collected from South China was cultivated in different treatments (Soil, Soil+Fe(II), Soil+NO3
X172
A
1000-6923(2017)01-0358-09
陳鵬程(1986-),男,廣東汕頭人,中國科學院廣州地球化學研究所博士研究生,主要從事土壤微生物環境生態研究.
2016-05-08
國家自然科學基金資助項目(41330857) * 責任作者, 研究員, cefbli@soil.gd.cn

