TGF-β3與熊果酸抑制人結腸癌細胞增殖作用的研究
邵 英,王東旭,陳前昭,曾于樺,周林云,周 益,任文艷,何百成
(1.重慶醫科大學藥理學教研室,2.重慶市生物化學與分子藥理學重點實驗室,重慶 400016)
TGF-β3與熊果酸抑制人結腸癌細胞增殖作用的研究
邵 英1,2,王東旭1,2,陳前昭1,2,曾于樺1,2,周林云1,2,周 益1,2,任文艷1,2,何百成1,2
(1.重慶醫科大學藥理學教研室,2.重慶市生物化學與分子藥理學重點實驗室,重慶 400016)
目的 研究TGF-β3與熊果酸(ursolic acid, UA)抑制結腸癌細胞增殖作用的關系及可能的分子機制。方法 采用結晶紫染色法和流式細胞術分析不同濃度UA對HCT116細胞增殖的作用。利用Western blot和流式細胞術等方法分析UA對HCT116細胞凋亡的影響。通過RT-PCR和(或)Western blot實驗分析UA在HCT116細胞中對TGF-β3、Smad2/3和β-catenin表達及磷酸化水平的影響。采用TGF-β3重組腺病毒和特異性抑制劑以及螢光素酶報告質粒分析TGF-β3介導UA抑制結腸癌細胞增殖的可能分子機制。結果 UA能明顯抑制HCT116細胞增殖,誘導G1期阻滯,并促進其凋亡。UA能明顯降低TGF-β3的mRNA和蛋白表達水平;UA對Smad2/3的總蛋白水平無明顯影響,但能明顯降低Smad2/3的磷酸化水平;外源性過表達TGF-β3可部分逆轉UA對HCT116細胞增殖的抑制作用,TGF-β3特異性抑制劑則增強UA對HCT116細胞增殖的抑制作用;UA降低β-catenin蛋白水平,并明顯抑制Wnt/β-catenin信號轉導;外源性過表達TGF-β3促進β-catenin蛋白表達,并部分逆轉UA對β-catenin蛋白表達的抑制效應;TGF-β3特異性抑制劑增強UA對β-catenin蛋白表達的抑制作用。結論 UA能抑制結腸癌細胞HCT116增殖并誘導凋亡,其作用可能是通過下調TGF-β3表達,進而抑制Wnt/β-catenin信號轉導。
熊果酸;結腸癌;增殖抑制;凋亡;TGF-β3;Wnt/β-catenin
結腸癌是消化系統的惡性腫瘤之一[1],目前治療所面臨的主要困難在于常用化療藥物的不良反應嚴重和腫瘤細胞的轉移。雖然近年來對結腸癌診斷和治療技術有了一定的進展,但預后仍不理想。因此,臨床仍需研發高效而低毒的藥物用于治療結腸癌。
熊果酸(ursolic acid ,UA)是從傳統中草藥中提取出的一種五環三萜類化合物,具有多種藥理活性,如鎮靜、抗炎、抗菌、降糖和抗潰瘍等[2]。近年來,UA因具有明顯的抗腫瘤活性而備受關注[3]。文獻報道,UA的抗腫瘤作用可能與抑制STAT3/COX-2、NF-κB、Wnt/β-catenin信號[4-7],激活p53有關[8],但具體分子機制目前仍然不清楚。
轉化生長因子β(TGF-β)對細胞的增殖與分化、胚胎發育以及血管生成等多種生理過程有重要的調控作用。TGF-β有3種亞型,即TGF-β1、TGF-β2和TGF-β3,三者均在結腸癌細胞中表達。研究表明,TGF-β3在腫瘤組織中呈明顯異常高表達[9]。TGF-β信號與Wnt/β-catenin信號之間存在cross-talk[10], Wnt/β-catenin信號的異常是引發結腸癌的重要因素之一[11]。UA可以有效抑制結腸癌細胞增殖,但這一作用是否與TGF-β3或Wnt/β-catenin信號有關,尚不清楚。
本實驗對UA抑制人結腸癌細胞增殖的作用進行了相關研究,并分析介導UA這種作用的可能分子生物學機制。結果顯示,UA明顯抑制結腸癌細胞增殖,并促進凋亡,這種作用可能與UA通過下調TGF-β3表達,進而抑制Wnt/β-catenin信號轉導有關。
1 材料與方法
1.1 試劑與細胞培養 熊果酸購自西安昊軒生物科技有限公司。HCT116細胞購自ATCC。本實驗所用TGF-β3、Smad2/3、p-Smad2/3、Bcl-2、Bad和GAPDH等一抗均購自Santa Cruz Biotechnology公司。TGF-β3特異性抑制劑(2-methoxyestradiol)購自賽力克公司。細胞培養采用DMEM高糖培養基(含10%的胎牛血清、100 kU·L-1青霉素以及0.1 g·L-1鏈霉素),細胞培養條件為5%的CO2和37 ℃。
1.2 重組腺病毒載體構建 本實驗使用的重組腺病毒載體通過AdEasy系統構建[12]。方法簡述如下:以EST克隆為模板,用高保真Taq酶通過PCR將目的基因編碼序列擴增并克隆到穿梭質粒中。線性化穿梭質粒后與骨架質粒進行同源重組,將重組正確的質粒線性化后轉染到HEK-293細胞中進行病毒包裝,得到目的基因的重組腺病毒載體(以綠色熒光蛋白進行標記)。所建病毒載體包括綠色熒光蛋白重組腺病毒載體(AdGFP,作為對照)和TGF-β3重組腺病毒載體(Ad TGF-β3)。
1.3 細胞增殖檢測實驗 將生長狀態良好的HCT116細胞均勻種到24孔板中,按實驗設計加入相應濃度的UA處理細胞(對照組細胞用相同體積的DMSO處理)。于相應時間點進行結晶紫染色[11],檢測UA對HCT116細胞增殖的影響情況。棄培養基,用PBS小心清洗孔板。每孔加入500 μL結晶紫飽和溶液(用PBS緩沖的10%甲醛配制),室溫下孵育20 min, 然后棄染液并用自來水小心清洗孔板。將孔板在室溫下晾干并掃描,再用20%的乙酸溶解結晶紫,于590 nm測定吸光度。每組實驗重復3次。
1.4 細胞周期及凋亡檢測實驗 將HCT116細胞均勻種于6孔細胞培養板中。貼壁后,按實驗設計加入相應濃度的UA進行處理。48 h后收集細胞,并用PBS(4 ℃)清洗,按試劑盒的說明進行操作。最后通過流式細胞儀進行細胞周期分析。采用Annexin V-EGFP和PI雙染法處理細胞,然后通過流式細胞儀分析。每組實驗重復3次。
1.5 RNA提取及RT-PCR實驗 將細胞種到T25培養瓶中,并用相應濃度的UA進行處理。采用TRIzol法提取總RNA,經逆轉錄反應制備成cDNA。最后,通過PCR檢測目的基因mRNA的表達水平。本實驗所用引物序列如下:GAPDH上游引物5′-CAACGAATTTGGCTACAGCA-3′, 下游引物5′-AGGGGAGATTCAGTGTGGTG-3′;TGF-β3上游引物5′-TGGTTAGAGGAAGGCTGAACTC-3′, 下游引物5′-ATGAGCAAATCCAACCTCAGAT-3′。每組實驗重復3次。
1.6 Western blot實驗 將生長良好的細胞均勻種于6孔細胞培養板中,待細胞貼壁后,按實驗設計加入相應濃度的UA進行處理。于處理后相應的時間點提取各組總蛋白,通過BCA法測定總蛋白濃度。SDS-PAGE法進行Western blot操作,利用ECL化學發光法顯影并采集圖像。每組實驗重復3次。
1.7 螢光素酶報告質粒檢測 將生長狀態良好的HCT116細胞種于T25培養瓶中,貼壁后Lipofectamine 2000轉染LEF/TCF4報告質粒(pTOP-Luc)3μg,4 h后換液。24 h后將細胞收集,并重新種于24孔細胞培養板中,分別用不同濃度的UA處理。24 h后,棄培養基并裂解細胞,按試劑盒操作說明測定螢光素酶活性。用BCA法測定裂解液總蛋白濃度,用于標準化螢光素酶活性。每組實驗重復3次。
2 結果
2.1 UA對HCT116細胞增殖的影響 結晶紫染色結果顯示,UA能有效地抑制HCT116細胞增殖,且抑制作用呈濃度和時間依賴性增強(Fig 1A);定量分析結果顯示,UA在15 μmol·L-1時已能明顯抑制細胞增殖(Fig 1B)。流式細胞術分析結果顯示,與對照組相比,UA能明顯誘導HCT116細胞發生G1期阻(Fig 1C)。結果提示,UA對HCT116細胞的增殖具有明顯抑制作用。
2.2 UA對HCT116細胞凋亡的影響 本研究進一步分析UA能否誘導結腸癌細胞凋亡。Western blot分析結果顯示,UA明顯增加Bad的水平,同時降低Bcl-2的水平(Fig 2A)。流式細胞術分析結果顯示,UA明顯呈濃度依賴性增加HCT116細胞凋亡比例(Fig 2B)。以上結果提示,UA對HCT116細胞凋亡具有促進作用。
2.3 UA對HCT116細胞中TGF-β3表達水平的影響 TGF-β信號對細胞的增殖與分化有重要調節作用,該信號異常與結腸癌的發生和進展密切相關。因此,我們接著分析UA對HCT116細胞的抗增殖作用是否與TGF-β有關。PCR和Western blot實驗結果顯示,UA呈濃度和時間依賴性降低TGF-β3 的mRNA和蛋白水平;同時,UA也明顯降低Smad2/3的磷酸化水平,但對Smad2/3的總蛋白表達沒有明顯影響(Fig 3)。結果提示,UA對HCT116細胞的抗增殖作用可能與抑制TGF-β3有關。
2.4 TGF-β3對UA抑制HCT116 細胞增殖作用的影響 為明確UA對HCT116細胞的抗增殖作用是否與其下調TGF-β3有關,本研究利用重組腺病毒介導的TGF-β3過表達或TGF-β3特異性抑制劑進行相關實驗。細胞周期分析結果顯示,外源性過表達TGF-β3部分逆轉UA誘導的G1期阻滯,但TGF-β3抑制劑則增強UA誘導G1期阻滯的作用(Fig 4A)。結晶紫染色結果顯示,外源性過表達TGF-β3能部分逆轉UA的抗增殖作用(Fig 4B),TGF-β3特異性抑制劑則增強UA對HCT116細胞的增殖抑制作用(Fig 4C)。結果提示,下調TGF-β3表達能部分介導UA對HCT116細胞的增殖抑制作用,但具體機制尚不清楚。
2.5 TGF-β3與UA對HCT116細胞Wnt/β-cate-nin信號轉導的影響 Wnt/β-catenin 信號參與細胞增殖與分化的調節,該信號異常也是結腸癌發生的主要原因之一。因此,我們進一步分析在HCT116細胞中UA是否會影響Wnt/β-catenin信號。螢光素酶報告質粒和Western blot結果顯示,UA呈濃度依賴性抑制LEF/Tcf4報告質粒的轉錄活性(Fig 5A),并明顯降低HCT116細胞中β-catenin的蛋白水平(Fig 5B)。UA對GSK3β的總蛋白無明顯影響,但能降低GSK3β的磷酸化水平(Fig 5B)。這些結果提示,UA的抗增殖作用可能與抑制Wnt/β-catenin信號轉導有關。我們推測,TGF-β3表達的下調可能與Wnt/β-catenin信號被抑制有關。實驗結果顯示,在HCT116細胞中,TGF-β3特異性抑制劑降低β-catenin蛋白表達,并增強UA對β-catenin表達的抑制作用(Fig 5C);外源性過表達TGF-β3促進β-catenin蛋白表達,并部分逆轉UA對β-catenin表達的抑制作用(Fig 5D)。以上結果提示,在人結腸癌細胞中,UA能通過下調TGF-β3實現對Wnt/β-catenin 信號轉導的抑制作用。
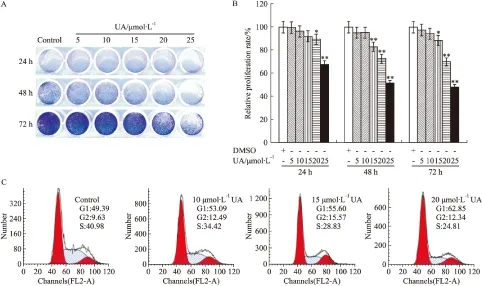
Fig 1 Effects of UA on proliferation in HCT116 cells
A:The crystal violet staining showed the effect of UA on proliferation in HCT116 cells;B:The quantification results of crystal violet staining showed the effect of UA on proliferation in HCT116 cells.*P<0.05,**P<0.01vscontrol;C:Flow cytometry analysis results showed the effect of UA on cell cycle in HCT116 cells
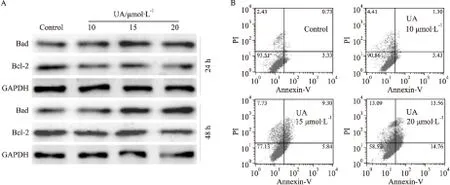
Fig 2 Effects of UA on apoptosis in HCT116 cells
A:Western blot results showed the effect of UA on the level of Bad and Bcl-2 in HCT116 cells;B:Flow cytometry analysis results showed the effect of UA on cell cycle in HCT116 cells
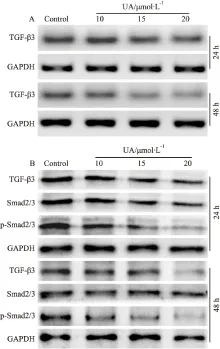
Fig 3 Effect of UA on TGF-β3 and Samd2/3 in HCT116 cells
A:PCR analysis results showed the effect of UA on the level of TGF-β3 in HCT116 cells;B:Western blot analysis results showed the effect of UA on the levels of TGF-β3, Smad2/3 and phosphorylation of Smad2/3 in HCT116 cells
3 討論
從傳統中草藥提取的天然產物或其衍生物是腫瘤化療藥物的重要來源之一,如長春新堿、喜樹堿和紫杉醇等早已用于臨床。UA作為一種五環三萜類化合物,普遍存在于多種藥用植物與水果中,且具有多種藥理活性,如鎮靜、降糖、抗炎和抗菌等。近年研究證實,UA還具有明顯的抗腫瘤活性[3,13]。其抗瘤機制可能與抑制STAT3、NF-κB、Wnt/β-catenin等有關[4,14-15],但具體機制仍不清楚。本研究證實,UA能明顯抑制人結腸癌細胞HCT116增殖,機制分析表明,UA的這種作用可能與通過下調TGF-β3表達,進而抑制Wnt/β-catenin信號轉導有關。
TGF-β是一類分泌型蛋白,通過激活經典Smads途徑,參與調節細胞的增殖、分化或凋亡等生理過程。TGF-β首先與其Ⅱ型受體結合,募集并使Ⅰ型受體磷酸化,活化后的Ⅰ型受體再募集并磷酸化Smad2與Smad3。磷酸化的Smad2/3使Smad4磷酸化,并與之結合形成異二聚體,然后轉位入核,與相應的效應元件結合,調節下游靶基因表達。研究報道,TGF-β信號通路的異常是結腸癌的主要病因之一,其3種亞型均與結腸癌相關[16]。 由于TGF-β3在腫瘤組織中的表達水平明顯要高于正常腸黏膜組織[9],因此我們推測TGF-β3在結腸癌的發展中可能起著關鍵作用。我們的研究結果已經證實,UA對結腸癌細胞具有抗增殖作用,但這種效應是否與TGF-β3有關仍不清楚。通過進一步分析,結果顯示UA明顯抑制TGF-β3表達,并明顯降低Smad2/3的磷酸化水平;外源性過表達TGF-β3則能部分逆轉UA對HCT116細胞的增殖抑制作用,而抑制TGF-β3則相應增強UA對HCT116細胞的抗增殖作用。以上結果提示,UA對HCT116細胞增殖的抑制作用可能與其下調TGF-β3表達有關,但TGF-β3介導UA這種作用的機制尚不清楚。
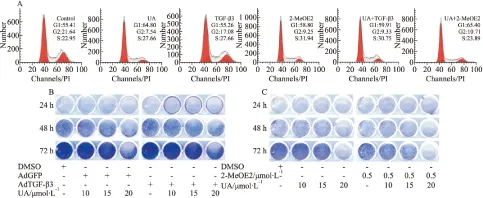
Fig 4 Effect of TGF-β3 on anti-proliferation effect of UA in HCT116 cells
A:Flow cytometry analysis results showed the effect of TGF-β3 on the cell cycle arrest effect of UA in HCT116 cells;B:The crystal violet staining results showed the effect of TGF-β3 on the anti-proliferation effect of UA in HCT116 cells;C:The crystal violet staining results showed the effect of TGF-β3 specific inhibitor on the anti-proliferation effect of UA in HCT116 cells(2-MeOE2:TGF-β3 inhibitor)

Fig 5 Effect of TGF-β3 on Wnt/β-catenin signaling in HCT116 cells
A:Luciferase reporter assay results showed the effect of UA on Wnt/β-catenin in HCT116 cells;B:Western blot analysis results showed the effect of UA on GSK-3β and the phosphorylation of GSK-3β in HCT116 cells;C:Western blot analysis results showed the effect of TGF-β3 specific inhibitor on the UA-induced decrease of β-catenin in HCT116 cells(2-MeOE2:TGF-β3 inhibitor);D:Western blot analysis results showed the effect of TGF-β3 on the UA-induced decrease of β-catenin in HCT116 cells
Wnt/β-catenin信號的異常是結腸癌的重要發病原因之一。這種異常可能與其重要成員突變有關,如APC和β-catenin等[11]。除此之外,Wnt/β-catenin信號本身也受其他信號的調節,如IGFs、PI3K/Akt、p53、TGF-β等。其中,TGF-β3受到Wnt/β-catenin 信號的調節[17],即TGF-β3與Wnt/β-catenin 信號之間可能存在相互調節的關系,但在結腸癌細胞中,TGF-β3與Wnt/β-catenin 信號之間的關系仍不清楚。我們的實驗結果顯示,在HCT116細胞中,UA明顯抑制Wnt/β-catenin信號轉導,并明顯降低β-catenin的蛋白表達水平;外源性過表達TGF-β3部分逆轉UA對β-catenin 表達的抑制作用;抑制TGF-β3則能促進UA對β-catenin表達的抑制作用。
本研究表明,UA對人結腸癌HCT116細胞具有增殖抑制作用,這種作用可能與其通過下調TGF-β3表達水平,進而抑制Wnt/β-catenin信號轉導有關。但在結腸癌細胞中, UA抑制TGF-β3表達,以及TGF-β3調節Wnt/β-catenin信號轉導的具體過程還有待進一步深入研究。
[致謝:本實驗在重慶市生物化學與分子藥理學重點實驗室完成。感謝何通川教授(Tong-Chuan He, 芝加哥大學醫學中心)為本研究提供重組腺病毒。]
[1] Roy S, Majumdar A P. Signaling in colon cancer stem cells[J].JMolSignal,2012, 7(1):11.
[2] Zang L L, Wu B N, Lin Y, et al. Research progress of ursolic acid′s anti-tumor actions[J].ChinJIntegrMed, 2014, 20(1):72-9.
[3] Chen H, Gao Y, Wang A, et al. Evolution in medicinal chemistry of ursolic acid derivatives as anticancer agents[J].EurJMedChem, 2015, 92:648-55.
[4] 唐 丹, 李劍萍,鄭錫鳳, 等.熊果酸通過STAT3通路調控胃癌細胞增殖和凋亡[J].中國藥理學通報, 2012, 28(2):179-84.
[4] Tang D,Li J P,Zheng X F, et al. Ursolic acid regulates the proliferation and aoptosis in gastric cancer through STAT3 pathway[J].ChinPharmacolBull, 2012, 28(2):179-84.
[5] 朱 悅, 周逸嬋, 朱國琴, 等.熊果酸抑制胃癌細胞COX-2表達的信號轉導研究[J].中國藥理學通報, 2016, 32(7):925-32.
[5] Zhu Y,Zhou Y C,Zhu G Q, et al. Signal transduction pathway of ursolic acid inhibiting COX-2 expression in gastric cancer cells[J].ChinPharmacolBull, 2016, 32(7):925-32.
[6] Park J H, Kwon H Y, Sohn E J, et al. Inhibition of Wnt/beta-catenin signaling mediates ursolic acid-induced apoptosis in PC-3 prostate cancer cells[J].PharmacolRep, 2013, 65(5):1366-74.
[7] Yie Y, Zhao S, Tang Q, et al. Ursolic acid inhibited growth of hepatocellular carcinoma HepG2 cells through AMPKalpha-mediated reduction of DNA methyltransferase 1[J].MolCellBiochem, 2015, 402(1-2):63-74.
[8] Prasad S, Yadav V R, Sung B, et al. Ursolic acid inhibits growth and metastasis of human colorectal cancer in an orthotopic nude mouse model by targeting multiple cell signaling pathways: chemosensitization with capecitabine[J].ClinCancerRes, 2012, 18(18):4942-53.
[9] Laverty H G, Wakefield L M, Occleston N L, et al. TGF-beta3 and cancer: a review[J].CytokineGrowthFactorRev, 2009, 20(4):305-17.
[10]Guerrero F, Herencia C, Almaden Y, et al. TGF-beta prevents phosphate-induced osteogenesis through inhibition of BMP and Wnt/beta-catenin pathways[J].PLoSOne, 2014, 9(2):e89179.
[11]劉映孜,金潔利,黃 軍,等. 粉防己甲素抑制人結腸癌細胞增殖與Wnt/β-catenin信號的關系研究[J].中國藥理學通報,2014,29(1):30-4.
[11]Liu Y Z, Jin J L, Huang J, et al. Study on the relationship between the anti-proliferation effect of tetrandrine and Wnt/β-catenin signal in colon cancer cells[J].ChinPharmacolBull, 2014,29(1):30-4.
[12]Luo J, Deng Z L, Luo X,et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J].NatProtoc, 2007, 2(5):1236-47.
[13]Kashyap D, Tuli H S, Sharma A K.Ursolic acid(UA): a metabolite with promising therapeutic potential[J].LifeSci, 2016, 146:201-13.
[14]Kim J H, Kim Y H, Song G Y, et al. Ursolic acid and its natural derivative corosolic acid suppress the proliferation of APC-mutated colon cancer cells through promotion of β-catenin degradation[J].FoodChemToxicol, 2014,67:87-95.
[15]Lin J, Chen Y, Wei L, et al. Ursolic acid inhibits colorectal cancer angiogenesis through suppression of multiple signaling pathways[J].IntJOncol, 2013,43(5):1666-74.
[16]Lampropoulos P, Zizi-Sermpetzoglou A, Rizos S, et al. TGF-beta signalling in colon carcinogenesis[J].CancerLett, 2012, 314(1):1-7.
[17]He F, Xiong W, Wang Y, et al. Epithelial Wnt/β-catenin signaling regulates palatal shelf fusion through regulation of TGFβ3 expression[J].DevBiol, 2011, 350(2):511-9.
Relationship between TGF-β3 and anti-proliferative effect of ursolic acid in human colon cancer cells
SHAO Ying1,2,WANG Dong-xu1,2,CHEN Qian-zhao1,2, ZENG Yu-hua1,2,ZHOU Lin-yun1,2,ZHOU Yi1,2,REN Wen-yan1,2,HE Bai-cheng1,2
(1.DeptofPharmacology, 2.ChongqingKeyLaboratoryofBiochemistryandMolecularPharmacology,ChongqingMedicalUniversity,Chongqing400016,China)
Aim To investigate the role of TGF-β3 in the anti-proliferation effect of ursolic acid(UA) in colon cancer cells and the possible molecular mechanism underlying this effect.Methods We introduced crystal violet staining, flow cytometry and Western blot assay to determine the effect of UA on proliferation and apoptosis in HCT116 cells. The levels of TGF-β3, Smad2/3 and β-catenin in HCT116 cell were evaluated by RT-PCR and Western blot. Finally, TGF-β3 inhibitor and recombinant adenovirus, and luciferase reporter assay were used to analyze the possible mechanism through which TGF-β3 mediated the anti-cancer effect of UA in HCT116 cells.Results UA inhibited the proliferation and induced apoptosis apparently in HCT116 cells. UA down-regulated TGF-β3 both in mRNA and in protein level. Meanwhile, UA decreasedthe phosphorylation of Smad2/3 concentration dependently, although no significant effect was found on the total protein level of Smad2/3 in HCT116 cells. Over-expression of TGF-β3 attenuated the inhibitory effect of UA on the proliferation of HCT116 cells,while the TGF-β3 inhibitor potentiated this effect. UA suppressed the transconduction of Wnt/β-catenin signaling in HCT116 cells through decreasing the level of β-catenin. Exogenous expression of TGF-β3 increased the level of β-catenin and partly reversed the UA-induced decrease of β-catenin. However, TGF-β3 inhibitor potentiated the inhibitory effect of UA on β-catenin in HCT116 cells.Conclusion The anti-proliferation activity of UA in colon cancer may be partly mediated through down-regulating TGF-β3 to suppress Wnt/β-catenin signaling at least.
ursolic acid; colon cancer; anti-proliferation; apoptosis;TGF-β3; Wnt/β-catenin
時間:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.020.html
2016-10-27,
2016-11-25
國家自然科學基金資助項目(No 81572226)
邵 英(1990-),女,碩士生,研究方向:分子藥理學,E-mail:18180058158@163.com; 何百成(1972-),男,博士,教授,研究方向:分子藥理學和干細胞生物學,通訊作者,E-mail:hebaicheng99@yahoo.com
10.3969/j.issn.1001-1978.2017.02.010
A
1001-1978(2017)02-0191-07
R284.1;R329.24;R329.25;R735.35;R977.6

