胡蘿卜類甜蛋白家族鑒定與生物信息學分析
劉 潮 韓利紅 王海波 宋培兵 唐利洲
(曲靖師范學院云南高原生物資源保護與利用研究中心,生物資源與食品工程學院,云南省高校云貴高原動植物多樣性及生態適應性進化重點實驗室,云南曲靖,655011)
胡蘿卜類甜蛋白家族鑒定與生物信息學分析
劉 潮 韓利紅 王海波 宋培兵 唐利洲*
(曲靖師范學院云南高原生物資源保護與利用研究中心,生物資源與食品工程學院,云南省高校云貴高原動植物多樣性及生態適應性進化重點實驗室,云南曲靖,655011)
為了全面了解胡蘿卜基因組中類甜蛋白家族基因結構和蛋白功能,利用胡蘿卜基因組數據庫,通過生物信息學方法對篩選的32個胡蘿卜類甜蛋白家族成員進行鑒定、聚類及結構功能分析。結果表明:胡蘿卜類甜蛋白家族基因分布在8條染色體上,該家族蛋白保守性較強。系統發育分析顯示,胡蘿卜類甜蛋白家族屬于10個進化組,其中進化組5中的基因主要來自1號染色體,該組成員具有抑菌潛力,值得深入研究。
胡蘿卜;類甜蛋白;系統進化;生物信息學
類甜蛋白(thaumatin-like protein,TLP)又稱為PR5蛋白,廣泛分布于多種植物、動物及微生物中(Abad et al.,1993;Shatters et al.,2006),具有廣譜的抗真菌活性、β-1,3葡聚糖酶活性、酶抑制活性、過敏原活性以及抗凍活性等(Liu et al.,2010),當植物遭受脅迫時被誘導表達,在植物的防御反應中發揮作用(van Loon et al.,2006;Beatrice et al.,2016;Rout et al.,2016),過表達TLP基因植物顯著延緩了病癥(Kalpana et al.,2006;Maruthasalam et al.,2007;Rout et al.,2016)。TLP蛋白除了參與植物的脅迫反應之外,也參與了生長發育的多項進程,有些植物(如櫻桃、蘋果、香蕉)果實成熟時很多TLPs高表達(Fils-Lycaon et al.,1996;Kim et al.,2003;Ho et al.,2007)。目前在擬南芥、水稻和楊樹基因組中已鑒定到多個TLPs(Liu et al.,2010;Zhao & Su,2010;Petre et al.,2011),對這些物種的TLP蛋白系統發育分析發現,水稻和擬南芥TLP分布于多個支系,并存在染色體內和染色體間的復制(Shatterset al.,2006)。研究植物基因組中TLP家族基因結構、分布與系統進化,對全面了解該家族蛋白在植物生命進程中的作用具有重要意義。
胡蘿卜(Daucus carota)原產于西亞,屬于傘形科胡蘿卜屬,根作蔬菜食用,含有多種維生素及胡蘿卜素,在世界各國普遍栽培。胡蘿卜苗期、成株期均有蟲害和白粉病、細菌性軟腐病等病害發生,往往造成胡蘿卜生產上毀滅性的損失。盡管對TLP家族的研究有了重大進展,但這些研究主要限于擬南芥和水稻等模式植物。為了全面了解胡蘿卜基因組中TLP家族基因結構和蛋白功能,本試驗通過生物信息學方法利用胡蘿卜基因組數據庫,從全基因組水平上分析TLP家族基因在胡蘿卜中的數目、基因結構、染色體定位以及系統進化,為進一步研究該家族成員的生物學功能奠定基礎。
1 材料與方法
1.1胡蘿卜TLP家族數據獲取與鑒定
胡蘿卜(D. carota)全基因組數據下載于GenBank數據庫,其基因組大小為473 Mb,分布于9條染色體,包括了32 113個基因座位,產生44 740個編碼蛋白轉錄本(Iorizzo et al.,2016)。以典型TLP蛋白1Z3Q(Musa acuminate)序列為探針,搜索胡蘿卜蛋白數據庫,在Pfam數據庫(http:// pfam.sanger.ac.uk/)和SMART數據庫(http://smart. embl-heidelberg.de/)中對候選蛋白序列功能域進行確認。通過Expasy(http://www.expasy.org/tools/)對蛋白生理生化特征進行預測。
1.2胡蘿卜TLP基因和蛋白結構及染色體定位分析
從GenBank數據庫中獲得胡蘿卜TLP蛋白對應的基因序列和CDS序列。使用基因結構顯示系統(http://gsds.cbi.pku.edu.cn/index.php)繪制基因結構示意圖。通過MEME SUITE在線工具(Bailey et al.,2009)(http://meme-suite.org/tools/meme)預測胡蘿卜TLP家族蛋白序列的保守Motif,Motif搜索數目為5,最大寬度20個氨基酸。通過 MapInspect(http://mapinspect.software.informer. com/)進行染色體定位作圖。利用Swiss-Model構建蛋白同源三級結構模型。使用VMD 1.8.5(http:// www.ks.uiuc.edu/Research/vmd/vmd-1.8.5/)進行3D結構的可視化。
1.3胡蘿卜TLP蛋白序列比對與系統進化分析
所有 蛋 白使 用ClustalX(Thompson et al.,1997)進行序列比對,應用MEGA 5.0(Tamura et al.,2011)軟件,采用NJ(Neighbor-Joining)法構建系統進化樹。
2 結果與分析
2.1胡蘿卜TLP家族成員的鑒定
采用生物信息學方法,鑒定到32個具有典型THN結構域的胡蘿卜TLP家族成員(表1)。32條TLPs序列中,有25條與1Z3Q序列一致性高于40%,所有序列E值均小于1E-30。蛋白理化性質分析顯示,最長的蛋白序列XP_017252308.1包含650個氨基酸,最短的XP_017229268.1也包含171個氨基酸,30個成員的蛋白氨基酸數目介于220~330之間,蛋白分子量介于18.64~68.39 kD,蛋白等電點介于4.17~8.99,69%的蛋白屬于酸性蛋白。
利用ClustalX進行序列比對,發現所有胡蘿卜TLP均含有16個半胱氨酸殘基,多數均具有索瑪甜家族標簽G-X-[GF]-X-C-X-T-[GA]-D-C-X-(1,2)-G-X-(2,3)-C和5個保守的REDDD氨基酸殘基,后者參與蛋白維持適當的拓撲結構和酸裂周圍的表面靜電勢,對TLPs抗真菌活性必不可少(Liu et al.,2012)。
2.2胡蘿卜TLP家族基因和蛋白結構分析
通過對胡蘿卜TLP家族基因結構、內含子位置和相位進行分析,發現5種基因結構類型,其中不含內含子和含有1、2、3(及以上)個內含子的基因數分別為6和17、6、3;相同數量內含子的基因類型中,內含子的相位又有多種類型,其基因結構類型較豐富。根據剪接中位置的不同,內含子分為3種相位類型,0型內含子位于2個密碼子之間,1型內含子位于密碼子的第1和第2堿基之間,2型內含子位于密碼子的第2和第3堿基之間(Sharp,1981)。相位的改變會導致后續閱讀框發生改變,因此內含子的相位通常是比較保守的。胡蘿卜TLP家族基因17個含有1個內含子的TLP基因中,7個均為1型相位。含有同樣內含子相位的基因可能來源于相同的祖先,可能是新近由基因擴張復制而來,而含有不同內含子相位的基因可能發生了獨立的內含子獲取或丟失,可能屬于較古老的基因。XP_017237350.1含有1個內含子,屬于數量最多的基因結構類型;XP_017233153.1和XP_017216393.1分別為不含內含子和含2個內含子的基因,屬于數量次之的基因結構類型(圖1)。
使用MEME SUITE在線軟件對胡蘿卜TLP家族蛋白序列保守氨基酸Motif進行分析,搜索參數選擇,最大寬度20個氨基酸。發現5類Motif的保守性較強,它們的正則表達式如圖2所示。30條序列均含有全部5種Motif,僅有蛋白XP_017229268.1缺少Motif 2和Motif 4,蛋白XP_017254223.1缺少Motif 5,說明該家族蛋白保守性較強。XP_017233153.1蛋白三維結構模型顯示,蛋白具有典型的3個功能域:DomainⅠ為N端核心功能域,由2個反向平行的β片層(分別包含5個和6個β折疊)組成;DomainⅡ由半胱氨酸二硫鍵形成的3個較短的α螺旋構成;Domain Ⅲ由2個β折疊和1個大環構成(Leone et al.,2006)。Motif 1位于蛋白“V”字形裂縫的內部,Motif 2位于功能域Ⅰ和功能域Ⅱ的結合部位,Motif 3位于功能域Ⅱ和功能域Ⅲ的結合部位,Motif 4位于蛋白“V”字形裂縫的外緣,屬于功能域Ⅱ,Motif 5位于蛋白序列的碳端,屬于功能域Ⅰ(圖3)。Motif 1、Motif 2、Motif 3和Motif 4構成了“V”字形裂縫,該部分保守的蛋白氨基酸殘基保證了蛋白催化功能的實現。
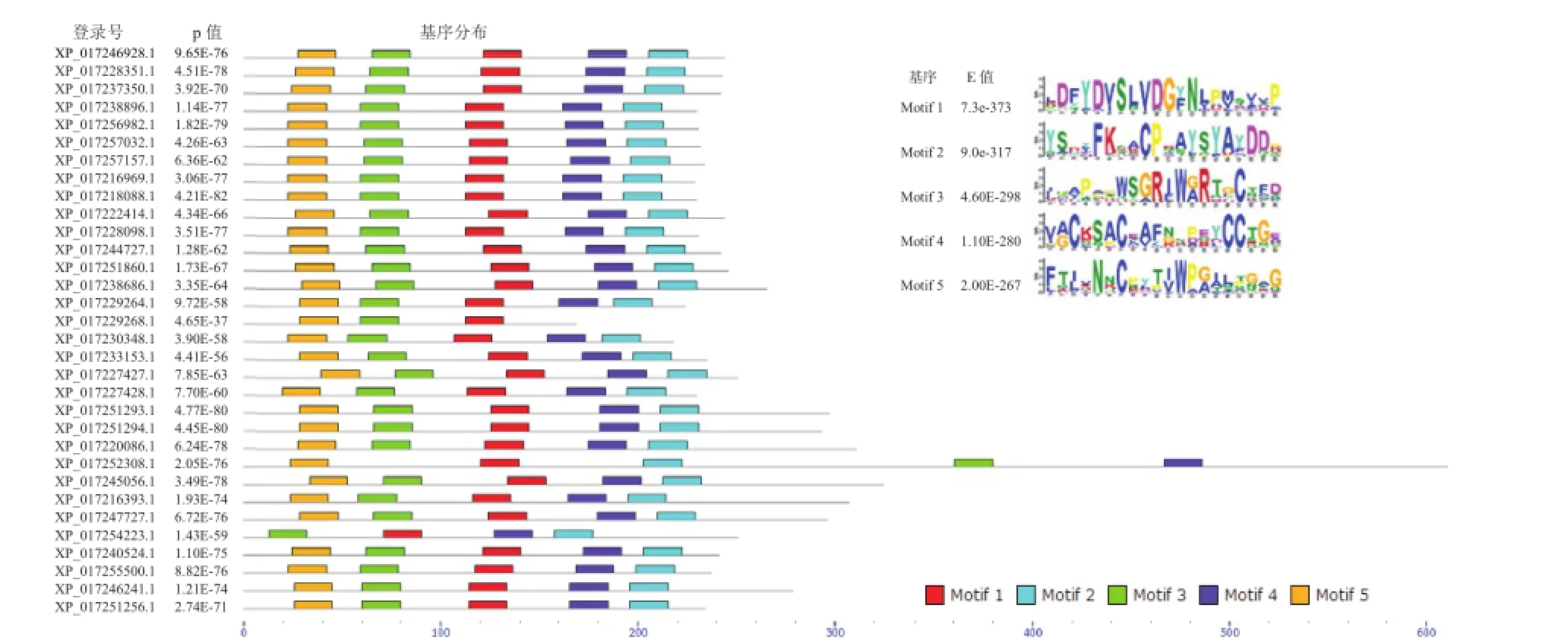
圖2 胡蘿卜TLP蛋白保守氨基酸基序分布
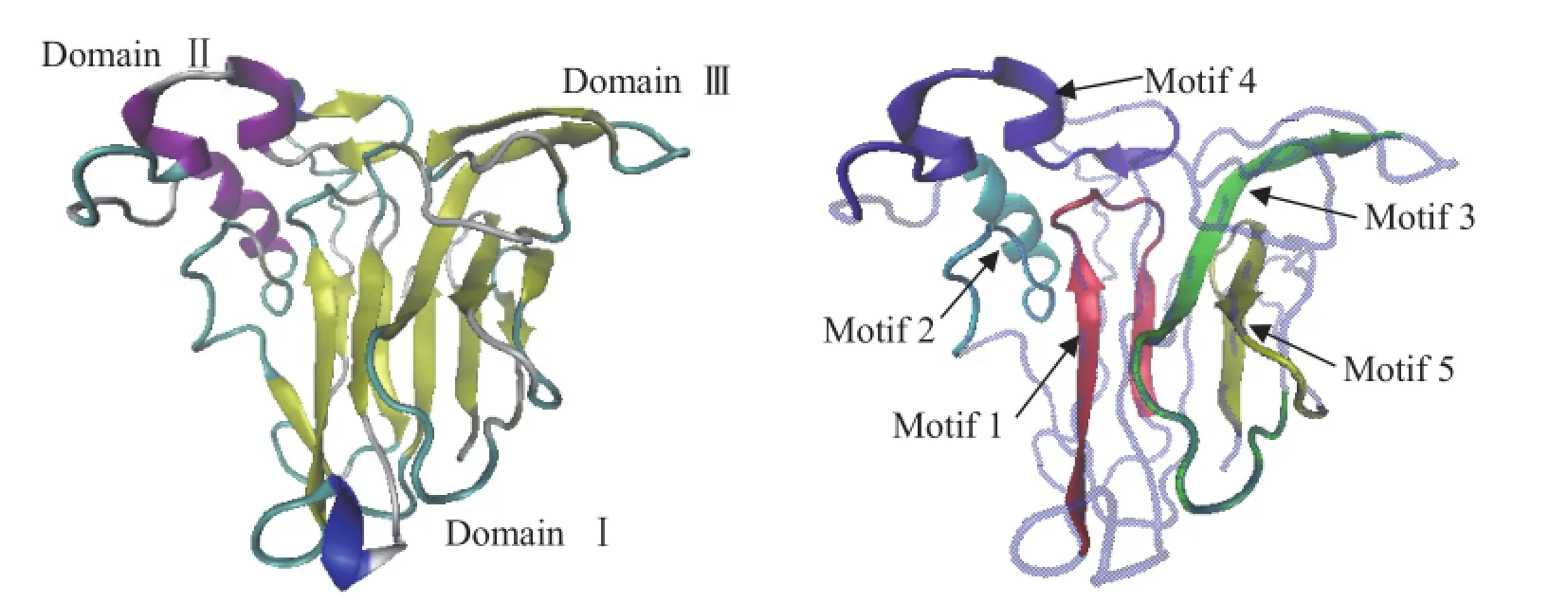
圖3 蛋白XP_017233153.1三維結構預測
2.3胡蘿卜TLP家族系統進化分析
為全面了解胡蘿卜TLP與其他物種同源基因的進化關系,選取了10個擬南芥(Arabidopsis thaliana)TLPs、10個 水 稻(Oryza sativa)TLPs和10個毛果楊(Populus trichocarpa)TLPs與32個胡蘿卜TLPs一起構建NJ系統進化樹(圖4),該進化樹以稻瘟病菌(Magnaporthe grisea)TLP(NCBI登錄號EAQ71431)作為外群。發現擬南芥、水稻和毛果楊的10個TLPs分別屬于10個進化組(Shatters et al.,2006;Jami et al.,2007),胡蘿卜TLPs在10個進化組中均有成員分布。其中進化組2成員最多,包含9個胡蘿卜TLP成員,其次為進化組5中含有6個DcTLPs,該組的其他物種成員能對病原或環境脅迫作出響應,并具有抑菌活性(Leone et al.,2006;Liu et al.,2012),進化組5中的胡蘿卜TLPs可能也具有抑菌活性。
2.4胡蘿卜TLP家族基因染色體定位分析

圖4 胡蘿卜TLP家族蛋白系統發育樹
采用MapInspect軟件繪制基因染色體定位圖,發現胡蘿卜TLP基因分布在9條染色體中的8條上(圖5)。其中1號、4號和6號染色體上分布最多,均有5個TLP基因;其次為3號和5號染色體,有4個TLP基因;8號和9號染色體最少,只有2個TLP基因。分析發現,胡蘿卜TLP基因在染色體上存在聚集現象,如在1號染色體的50 Mb、6號染色體的32 Mb、3號染色體的36 Mb、5號染色體的5 Mb、7號染色體的5 Mb、9號染色體的10 Mb位置都存在2個或2個以上的基因集中分布的現象。
3 結論與討論
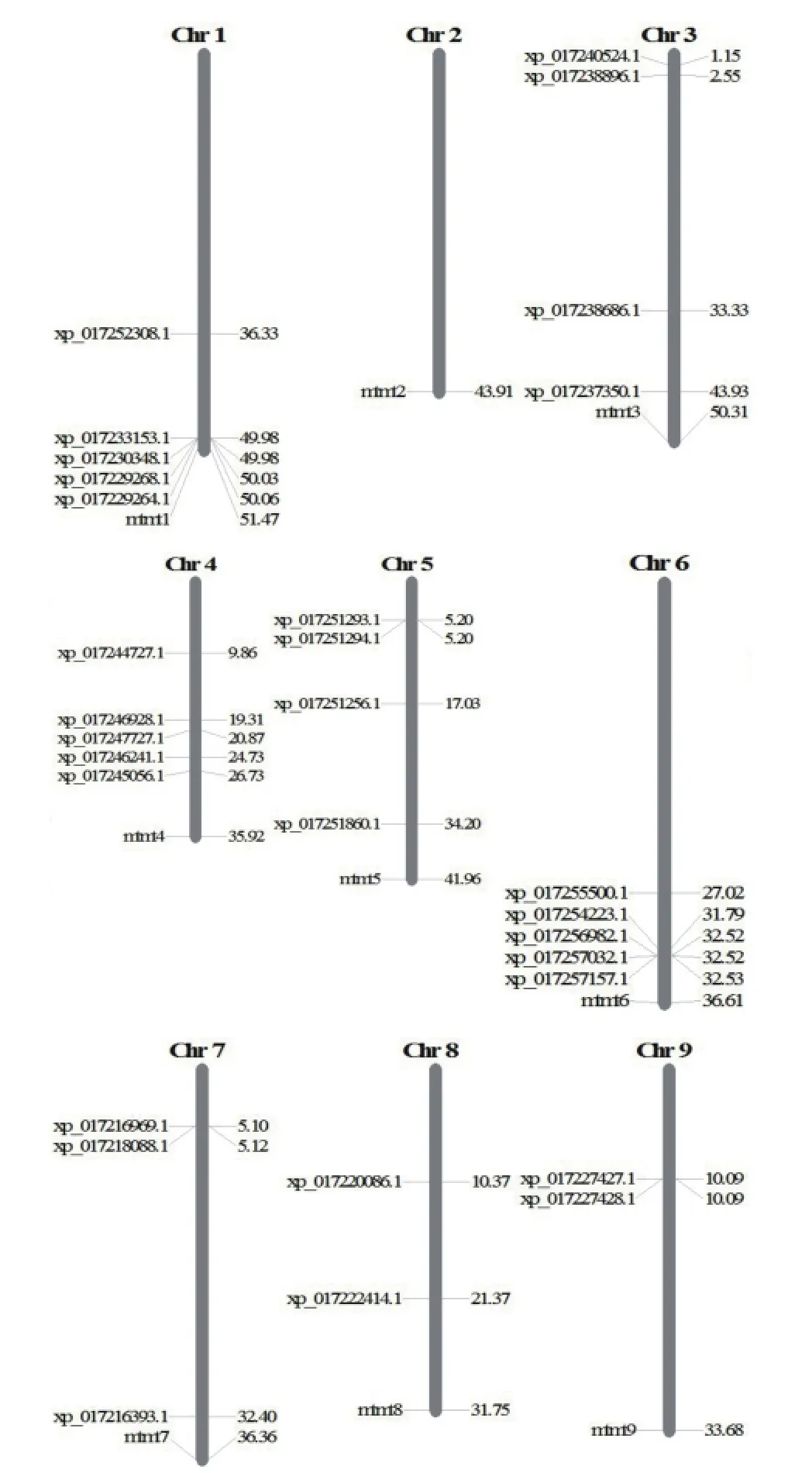
圖5 胡蘿卜TLP家族基因染色體定位
TLP轉基因作物顯著提高了其對病原真菌的抗性和對多種非生物脅迫的耐受性(Kalpana et al.,2006;Maruthasalam et al.,2007;Rout et al.,2016),因此,對植物TLP家族的研究受到越來越多的關注。本試驗通過生物信息學方法共獲得32條胡蘿卜TLPs序列,均具有THN功能域(PF00314)。通過搜索Superfamily 1.75 database(http://supfam.org/SUPERFAMILY/hmm.html)發現,植物基因組編碼TLP蛋白數量差異很大,如番木瓜(Carica papaya)編碼TLP蛋白數量為18,黃瓜(Cucumis sativus)29,木薯(Manihot esculenta)33, 番 茄(Solanum lycopersicum)34,桃(Prunus persica)38,小果野蕉(Musa acuminata)41,粳稻(Oryza sativa ssp. japonica)46, 谷 子(Setaria italica)46, 楊 樹(Populus trichocarpa)54, 柳 枝 稷(Panicum virgatum)65,玉米(Zea mays)67,面包小麥(Triticumaestivum)84,火炬松(Pinus taeda)87。蔬菜中編碼的TLP蛋白數量相對較少,糧食作物編碼數量較多,喬木火炬松中最多,這可能與植物所生存的脅迫環境有關,蔬菜作物一般種植面積相對較小,多為多樣性種植,所面臨的病理及環境脅迫壓力較小;而糧食作物一般為大面積單一化種植,病原微生物種類復雜多樣,很容易造成病害的大面積蔓延,面臨的環境脅迫壓力大,所以植物通過基因擴張產生更多的抗病相關基因以應對不良環境。雖然胡蘿卜TLP家族基因數量不是很多,但其基因結構類型仍較豐富,說明該家族基因容易發生內含子獲取或丟失,這與該家族基因功能的多樣性是一致的。
比較基因組通過對已知的基因和基因組結構進行比較,來了解基因的功能、表達機理和物種進化,通過對不同種生物的基因組數據及其垂直進化、水平演化過程進行比較研究,可以了解基因的結構及其調控作用。系統發育分析顯示,胡蘿卜TLPs家族基因數目和系統發育與擬南芥、水稻和楊樹類似(Liu et al.,2010;Zhao & Su,2010),主要分為10個進化組,說明單子葉植物和雙子葉植物進化上發生分離前TLP家族已經形成了10個進化祖先(Shatters et al.,2006),后續的進化過程中該家族基因較保守。染色體定位分析發現,胡蘿卜TLP家族多個基因存在集中分布現象,說明這些基因可能是通過基因復制進化而來的。各個進化組中TLP數量不一致,其中進化組2成員最多,成員數量次之的進化組5中含有6個TLPs,進化組5中的基因主要來自1號染色體,說明這些基因可能是染色體內復制的結果。Shatters等(2006)發現動物TLP蛋白可能是以單一祖先序列的形式來自于植物,而水稻和擬南芥TLP蛋白分布于多個支系,并存在染色體內和染色體間的復制,單子葉植物和雙子葉植物進化上發生分離后,TLP基因在10個進化枝上發生了不對稱的增加。本試驗結果與Shatters等(2006)的研究結果一致,即胡蘿卜的TLP蛋白也分布于多個支系,且可能存在染色體內和染色體間的復制現象。研究發現,進化組5中的其他物種TLPs能對病原或環境脅迫作出響應,如AT4G11650又稱為ATOSM34,編碼了擬南芥滲調蛋白,參與了擬南芥響應病原微生物和鹽害脅迫的信號途徑(Narasimhan et al.,2009),預示該組中胡蘿卜TLPs很可能也具有類似功能,具體活性值得深入研究。
為了更好的了解胡蘿卜TLP家族基因和蛋白的結構和功能,本試驗通過生物信息學方法對胡蘿卜TLP家族基因結構類型、基因染色體定位和系統進化進行詳細分析。共獲得32個胡蘿卜TLP家族基因,其基因結構類型多樣,且分布在多條染色體上,多個基因存在聚集現象,第5進化組中的成員具有抑菌潛力,值得深入研究。
Abad L R,D’Urzo M P,Liu D,Narasimhan M L,Reuveni M,Zhu J K,Niu X,Singh N K,Hasegawa P M,Bressan R A.1996.Antifungal activity of tobacco osmotin has specificity and involves plasma membrane permeabilization.Plant Science,118(1):11-23.
Bailey T L,Boden M,Buske F A,Frith M,Grant C E,Clementi L,Ren J,Li W W,Noble W S.2009.MEME SUITE:tools for motif discovery and searching.Nucleic Acids Research,w202-w208.
Beatrice C,Linthorst J M H,Cinzia F,Luca R.2016.Enhancement of PR1 and PR5 gene expressions by chitosan treatment in kiwifruit plants inoculated with Pseudomonas syringae pv.actinidiae.European Journal of Plant Pathology,doi:10.1007/s10658-016-1080-x.
Fils-Lycaon B R,Wiersma P A,Eastwell K C,Sautiere P.1996.A cherry protein and its gene,abundantly expressed in ripening fruit,have been identified as thaumatin-like.Plant Physiology,111:269-273.
Ho V S,Wong J H,Ng T B.2007.A thaumatin-like antifungal protein from the emperor banana.Peptides,28:760-766.
Iorizzo M,Ellison S,Senalik D,Zeng P,Satapoomin P,Huang J,Bowman M,Iovene M,Sanseverino W,Cavagnaro P,Yildiz M,Macko-Podgorni A,Moranska E,Grzebelus E,Grzebelus D,Ashrafi H,Zheng Z,Cheng S,Spooner D,van Deynze A,Simon P.2016.A high-quality carrot genome assembly provides new insights into carotenoid accumulation and asterid genome evolution.Nature Genetics.48(6):657-666.
Jami S K,Anuradha T S,Guruprasad L,Kirti P B.2007.Molecular,biochemical and structural characterization of osmotinlike protein from black nightshade(Solanum nigrum).Journal of Plant Physiology,164:238-252.
Kalpana K,Maruthasalam S,Rajesh T,Poovannan K,Kumar K K,Kokiladevi E,Raja J A J,Sudhakar D,Velazhahan R,Samiyappan R,Balasubramanian P.2006.Engineering sheath blight resistance in elite indica rice cultivars using genes encodingdefense proteins.Plant Science,170(2):203-215.
Kim S H,Lee J R,Kim S R.2003.Molecular characterization of a fruit-preferential thaumatin-like gene from apple(Malus domestica cv.Fuji).Journal of Plant Biology,46:52-58.
Leone P,Menu-Bouaouiche L,Peumans W J,Payan F,Barre A,Roussel A,van Damme E J M,Rougé P.2006.Resolution of the structure of the allergenic and antifungal banana fruit thaumatin-like protein at 1.7-A.Biochimie,88(1):45-52.
Liu D,He X,Li W,Chen C,Ge F.2012.Molecular cloning of a thaumatin-like protein gene from Pyrus pyrifolia and overexpression of this gene in tobacco increased resistance to pathogenic fungi.Plant Cell,Tissue and Organ Culture,111:29-39.
Liu J J,Sturrock R,Ekramoddoullah A K M.2010.The superfamily of thaumatin-like proteins:its origin,evolution,and expression towards biological function.Plant Cell Reports,29:419-436.
Maruthasalam S,Kalpana K,Kumar K K,Loganathan M,Poovannan K,Raja J A J,Kokiladevi E,Samiyappan R,Sudhakar D,Balasubramanian P.2007.Pyramiding transgenic resistance in elite indica rice cultivars against the sheath blight and bacterial blight.Plant Cell Reports,26(6):791-804.
Narasimhan M L,Bressan R A,D’Urzo M P,Jenks M A,Mengiste T.2009.Unexpected turns and twists in structure/function of PR-proteins that connect energy metabolism and immunity.Advances in Botanical Research,51:439-489.
Petre B,Major I,Rouhier N,Duplessis S.2011.Genome-wide analysis of eukaryote thaumatin-like proteins(TLPs)with an emphasis on poplar.Plant Biology,11:33.
Rout E,Nanda S,Joshi R K.2016.Molecular characterization and heterologous expression of a pathogen induced PR5 gene from garlic(Allium sativum L.)conferring enhanced resistance to necrotrophic fungi.European Journal of Plant Pathology,144(2):345-360.
Sharp P A.1981.Speculations on RNA splicing(minireview).Cell,23(643):621.
Shatters Jr R G,Boykin L M,Lapointe S L,Hunter W B,Weathersbee A A.2006.Phylogenetic and structural relationships of the PR5 gene family reveal an ancient multigene family conserved in plants and select animal taxa.Journal of Molecular Evolution,63(1):12-29.
Tamura K,Peterson D,Peterson N,Stecher G,Nei M,Kumar S.2011.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods.Molecular Biology and Evolution,28(10):2731-2739.
Thompson J D,Gibson T J,Plewniak F,Jeanmougin F,Higgins D G.1997.The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools.Nucleic Acids Research,25(24):4876-4882.
van Loon L C,Rep M,Pieterse C M J.2006.Significance of inducible defense-related proteins in infected plants.Annual Review of Phytopathology,44:135-162.
Zhao J P,Su X H.2010.Patterns of molecular evolution and predicted function in thaumatin-like proteins of Populus trichocarpa.Planta,232(4):949-962.
Identification and Bioinformatics Analysis of Thaumatin-like Protein Family in Daucus carota
LIU Chao,HAN Li-hong,WANG Hai-bo,SONG Pei-bing,TANG Li-zhou*
(Center for Yunnan Plateau Biological Resources Protection and Utilization,College of Biological Resource and Food Engineering,Key Laboratory of Yunnan Province Universities of the Diversity and Ecological Adaptive Evolution for Animals and Plants on YunGui Plateau,Qujing Normal University,Qujing 655011,Yunnan,China)
This study analyzed and identified gene structure and phylogenesis of 32 carrot thaumatinlike proteins through genome database and bioinformatics method. The results showed that the carrot TLP genes distributed on eight out of nine chromosomes,the protein sequences were more conserved. The phylogeny analysis showed that carrot TLPs were classified into 10 evolutionary groups,most members of group fifth derived from chromosome one,which have potential antifungal activity.
Daucus carota;Thaumatin-like protein;Molecular evolution;Bioinformatics
劉潮,男,博士研究生,講師,主要從事分子植物病理研究,E-mail:liuchao@mail.qjnu.edu.cn
*通訊作者(Corresponding author):唐利洲,博士,教授,主要從事動物遺傳多樣性研究,E-mail:tanglizhou@163.com
2016-11-17;接受日期:2017-01-12
國家自然科學基金項目(31460179),云南省高校云南特境內生菌資源的開發與利用科技創新團隊項目

