HIV-1型Nef基因重組表達載體的構建及其穩定表達細胞系的建立
李苗苗, 楊霄旭,楊朝霞,向雙林,韓 梅
(湖南師范大學生命科學學院,中國 長沙 410081)
HIV-1型Nef基因重組表達載體的構建及其穩定表達細胞系的建立
李苗苗, 楊霄旭,楊朝霞,向雙林,韓 梅
(湖南師范大學生命科學學院,中國 長沙 410081)
為了構建艾滋病毒HIV-1型Nef基因重組表達載體,利用PCR從pNL4-3質粒上擴增 HIV-1型Nef基因,獲得Nef基因完整的編碼區,構建可表達Nef蛋白的 pEB-myc-nef重組表達載體.經鑒定正確后,利用 LipofectamineTM2000將重組質粒轉染SW480細胞,通過Western Blot技術檢測 Nef蛋白的瞬時表達.為了建立穩定表達Nef基因的SW480細胞系,采用G418篩選建立穩定表達細胞系的方法,篩選出單克隆細胞系.擴大培養克隆細胞后,通過RT-PCR和Western Blot分別檢測Nef的mRNA轉錄水平及蛋白表達水平,經長達60 d的傳代,最終獲得穩定表達Nef基因的SW480細胞系,為研究RNAi在艾滋病治療方面的應用提供了細胞模型.
Nef基因;SW480細胞;G418;穩定細胞系
艾滋病(AIDS)全稱為“獲得性免疫缺陷綜合征”,是一種由人免疫缺陷病毒(HIV)引起的,以全身免疫系統嚴重損害為特征的傳染性疾病.RNA干擾(RNAi)是細胞內序列特異性抑制靶基因表達的機制,具有高效性、特異性和副作用小的特點,將其應用于抗HIV-1 治療研究是近來研究熱點[1-2].RNAi抑制HIV-1的復制,最直接的方法就是利用RNAi方法直接干擾HIV-1病毒的RNA,據文獻報道幾乎HIV-l的所有基因都可作為干擾的靶點:如LTR[3],gag[4-5],pol[6],vpu[7],vif[5],tat[8]和env[9]等基因.RNAi還可以將干擾的位點靶定到細胞上與HIV病毒感染密切相關的受體蛋白、輔助受體蛋白或其他的一些細胞因子[10].
負調控因子(negative factor,Nef) 是人免疫缺陷病毒( HIV) 附屬蛋白之一,相對分子質量小,柔韌性大,核心結構呈球形.Nef 不具酶活性,具有銜接蛋白的作用,可下調 CD4,主要組織相容性復合體Ⅰ(MHCⅠ),主要組織相容性復合體Ⅱ(MHC Ⅱ)和 CD28 分子,在對抗宿主免疫應答過程中發揮重要作用.Nef 可增強病毒的復制和感染性,抑制 HIV 感染細胞的凋亡,在 HIV 致病機制方面也發揮關鍵作用.基于Nef在體內的致病機制,多種抗HIV-1病毒策略被提出,使Nef成為潛在的HIV-1靶點.本文試圖構建穩定表達HIV-1型Nef蛋白的SW480細胞系,為研究RNAi在艾滋病治療方面的應用提供細胞模型.
1 材料和方法
1.1 材料
大腸桿菌TOP10感受態細菌、pEBMulti-neo-myc質粒、pNL4-3質粒、SW480細胞(人結腸癌細胞)均由本實驗室保存;RNA提取試劑TRIzol和LipofectamineTM2000轉染試劑購自Invitrogen公司; Ex Taq DNA聚合酶、T4 DNA連接酶、限制性內切酶BamHⅠ與NotⅠ購自ThermoFisher公司;DNA膠回收試劑盒、質粒提取試劑盒和去內毒試劑購自廣州東盛生物科技有限公司;G418購自Sigma公司;小鼠源Anti-myc抗體、內參蛋白actin抗體和HRP標記羊抗小鼠IgG均購自Santa Cruz公司;細胞培養所用的DMEM培養基和胎牛血清購自美國HyClone公司;其他常規試劑與耗材均購自于上海生工生物科技有限公司.
1.2 引物設計合成
參照pNL4-3質粒上HIV-1型Nef基因序列,利用Primer Premier 5 以及Nebcutter 2.0軟件設計的引物如下:Nef正向引物,5′-CGCGGATCCGGGTGGCAAGTGGGTC-3′;Nef反向引物,5′-ATTTGCGGCCGCTCAGCAGCTCTTGAAGTAC- 3′.分別在上游引物和下游引物5′端加上了BamHⅠ和NotⅠ酶切位點和相應的保護堿基,引物由上海生工生物有限公司合成.
1.3 HIV-1型Nef片段的擴增
以pNL4-3質粒為模板,使用Ex Taq DNA聚合酶,采用PCR擴增全長HIV-1型Nef基因編碼區,全長640 bp.PCR擴增體系(20 μL):10× Buffer 2 μL,10 mmol/L dNTP 0.5 μL,0.5 g/L pNL4-3質粒 1 μL,正向引物和反向引物(10 nmol/L)各1 μL,Ex Taq DNA聚合酶 0.25 μL,ddH2O 14.5 μL.PCR 的擴增條件:94 ℃預變性2 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸50 s,共進行32個循環,72 ℃繼續延伸10 min.得到的PCR產物經過1%的瓊脂糖凝膠電泳鑒定后,根據片段大小用DNA純化試劑盒進行切膠回收.
1.4 HIV-1型Nef真核表達載體構建
將上述PCR產物和pEBMulti-neo-myc質粒分別用限制性內切酶BamHⅠ和NotⅠ雙酶切后, 1%瓊脂糖凝膠電泳分離,膠回收純化,經T4 DNA連接酶過夜連接后轉化E.coliTOP10感受態,卡那霉素LB固體培養基篩選培養,挑取陽性克隆擴增后,進行菌液PCR鑒定,提取質粒進行酶切和DNA測序鑒定.
1.5 重組表達載體的瞬時表達及Western Blot檢測
SW480細胞培養于添加10%胎牛血清和100×青霉素-鏈霉素雙抗混合液的DMEM培養液中,在轉染前,將細胞接種于6 cm培養皿,接種量為2×106個細胞,過夜培養使其密度達80%~90%.參照LipofectamineTM2000轉染試劑產品說明書,將8 μg pEB-myc-nef重組表達質粒轉染SW480細胞,以轉染空載體pEBMulti-neo-myc質粒的SW480細胞為對照,48 h后收集細胞.冰上收獲細胞,經裂解后離心取上清,加入上樣緩沖液和DTT煮沸10 min.用10%SDS-PAGE膠分離細胞蛋白,上樣20 μg.110 V恒壓80 min轉至PVDF膜上.將轉膜后的PVDF膜用含5%的脫脂奶粉過夜封閉.再孵育小鼠抗myc的抗體,充分洗膜,隨后孵育HRP標記羊抗小鼠IgG,充分洗膜.然后各取1 mL ECL化學發光試劑A和B液混勻,5 min后平鋪于膜的蛋白面,通過顯影儀(Tonon公司)顯影拍照.
1.6 SW480細胞G418最低致死濃度的測定
將SW480細胞接種于96孔培養板中,在CO2培養箱中37 ℃培養.待細胞密度達到80%后,使用不同濃度G418(0,100, 200,300,400,500,600,700,800,900,1000 mg/L)的DMEM完全培養基培養細胞,每天更換培養基,連續觀察12 d,確定全部細胞死亡的最低濃度,即為最佳的G418篩選濃度.
1.7 穩定表達Nef基因的SW480細胞株的篩選和鑒定
SW480細胞接種于24孔板,培養16 h,細胞貼壁生長至匯合度達80%時,將0.8 μg pEB-myc-nef質粒在20μL脂質體Lipofectamine 2000TM介導下轉染SW480細胞.48 h后將細胞1∶10稀釋轉種24孔板,同時加入終濃度為900 mg/L的G418,同時設pEBMulti-neo-myc質粒轉染對照.2~3 d換液1次,待大部分細胞死亡之后,改用450 mg/L G418的培養液維持壓力篩選3周,挑出單個細胞集落,有限稀釋到96孔板進行單克隆篩選,篩選出的單克隆細胞依次于48孔、12孔、6孔板及6 cm和10 cm培養皿擴大培養.擴大培養到一定量后,進行冷凍保存.剩余的一些細胞連續傳代60 d以上(約30代),取一部分細胞進行Nef的RT-PCR檢測和Western Blot檢測,確保細胞株的穩定性.
2 結果
2.1 HIV-1Nef基因PCR擴增結果
使用PCR方法擴增Nef基因產物,將20 μL PCR反應產物進行1%瓊脂糖凝膠電泳后,可見1條約640 bp大小的片段(如圖1),片段大小符合預期,說明已成功擴增出HIV-1Nef基因.
2.2 真核表達載體pEB-myc-Nef的鑒定
2.2.1 轉化菌中Nef基因的PCR鑒定 將上述過夜連接的產物轉化E.coliTop10感受態細胞,卡那霉素LB固體培養基篩選培養,挑取4個克隆擴增后,進行菌夜PCR鑒定,結果如圖2所示,瓊脂糖電泳可見一條約為640 bp大小的Nef目的基因條帶,與預期的條帶大小吻合.

注:M:DNA marker; 1-4:PCR product of HIV-1 Nef gene圖1 PCR擴增產物的瓊脂糖凝膠電泳Fig.1 Agarose gel eletrophoresis of PCR product

注:M:DNA marker; 1-4:PCR products of different clones圖2 轉化菌中Nef基因的PCR分析Fig.2 PCR analysis of nef fragment in transferred bacteria
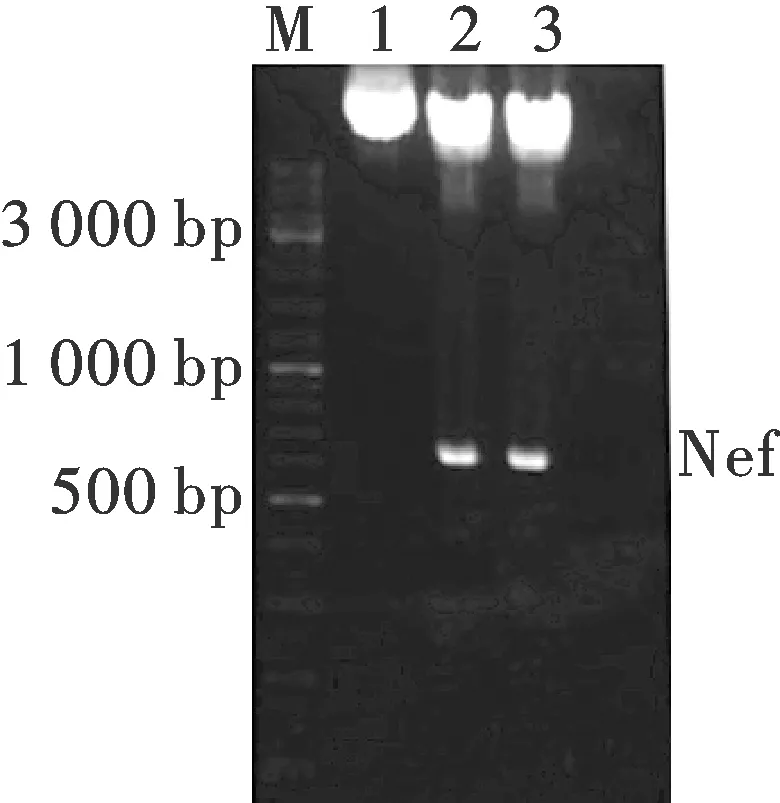
注:M:DNA marker; 1:pEB-myc-Nef; 2-3:pEB-myc-Nef/BamH Ⅰ+Not Ⅰ圖3 重組表達質粒pEB-myc-Nef的限制性內切酶酶切鑒定Fig.3 Restriction enzyme identification of the recombinant plasmid pEB-myc-nef
2.2.2 重組表達質粒pEB-myc-Nef的雙酶切鑒定
重組載體pEB-myc-Nef經BamH Ⅰ和NotⅠ雙酶切后,瓊脂糖電泳可見一條約為640 bp大小的Nef目的基因條帶,一條為10 223 bp大小的pEBMulti-neo-myc條帶(圖3),說明載體構建正確.
PCR擴增的Nef全長DNA序列插入pEBMulti-neo-myc載體,測序結果與pNL4-3質粒報道的Nef序列相符,表明Nef全長編碼區DNA成功插入到pEBMulti-neo-myc質粒中,且插入方向和閱讀框架均正確.
2.3 SW480細胞G418最低致死濃度的測定
使用G418終濃度分別為0~1 000 mg/L的DMEM培養液培養SW480細胞,觀察細胞的死亡情況.實驗發現,加藥后1 d,細胞形態正常,未出現明顯的變化;持續篩選7 d,大量細胞開始脫落死亡,貼于培養皿底部的細胞逐漸變圓;至12 d,細胞全部死亡(圖4).確定SW480細胞全部死亡的最低濃度為900 mg/L.

圖4 G418 毒性試驗細胞形態變化(10×)Fig.4 Cells morphology by G418 toxicity test(10×)
2.4Nef基因在SW480細胞中的瞬時表達
將重組質粒pEB-myc-Nef和載體質粒pEBMulti-neo-myc分別轉染SW480細胞,收集細胞,裂解后上樣進行Western Blot檢測,結果如圖5所示.重組質粒pEB-myc-Nef轉染細胞中在約29 000處有特異性條帶,而載體質粒pEBMulti-neo-myc轉染細胞中沒有,表明HIV-lNef基因在SW480細胞中進行了表達.圖中actin蛋白為內參蛋白.
2.5 穩定表達Nef基因的SW480細胞系的鑒定
pEB-myc-Nef質粒轉染SW480細胞后,經G418抗性篩選3周后,在顯微鏡下挑選出了4個細胞集落,經傳代擴增后,用Western Blot技術檢測到Nef的表達,而空載對照SW480細胞則未檢測到Nef基因的表達(圖6),并且在連續傳代60 d后,通過RT-PCR技術和Western Blot技術,仍可以檢測到Nef基因的轉錄(圖7)與表達(圖8).以上結果表明,已篩選到穩定表達HIV-1型Nef基因的SW480細胞株.

注:1:pEBMulti-neo-myc;2:pEB-myc-Nef圖5 Western blot鑒定Nef蛋白在SW480細胞中的表達Fig.5 Western blot analysis of Nef Protein expression in SW480

注:1-4:Nef protein expression in four cell clones transfected with recombinant expression plasmid; 5:non-Nef protein expression in SW480 cells transfected with contrast empty plasmid圖6 Western Blot鑒定G418篩選3周后Nef蛋白在SW480細胞中的表達Fig.6 Western Blot analysis of Nef protein expression in SW480 screened by G148 for three weeks

注:M:DNA marker; 1-3:SW480 cells transfected with recombinant expression plasmid; 4-5:SW480 cells transfected with contrast empty plasmid圖7 RTPCR檢測連續培養60天后單細胞克隆中Nef基因的轉錄Fig.7 RT-PCR analysis of Transcription of Nef gene in SW480 cells cultured for a further 60 days

圖8 Western Blot檢測連續培養60 d后單細胞克隆中Nef基因的表達Fig.8 Western Blot analysis of Nef gene expression in SW480 cells continued for a further 60 days
3 討論
RNAi通過降解mRNA或抑制蛋白質來沉默基因這種技術在生物學研究領域具有極重要的意義,RNAi不僅可以作為基因功能研究與評價的方法工具,它還可以作為一種基因治療的手段.2001年Tusehl研究組開創了RNAi技術治療人類疾病的新途徑.將RNAi用于病毒性疾病的治療和預防研究取得了一些顯著的效果,比如乙肝病毒(HBV)[13]、丙肝病毒(HCV)[14]、人乳頭瘤病毒(HPV)[15]、EB病毒[16].將RNAi應用于艾滋病治療的文獻也不計其數[17],這些研究都為HIV-1的基因治療提供了很好的參考依據.但是RNAi還無法應用于臨床治療艾滋病,阻礙這一進程的是RNAi的傳遞模式.
2006年,向雙林等提出利用修改過的非治病性細菌在體內及體外定向傳遞shRNA到靶細胞中以發揮干擾作用.他們將這種依賴細菌進行的RNAi傳遞技術稱之為TransKingdom RNAi (tkRNAi)[18].該研究的最終目的是將這種依賴細菌進行的RNAi傳遞技術應用到干擾艾滋病病毒的基因研究中,試圖探尋更有效的RNAi傳遞方法,為將RNAi應用到臨床上治療艾滋病提供理論依據.由于HIV病毒基因的RNAi干擾實驗在體內無法進行,構建能夠穩定表達HIV-1型病毒蛋白的細胞模型顯得至關重要.
本實驗從pNL4-3質粒上擴增出Nef基因,隨后與pEBMulti-neo-myc質粒共同經BamHⅠ和NotⅠ雙酶切,連接并轉化構建成pEB-myc-nef真核表達質粒.通過菌液PCR驗證、雙酶切驗證和DNA測序分析證明nef全長編碼區DNA成功插入到pEBMulti-neo-myc質粒中,且插入方向和閱讀框架均正確.利用 LipofectamineTM2000將重組質粒轉染SW480細胞,培養48 h后,裂解細胞,收集蛋白,利用Western Blot技術檢測到 Nef蛋白的瞬時表達.然后利用G418篩選建立穩定表達細胞系的方法,首次建立了穩定表達HIV-1型Nef基因的SW480細胞系,為研究tkRNAi在艾滋病治療方面的應用提供了細胞模型.
[1] LUIS I B K,SOCRATES S O,ENRIQUE R A.RNA interference and HIV-1 infection[J].Rev Med Virol,2008,18(1):5-18.
[2] BEN B,OLIVIER T B.Towards a durable RNAi gene therapy for HIV-AIDS[J].Expert Opin Biol Ther,2009,9(2):161-170.
[3] SAMANTHA B,SHEENA S,KARIN J,etal.The inhibitory efficacy of RNA POL Ⅲ-expressed long hairpin RNAs targeted to untranslated regions of the HIV-1 5′ long terminal repeat [J].Oligonucleotides,2007,17(4):419-432.
[4] WAHEED A A,FREED E O.HIV type 1 gag as a target for antiviral therapy [J].AIDS Res Hum Retroviruses,2012,28(1):54-75.
[5] OLIVIER T B,PAVLINA K,MUSTAFA C,etal.Silencing of HIV-1 with RNA interference:a multiple shRNA approach [J].Mol Ther,2006,14 (6):883-892.
[6] ZHANG T,CHENG T,WEI L H,etal.Efficient inhibition of HIV-1 replication by an artificial polycistronic miRNA construct [J].Virol J,2012,9:118.DOI:10.1186/1743-422X-9-118.
[7] LIANG Z P,GUO Z Y,WANG X,etal.Two retroviruses packaged in one cell line can combined inhibit the replication of HIV-1 in TZM-bl cells [J].Virol Sin,2012,27(6):338-343.
[8] UNWALLA H,ROSSI J J.Tat-regulated expression of RNA interference:Triggers for the treatment of HIV infection[J].Curr HIV/AIDS Rep,2008,5(1):40-43.
[9] PARK W S,HAYAFUNE M,MIYANO-KUROSAKI N,etal.Specific HIV-1 env gene silencing by small interfering RNAs in human peripheral blood mononuclear cells[J].Gene Ther,2003,10(24):2046-2050.
[10] JULIA J M E,GEERTS D,JEENINGA R E,etal.Long-term inhibition of HIV-1 replication with RNA interference against cellular co-factors[J].Antiviral Res,2011,89(1):43-53.
[11] SINGH S K,GAUR R K.Progress towards therapeutic application of RNA interference for HIV infection[J].Bio Drugs,2009,23(5):269-276.
[12] SOEJITNO A,WIHANDANI D M,KUSWARDHANI T.The therapeutic potential of RNA interference in controlling HIV-1 replication [J].Acta Medica Indonesiana,2009,41:215-221.
[13] WEINBERG M S,ELY A,BARICHIEVY S,etal.Specific inhibition of HBV replication in vitro and in vivo with expressed long hairpin RNA[J].Mol Ther,2007,15(3):534-541.
[14] KHALIQ S,KHALIQ S A,ZAHUR M,etal.RNAi as a new therapeutic strategy against HCV [J].Biotechadv,2010,28 (1):27-34.
[15] NIU X Y,PENG Z L,DUAN W Q,etal.Inhibition of HPV 16 E6 oncogene expression by RNA interference in vitro and in vivo [J].Int J Gynecol Cancer,2006,16(2):743-751.
[16] HONG M,MURAI Y,KUTSUNA T,etal.Suppression of Epstein-Barr nuclear antigen 1 (EBNA1) by RNA interference inhibits proliferation of EBV-positive Burkitt’s lymphoma cells [J].J Cancer Res Clin Oncol,2006,132(1):1-8.
[17] VLACHAKIS D,TSILIKI G,PAVLOPOULOU A,etal.Antiviral stratagems against HIV-1 using RNA interference (RNAi) technology[J].Evol Bioinf,2013,9(9):203-213.
[18] XIANG S L,FRUEHAUF J,LI C J.Short hairpin RNA-expressing bacteria elicit RNA interference in mammals[J].Nat Biotechnol,2006,24(6):697-702.
(編輯 WJ)
Recombinant Vector Construction and Stable Cell Line Establishment for Expression of HIV-1NefGene
LIMiao-miao,YANGXiao-xu,YANGZhao-xia,XIANGShuang-lin,HANMei*
(College of Life Sciences,Hunan Normal University,Changsha 410081,China)
In order to construct the recombinant expression vector and establish the stable SW480 cell line for expression of HIV-1Nefgene, HIV-1Nefgene was amplified from the plasmid of pNL4-3 by PCR,and its full ORF was cloned into pEBMulti-neo-myc vector to form the vector pEB-myc-nef.This vector expressing Nef and myc proteins was confirmed by sequencing analysis.The transient expression of Nef in SW480 cells transfected with the recombinant plasmid via LipofectamineTM2000 was then determined by Western Blot.Furthermore,SW480 cells transfected with pEB-myc-nef were screened by G418.Positive cell clones were cultivated and subcultured,and thenNeftranscriptional level and protein expression level were determined by RT-PCR and Western Blot,respectively.After continuous passage for 60 days,the SW480 cells transfected with the recombinant plasmid stably express Nef protein by G418 pressure selection,which will provide an appropriate cell model in order to study the application of RNAi in the treatment of AIDS.
Nefgene; SW480 cell; G418; stable cell line
10.7612/j.issn.1000-2537.2017.01.005
2016-03-14
湖南省科技廳重點項目(2014FJ2006);長沙市科技局重點項目(K1205221-31)
* 通訊作者,E-mail:hanmei@hunnu.edu.cn
Q78;R392
A
1000-2537(2017)01-0031-06

