間充質干細胞與未成熟樹突細胞聯合胰島細胞移植治療小鼠糖尿病
王婷婷,王紅燦,路玉蓉,葉東碩,楊登科,張光濤,張芳婷,龍光輝,張 健,楊寅柯
(1.湖南大學生物學院,中國 長沙 410082; 2.深圳市博圣康生物科技有限公司,中國 深圳 518000; 3.北京大學深圳醫院,中國 深圳 518000)
間充質干細胞與未成熟樹突細胞聯合胰島細胞移植治療小鼠糖尿病
王婷婷1,王紅燦1,路玉蓉2,葉東碩2,楊登科2,張光濤3,張芳婷3,龍光輝3,張 健1,楊寅柯1
(1.湖南大學生物學院,中國 長沙 410082; 2.深圳市博圣康生物科技有限公司,中國 深圳 518000; 3.北京大學深圳醫院,中國 深圳 518000)
為建立一種有效的胰島移植免疫耐受的新方案,利用流式細胞術鑒定未成熟樹突細胞(immature dendritic cells,imDCs),成骨誘導鑒定間充質干細胞(mesenchymal stem cells,MSCs),雙硫腙(Dithizone,DTZ)染色鑒定胰島細胞.胰島細胞與間充質干細胞聯合移植治療小鼠糖尿病,測定移植后糖尿病小鼠血糖及糖化血紅蛋白變化,結果發現200個胰島細胞與2×105個未成熟樹突細胞共同移植雖然未能顯著延長移植物的存活時間(7±2.65 d),但能顯著降低糖尿病小鼠血糖水平;200個胰島細胞與2×105個間充質干細胞共移植,可使血糖下降到較低水平,并維持移植物存活時間達8±2.31天;200個胰島細胞與2×105個間充質干細胞及2×105個未成熟樹突細胞共同移植于糖尿病小鼠,可使糖尿病鼠血糖下降并顯著延長移植物的存活時間(12.6±3.48 d).結果說明聯合移植在一定程度上可延長移植物的存活時間并使血糖維持在較低的水平,有效控制糖化血紅蛋白濃度,較單獨移植胰島細胞治療小鼠糖尿病有積極的作用.
樹突細胞;間充質干細胞;胰島細胞移植;糖尿病;糖化血紅蛋白
20世紀70年代以來,胰島移植成為治療糖尿病的主要選擇之一[1-3],胰島移植細胞的質量與數量是決定移植效果的關鍵,除了如何獲得高純度、高產量及高成活率的胰島細胞,胰島移植后無血管期以及后期的血管形成不良導致胰島丟失和胰島移植后效率低和免疫排斥也是目前亟需解決的問題[4].有研究表明,間充質干細胞(mesenchymal stem cells,MSCs)不僅可以產生促組織再生和修復的細胞因子和生長因子,防止糖尿病動物體內損傷的胰腺β細胞凋亡[5],而且可以通過形成胰島細胞分泌胰島素并穩定血糖水平[6-8].體外研究則發現,MSCs可抑制T細胞的活化和各種刺激引起的T細胞增殖,并表明MSCs異體移植不會引起免疫排斥反應,還可誘導產生非特異性免疫耐受[9].未成熟樹突細胞(immature dendritic cell,imDCs)不表達共刺激分子,當imDCs攜帶自身抗原移行至外周淋巴組織后不能使T細胞活化,從而誘導產生自身耐受,相應延長異種胰島細胞在糖尿病小鼠體內的存活時間[10-11].在本研究中作者考察間充質干細胞(MSCs)、未成熟樹突細胞(imDCss)與胰島細胞3種細胞不同移植方式在治療糖尿病鼠中的治療效果,建立一種胰島移植治療糖尿病鼠免疫耐受的新方案,為臨床開展胰島移植治療糖尿病提供有益的探索.
1 材料與方法
1.1 材料
BALB/c小鼠(6周齡),SD大鼠(270 g)均購自廣東醫學實驗動物中心;胎牛血清(GIBCO);RPMI-1640,DMEM/F12培養基,HBSS,青霉素和鏈霉素均購自HYCLONE;MTT及DMSO均購自上海生物工程有限公司;淋巴細胞分離液(Histopaque-1.077 g/mL),膠原酶-V,鏈脲佐菌素(STZ),雙硫腙(DTZ)及吖啶橙/碘化丙啶(AO/PI)均購自SIGMA;Rat INS (Insulin) ELISA Kit 購自Elabscience;小鼠糖化血紅蛋白(HbA1c)ELISA Kit購自上海研謹生物科技有限公司;Anti-Mouse CD11c FITC,Anti-Mouse CD86 FITC,Anti-Mouse CD80 FITC,Anti-Mouse MHC-Ⅱ FITC,Rat IgG2b K Isolype Control FITC,Armenian Hamster IgG Isotype Control FITC,Rat IgG2a K Isotype Control FITC均購自EBIOSCIENCE;重組小鼠粒細胞-巨噬細胞集落刺激因子(recombinant mice granulocyte macrophage colony stimulating factor,rmGM-CSF和重組小鼠白介素-4 (recombinant mice interleukin4,rmIL-4) 購自PEPROTECH;血糖儀及血糖試紙為羅氏ACCU-CHEK?Performa.流式細胞儀為BD;酶標儀為Bio-Tek.
1.2 方法
1.2.1 間充質干細胞(MSCs)的分離培養和成骨誘導 取6~8周齡的雄性BALB/c小鼠斷頸處死,無菌取出雙側的股骨和脛骨,剔凈周圍組織,后用DMEM/F12培養基(含1%青霉素/鏈霉素)沖洗.剪掉兩端膨大關節,用DMEM/F12完全培養基沖洗髓腔,至髓腔變白.沖洗液經74 μm濾網過濾,收集濾液并離心,重懸細胞,調整細胞密度為2~5×106/mL,用6孔板培養.將培養板放入37 ℃,5%CO2的培養箱中,3 h后,換液,去除不貼壁的細胞.此后,每8 h換液一次,棄去未貼壁細胞,直至72 h(從初始培養算起).以后每3 d換液一次,待細胞達到90%融合時,用0.25%胰酶消化并傳代,繼續放入37 ℃,5%CO2的培養箱中培養,取純化的第3代MSC接種于24孔板,細胞生長融合至80%~90%時,換成成骨誘導培養基,每3 d換液一次,以含10%FBS的DMEM/F12為對照.37 ℃,5%CO2培養箱培養.誘導2周后,ALP鈣鈷法染色,誘導3周的細胞,Von kossa’s礦化染色.
1.2.2 未成熟樹突細胞(imDCss)的分離培養和鑒定 取6~8周齡的雄性BALB/c小鼠斷頸處死,無菌取出雙側的股骨和脛骨,剔凈周圍組織,用RPMI-1640 培養基沖洗,減掉兩端膨大關節,用培養基沖洗髓腔,至髓腔變白,沖洗液經74 μm濾網過濾,收集濾液離心,收集細胞.加入1mL細胞裂解液,輕輕拍打30~60 s后立即加入50 mL冷的PBS稀釋裂解液,離心后細胞計數,調整細胞濃度至2×106/mL.
收集的細胞用含10%FBS的RMPI-1640培養基(含1%青霉素/鏈霉素),37 ℃,5%CO2培養箱培養.同時培養基中加入20 μg/L Recombinant Mouse GM-CSF,10 μg/L Recombinant Mouse IL-4;第3天和第5天半量換液,補充GM-CSF和IL-4至全量,培養到第7天,進行流式鑒定,鑒定的抗體表型分別為CD11c,MHC-Ⅱ,CD86,CD80.
1.2.3 大鼠胰島細胞的分離純化及活力檢測 將成年SD大鼠(8~10周齡,體重250~300 g)用戊巴比妥鈉麻醉;打開腹腔,結扎胰管;經膽總管向胰腺注入膠原酶V溶液(1 g/L) 8~10 mL,摘取胰腺,37.5℃水浴20 min后終止消化,通過0.45 mm篩網過濾細胞.洗滌后用Histopaque@-1077純化獲得胰島細胞;收集細胞,再洗滌,取5 mL胰島懸液雙硫腙(DTZ)染色,普通光學顯微鏡下觀察拍照,并進行胰島當量計數和純度分析.重復3次,分別鏡檢計數雙硫腙(DTZ)陽性細胞團.胰島當量=(3次陽性胰島數值之和/3)×[樣本總量(mL) / 50 μL],胰島的純度=DTZ染色陽性的胰島個數/細胞團總數×100%,此實驗中胰島的純度=紅色 / (紅色+黃色)×100%.
以無酚紅Hanks液配置AO儲存液及PI儲存液,避光4 ℃保存.使用前,稀釋成規定的濃度,活的胰島細胞經AO/PI染色呈綠色,死亡的胰島細胞經AO/PI染色呈紅色.拍照并用Image-Pro plus軟件分析胰島細胞活力.胰島的活力=綠色/(紅色+綠色)×100%.
1.2.4 葡萄糖刺激胰島細胞胰島素釋放濃度的測定 用含2.8 mmol/L葡萄糖和16.8 mmol/L葡萄糖的無血清RPMI-1640培養基,將分離純化后的胰島細胞接種于24孔板,每孔約100 IEQs胰島細胞,37 ℃各孵育2 h,分別收集培養液保存,ELISA法測定培養液中胰島素的含量.刺激指數(Stimulation Index,SI)=16.8 mmol/L葡萄糖刺激下的胰島素濃度/2.8 mmol/L葡萄糖刺激下的胰島素濃度.
1.2.5 體外混合淋巴細胞反應(MLR)及MTT法檢測淋巴細胞增殖影響 以SD大鼠外周血T淋巴細胞為反應細胞(R),分別將絲裂霉素C(40 mg/L)處理的 MSCs,imDCs,imDCs+MSCs作為刺激細胞,調整細胞密度,將一定濃度的反應細胞與相應濃度的刺激細胞(S)(S與R數目比為1∶10)加入到96孔細胞培養板中,每孔200 μL 10%FBS RPMI 1640培養基,每組3個復孔, 37 ℃,5%CO2培養箱培養3天.終止反應前4 h,每孔加入MTT(5 g/L)20 μL,4 h后,離心棄上清,每孔加入100 μL DMSO,振蕩10 min,使結晶充分溶解,酶標儀(BIO-TEK)570 nm處測定吸光度.并計算其刺激指數(SI)=實驗組OD570吸光度/對照組OD570吸光度.
MLR實驗分為5組:A組(陰性對照組):DC(SD大鼠,方法同小鼠imDCs)與T細胞混合培養組(nS∶nR為1∶10,即T細胞為1×105/孔,DC為1×104/孔);B組:(陽性對照組):mDCs(LPS刺激imDCs成熟)與T細胞混合培養組(nS∶nR為1∶10);C組:MSCs與T細胞混合培養組(nS∶nR為1∶10); D組:imDCs與T細胞混合培養組(nS∶nR為1∶10);E組: imDCs及MSCs與T細胞混合培養組(T細胞為1×105/孔,MSCs為5×103/孔,imDCs為5×103/孔).
1.2.6 小鼠糖尿病模型的建立 以pH 4.5的0.1 mol/L檸檬酸-檸檬酸鈉緩沖液配置12 g/L鏈脲佐菌素(STZ)溶液,0.22 μm濾膜過濾除菌后置冰上備用.BALB/c小鼠,雄性,8~10周齡,75%酒精常規消毒腹部皮膚,150 mg/kg體重腹腔注射鏈脲佐菌素(STZ)溶液.注射72 h后開始測定血糖,連續測定5 d,每天血糖都維持16.7 mmol/L以上為造模成功.
1.2.7 實驗分組及術后血糖、糖化血紅蛋白檢測 將8~10周齡的糖尿病雄性BALB/c小鼠隨機分為5組,接受胰島與同源未成熟樹突細胞(imDCs)或間充質干細胞(MSCs)的移植.糖尿病小鼠用戊巴比妥鈉麻醉后,在背部肋下皮膚處做一小切口,以無菌棉簽擠壓暴露左腎.A組(n=5):糖尿病模型對照組,未移植細胞;B組(n=6):200個胰島移植于糖尿病小鼠左腎被膜下;C組(n=6):200個胰島與2×105個間充質干細胞(MSCs)移植于糖尿病小鼠左腎被膜下;D組(n=6):200個胰島及2×105個未成熟樹突細胞(imDCs)移植于糖尿病小鼠左腎被膜下;E組(n=5):將200個胰島、2×105個間充質干細胞(MSCs)及2×105個未成熟樹突細胞(imDCs)共同移植于糖尿病小鼠左腎被膜下.移植后,尾靜脈采血檢測血糖值,移植后連續兩次血糖水平>11.1 mmol/L定義為發生移植排斥反應,連續兩次血糖水平>16.7 mmol/L定義為移植物失功.
移植后,每4 d小鼠眼眶取血ELISA法測定糖化血紅蛋白(HbA1c)濃度.糖化血紅蛋白的濃度:HBA1C%=HbA1c(g/dl)/Hb(g/dl) ×100%.糖化血紅蛋白為4%~6%時定義為血糖控制正常;6%~7%為血糖控制比較理想;7%~8%定義為血糖控制一般;8%~9%定義為控制不理想;糖化血紅蛋白>9%定義為血糖控制很差.ADA(美國糖尿病學會)建議糖化血紅蛋白控制在小于7%,IDF(國際糖尿病聯盟)建議糖化血紅蛋白控制標準為小于6.5%,目前我國將糖尿病患者糖化血紅蛋白的控制標準定為6.5%以下.采用SPSS 13.0統計軟件分析,組間比較采用單因素方差分析,數據采用均數±標準差表示.P<0.05表示差異有統計意義.
2 結果與分析
2.1 MSCs形態觀察及成骨誘導培養鑒定
骨髓細胞貼壁法培養72 h后,在顯微鏡下觀察,發現貼壁細胞形態不均一,有成纖維樣細胞,也有小的圓形細胞等[圖1A(彩圖見封三)].一周后主要以梭樣細胞為主,經多次傳代培養后細胞形態均一(圖1B,第三代),表現出典型的間充質干細胞(MSCs)形態.對傳代培養第三代細胞進行成骨誘導實驗,鑒定所分離細胞為MSCs,顯微鏡下可見:鈣鈷法染色可見細胞質有大量褐色沉淀, ALP呈陽性表達(見圖1C);Von kossa’s礦化染色可見細胞聚集處有黑色骨塊,島狀分布(見圖1D).
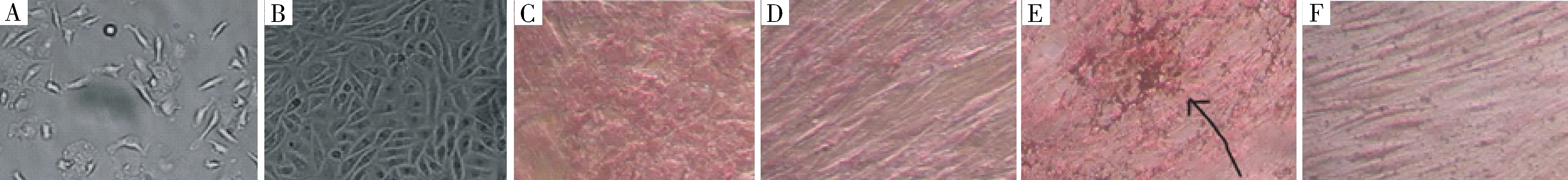
A.72 h后貼壁細胞;B.傳代培養第三代;C.ALP鈣鈷法染色;D.ALP鈣鈷染色對照;E.Von Kossa’s礦化染色;F.Von Kossa’s 礦化染色對照圖1 小鼠間充質干細胞形態圖及成骨鑒定(10×10)Fig.1 Morphology and osteogenic differentiation potential of mouse mesenchymal stem cells (10×10)
2.2 imDCs形態觀察及表面標志測定
利用BALB/c小鼠骨髓誘導培養樹突狀細胞,3 h后只保留貼壁細胞,培養3 d即可見大量集落形成[圖2A(彩圖見封三)],隨著培養時間的延長,細胞體積、形態變化,培養7 d后細胞形態不規則,細胞表面產生不規則的毛刺狀突起(圖2B).經流式細胞儀分析鑒定,結果發現小鼠骨髓未成熟樹突細胞高表達CD11c(89.9%),中度表達MHC-Ⅱ(36.61%),低表達CD80 (5.03%)和CD86 (1.5%)(見圖3),符合imDCs表面標志物的特征.
A.培養3 d形成的細胞集落 B.培養7 d的細胞形態圖2 小鼠未成熟樹突細胞形態圖(10×10)Fig.2 Figures of immature dendritic cells (10×10)
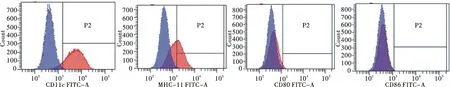
圖3 小鼠未成熟樹突細胞流式鑒定Fig.3 Flow cytometric analysis of imDCs surface molecules
2.3 大鼠胰島細胞的形態觀察及活性檢測
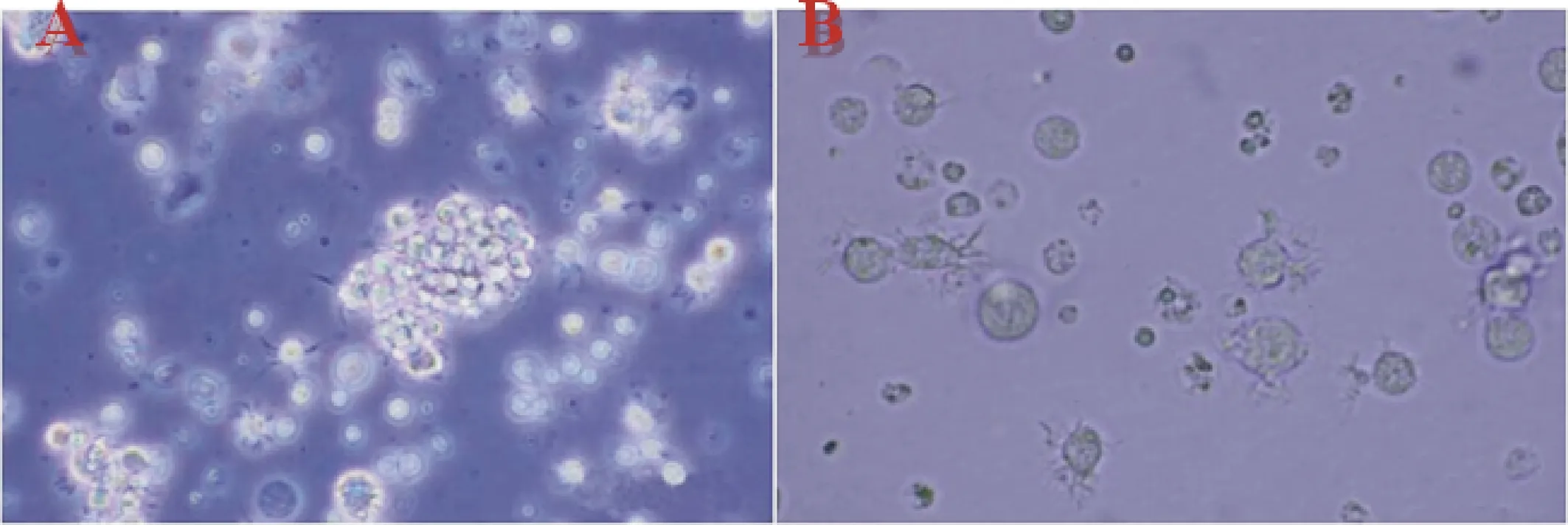
顯微鏡下觀察純化后的胰島細胞形態如圖4A(彩圖見封三);胰島細胞經DTZ染色見圖4B,胰島細胞呈猩紅色,外分泌細胞不會被DTZ染色而呈黃色,結果分析發現純化前分離的大鼠胰腺胰島純度為4.5%±1.5%,純化后為67%±9.85%;純化后胰島細胞AO/PI染色結果見圖4C,其中活細胞被染成綠色,而死亡的胰島細胞呈紅色,選擇4個不同的視野進行拍照,Image-pro plus 6.0分析胰島純化后的細胞存活百分比,即胰島的活力,本研究中作者共分析了4例大鼠胰腺分離純化后活力,結果如圖4D所示,純化后獲得的胰島存活率平均為(91±3)%.

A.純化后的胰島(25×10) B.胰島DTZ染色(25×10) C.胰島AO/PI染色 (25×10) D.分離的大鼠胰島活力圖4 大鼠胰島細胞的形態觀察及活性檢測Fig.4 Morphological observation and activity detection of islets
2.4 葡萄糖刺激分離的胰島細胞胰島素釋放濃度
ELISA法檢測不同濃度葡萄糖刺激胰島細胞后胰島素釋放水平,結果如圖5所示,分離的大鼠胰島細胞在體外培養條件下對葡萄糖的刺激仍具有良好的胰島素釋放能力,SI為2.53±0.29.
2.5 imDCs與MSCs對MLR中T淋巴細胞抑制作用
分別比較imDCs-T細胞共培養組和MSCs-T細胞共培養組以及imDCs+MSCs-T細胞共培養組中T細胞增殖能力,結果發現imDCs+MSCs-T細胞共培養組對T細胞刺激顯著低于其他各組,MTT檢測分析表明imDCs+MSCs對T細胞刺激能力低,并能顯著抑制T細胞的增殖(SI=1.15±0.12,P<0.05),結果如圖6所示,與對照組(mDCs-T細胞共培養組)相比,imDCs-T細胞(SI=1.58±0.18),MSCs-T細胞(SI=1.66±0.13),說明imDCs與MSCs均對T細胞增殖有抑制作用,而imDCs+MSCs對T細胞的抑制效果更明顯.
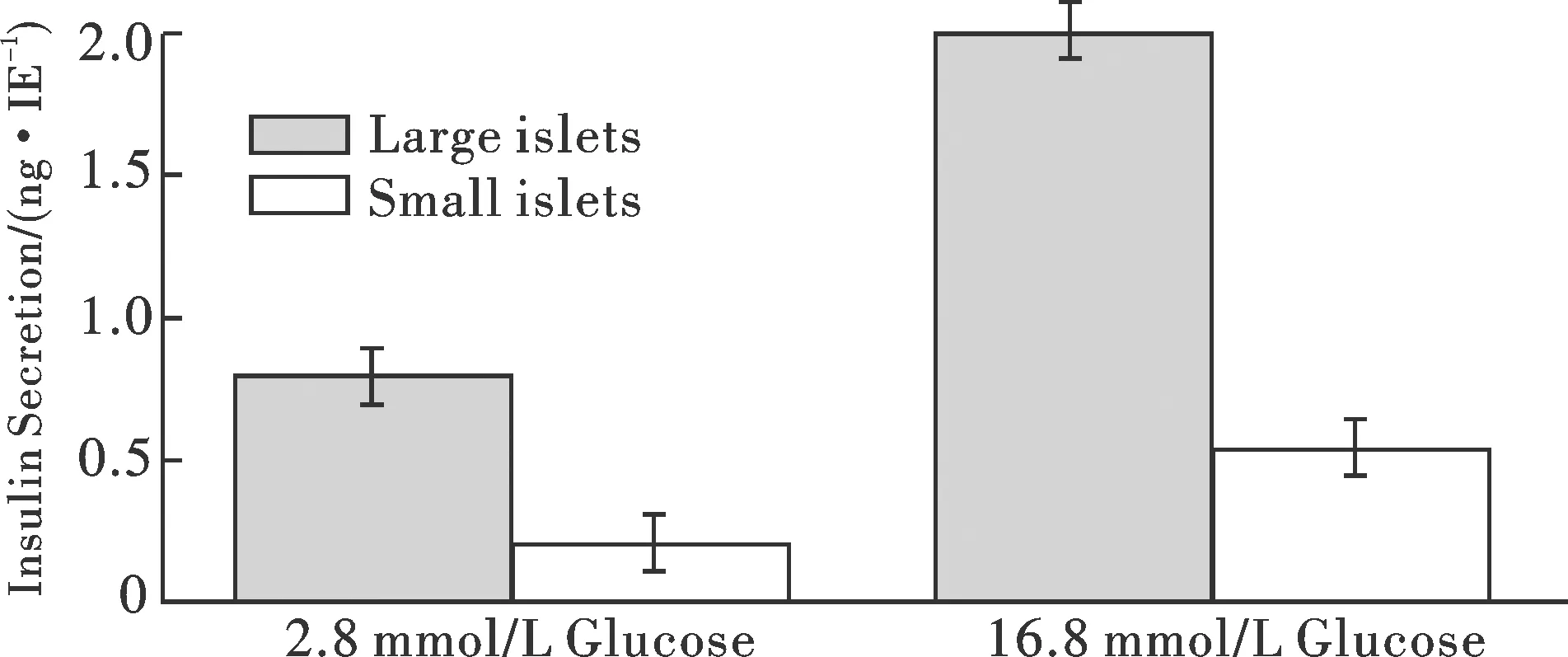
圖5 釋放胰島素濃度Fig.5 The release of insulin
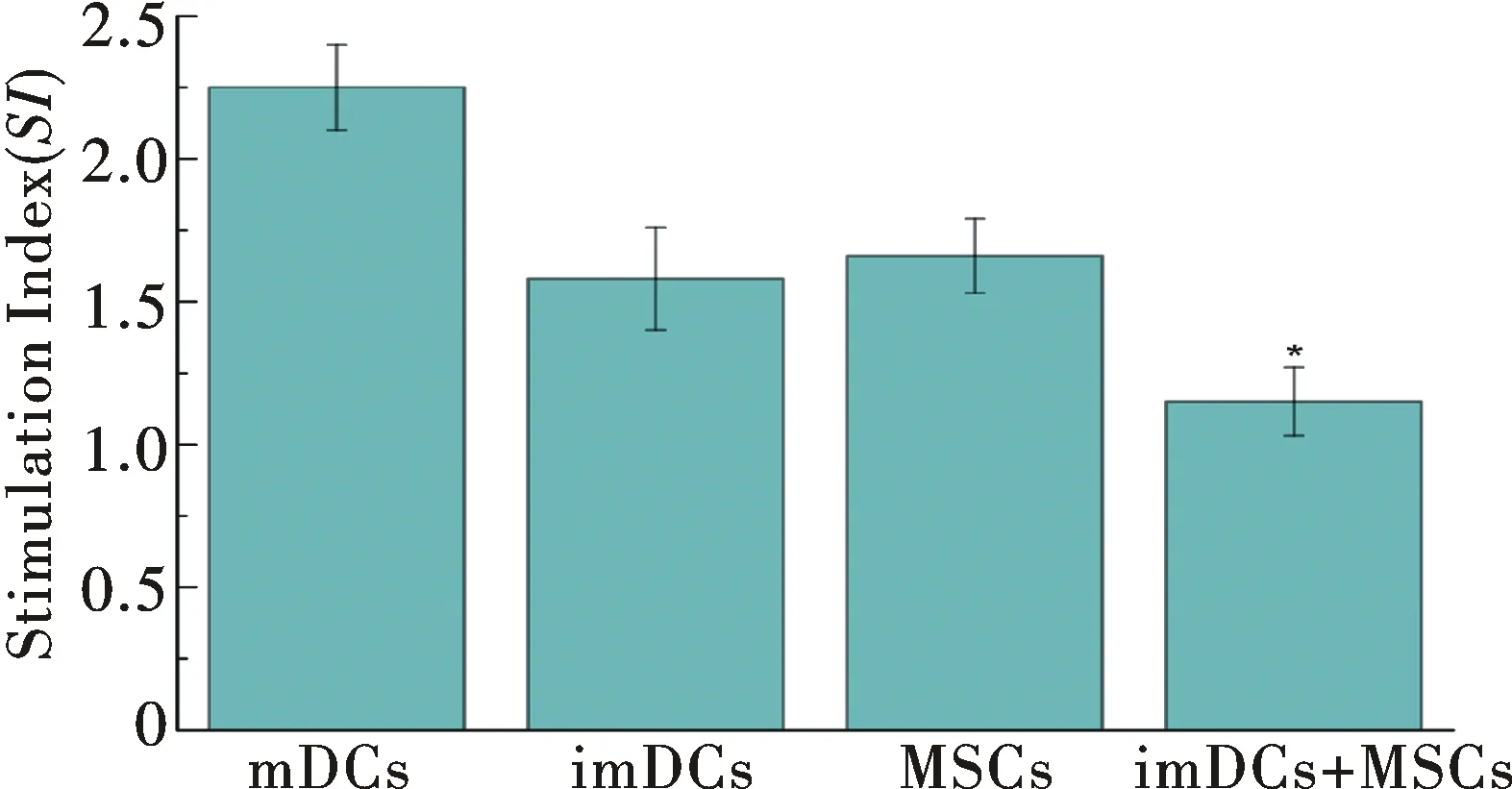
圖6 MTT檢測imDCs與MSCs對MLR體系中T淋巴細胞活化刺激(*P<0.05)Fig.6 The activation of T cells stimulated by imDCs or MSCs was determined by the MTT assay(*P<0.05)
2.6 移植后血糖水平檢測
移植后各組小鼠血糖檢測結果如圖7所示,與對照組相比,僅200個胰島細胞移植后小鼠血糖很快降低,在較低水平維持5 d后開始升高,移植7 d后血糖水平高于11.1 mmol/L,且呈持續上升趨勢,10 d后血糖值高于16.7 mmol/L;200個胰島細胞與2×105個間充質干細胞共移植組中,移植后第三天小鼠血糖降至5.4±1.25 mmol/L,并維持在較低水平,直至移植14 d后,血糖值高于16.7 mmol/L,但其血糖維持在降低水平的時間相較于胰島移植組略長(8±2.31 d); 200個胰島同2×105個未成熟樹突細胞共同移植于糖尿病鼠可使糖尿病鼠血糖下降,并較長時間地維持血糖于較低水平(7±2.65 d),第11天血糖水平(12.48 mmol/L)低于胰島細胞和間充質干細胞移植的血糖水平(15.63 mmol/L),具有顯著差異(P﹤0.05),且從第8天起血糖水平整體低于間充質干細胞和胰島細胞移植組.200個胰島細胞與2×105個間充質干細胞、2×105個未成熟樹突細胞共同移植,可以更長時間地維持血糖處于較低水平(12.6±3.48 d),且從第7天開始其血糖水平均低于其他各組,綜上說明聯合移植可以延長移植物的存活時間.
2.7 移植后糖化血紅蛋白檢測
糖化血紅蛋白(HbA1c)是血液中紅細胞內的血紅蛋白與血糖結合的產物,血糖和血紅蛋白的結合生成糖化血紅蛋白是不可逆反應,并與血糖濃度成正比,檢測糖化血紅蛋白能更好地監控血糖的控制情況,本實驗運用ELISA法檢測血液中糖化血紅蛋白(HbA1c),結果如圖8所示,與對照組相比,各移植組在移植后12天內糖化血紅蛋白水平都控制良好,差別具有統計學意義(P<0.05),說明胰島移植能有效控制糖尿病小鼠血糖水平;但隨著時間的推移,小鼠HbA1c水平呈上升趨勢,血糖控制效果日益減低,移植后第16天的檢測結果顯示,B,C,D實驗組HbA1c均大于7%,第20天僅胰島移植組HbA1c為(8.1±0.56)%,血糖控制效果不理想;而D組移植后第16天((7.3±0.43)%,P<0.05)和第20天((7.0±0.43)%,P<0.05)的檢測結果表明,D組控制血糖效果較B,C組均好;E組自移植后16天糖化血紅蛋白一直控制在6.5%以下(P<0.01),且HbA1c值穩定,直至第20天,為(6.6±0.41)%,說明胰島細胞與間充質干細胞、未成熟樹突細胞聯合移植血糖控制效果較好,且明顯優于其他組.
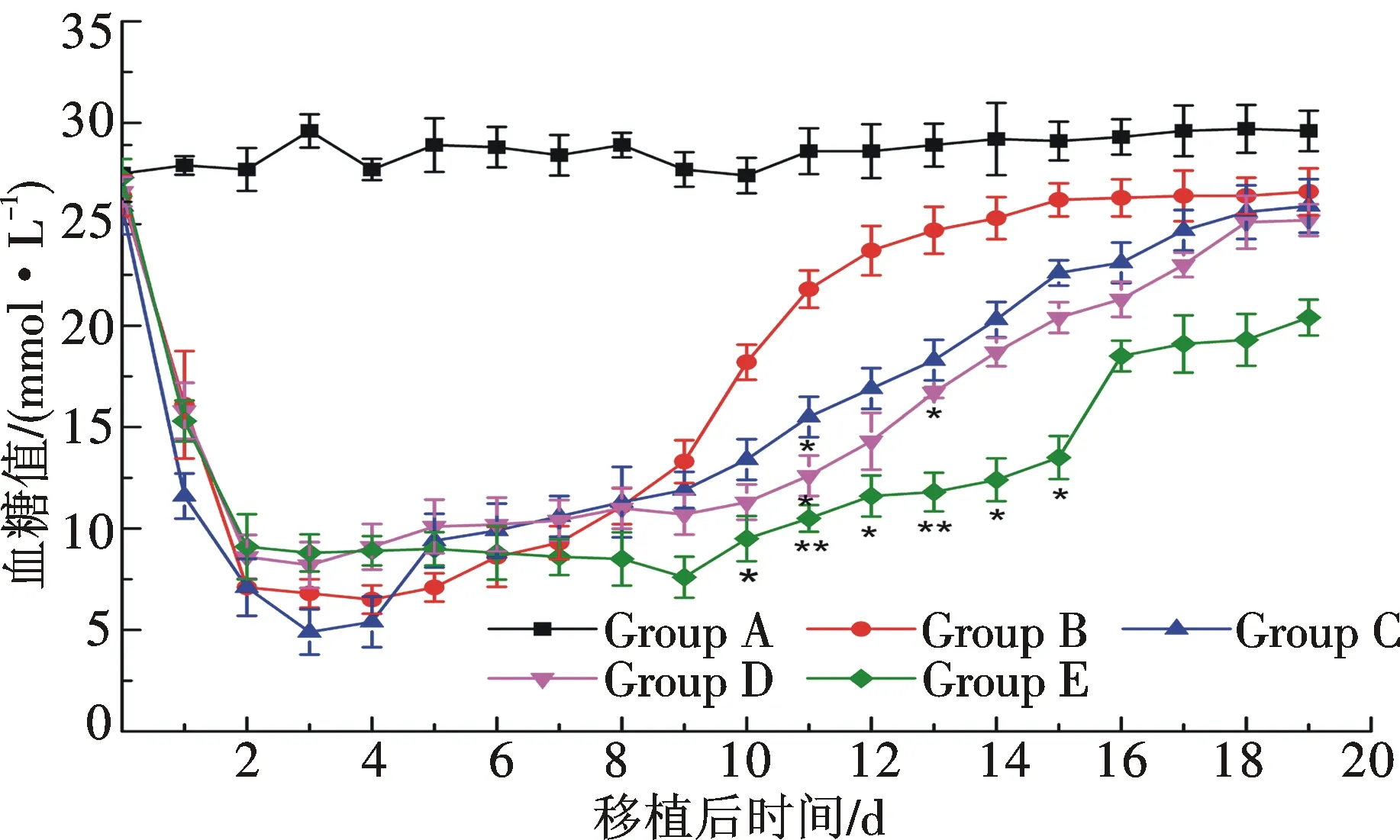
注:*P<0.05,**P<0.01圖7 糖尿病小鼠接受移植后的隨機血糖水平監測Fig.7 Random blood glucose monitoring after islets transplantation
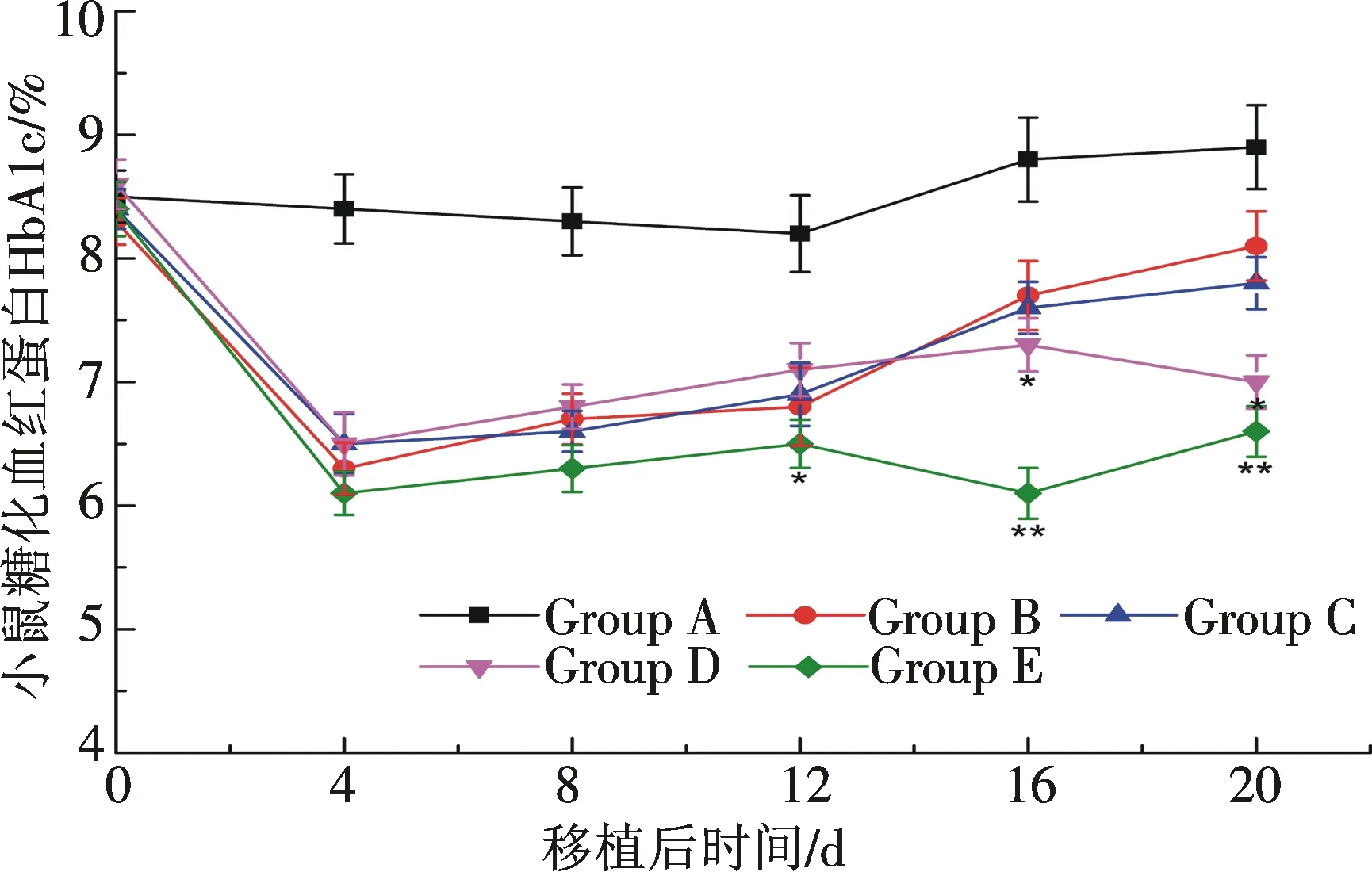
注:*P<0.05,**P<0.01圖8 糖尿病小鼠接受移植后的糖化血紅蛋白檢測Fig.8 The concentration of HbA1c monitoring after islets transplantation
3 討論
糖尿病模型鼠移植同種異體胰島細胞可以達到降低血糖的目的,但由于移植后的免疫排斥致使治療效果不能長久維持,移植不久血糖就會升高.樹突細胞因其在機體免疫耐受及免疫調節中諸多的特殊作用而受人們關注.其中,未成熟樹突細胞誘導免疫耐受能使移植器官在不使用免疫抑制劑的情況下長期存活被認為是一種防治移植排斥反應的有效方法[12-13].本文將胰島細胞與未成熟樹突細胞(imDCs)混合移植于糖尿病小鼠,發現移植物的存活時間明顯延長并維持血糖在較低水平,糖化血紅蛋白控制效果良好,證實了未成熟樹突細胞的免疫耐受功能,但在移植一段時間后,血糖水平升高并恢復高血糖狀態,移植物功能減退,其可能原因是未成熟樹突細胞體內刺激成熟,因此體內如何長期維持樹突細胞的未成熟或耐受狀態仍是一個難題.有研究發現移植間充質干細胞(MSC)可以降低I型及Ⅱ糖尿病的血糖值,并推測其降低血糖的機制可能是促進胰島細胞再生、免疫調節以及提高胰島的敏感性[14-15].許多研究證實,骨髓間充質干細胞(BMSCs)分泌的細胞因子EGF和HGF對β細胞的增加和凋亡至關重要,還分泌VEGF等促進移植物新生血管形成,增加細胞間的血管密度[16-18].Gao 發現移植的MSCs在糖尿病動物體內可以轉移到胰腺,促進β細胞再生和修復,在體內間充質干細胞可以使胰島細胞增加P-Akt和P-Erk的表達.在體外,胰島細胞和間充質干細胞共培養也可使P-Akt和P-Erk的表達量增加,而Akt和Erk又是β細胞增值的主要調節者[19].本文也證實胰島與骨髓來源的間充質干細胞(MSCs)混合移植可以延長移植物的存活時間并使血糖維持在較低的水平,但其具體的作用機制尚待深入研究,作者推測β細胞的再生可能是通過復制先前存在的β細胞或通過間充質干細胞(MSC)在胰腺細胞的組織再生.
研究報道間充質干細胞不僅可抑制單核細胞向樹突細胞的分化,抑制樹突細胞的成熟,還能產生多種具有免疫調節功能的細胞因子包括抑制未成熟樹突細胞成熟的細胞因子.如骨髓間充質干細胞分泌的TSG-6可抑制骨髓來源的樹突細胞成熟[20],分泌IL-6參與調控未成熟樹突細胞保持不成熟的細胞表型[21],此外,還分泌PGE2參與調控單核細胞分化成未成熟樹突細胞[22].間充質干細胞還可減少成熟樹突細胞表面標志物的表達,減少IL-12的產生,減少T細胞的激活[20].另有研究表明MSC-DC發揮抑制作用是通過細胞直接接觸作用而非通過分泌可溶因子[23],而PD-L1(programmed-death ligands 1)是表達于樹突細胞上的B7家族分子,可通過誘導T細胞表達其受體PD-1并與其結合引發下游反應而誘導T細胞分化或失能等,而且imDCs對T細胞活化的影響與imDCs上表達的PD-L1有關[24-25].本實驗利用混合淋巴細胞反應(MLR)及MTT檢測法分析體外imDCs與MSCs對同源異體T細胞刺激活化影響,發現imDCs與MSCs均能有效抑制T細胞增殖,而且imDCs與MSCs聯合對T細胞的抑制效果最為明顯, MSCs,imDCs,imDCs+MSCs聯合胰島移植治療糖尿病能夠有效維持血糖低水平的可能機制是這些細胞影響了T細胞的活化及增殖,而imDCs+MSCs更加強了對T細胞的抑制效果,而imDCs+MSCs與T細胞的抑制效果是否與PD-L1分子相關尚需進一步研究.
作者通過建立的高質量、高數量胰島細胞的分離系統,將骨髓間充質干細胞(BMSCs)、未成熟樹突細胞(imDCs)與胰島細胞一起移植于糖尿病小鼠,結果發現胰島移植物的存活時間相較于胰島細胞與imDCs或胰島細胞與MSCs混合移植均延長,且其降低血糖的效果顯著改善,糖化血紅蛋白控制效果最為理想,對胰島功能重建、血糖長期穩定控制以及免疫耐受均有一定借鑒意義.
[1] 范亞平,劉開甄.1型糖尿病的免疫耐受治療[J].國際內分泌代謝雜志,2011,31(5):337-339.
[2] 簡優強,周漢新,李富榮.免疫抑制或免疫耐受在胰島移植中的作用[J].中國免疫學雜志,2012,28(2):19-23.
[3] 蔡寒青.胰島移植治療糖尿病的臨床前研究[D].北京:中國協和醫科大學,2008.
[4] 傅藝凌.異種胰島移植中巨噬細胞免疫排斥及調節的研究[D].濟南:山東大學,2007.
[5] COURI C E.Stem cell transplantation for type 1 diabetes mellitus [J].Diabetol Metab Sypdr,2009,1(1):1-4.
[6] GAO X D,SONG L J,SHEN K T,etal.Bone marrow mesenchymal stem cells promote the repair of islets from diabetic mice through paracrine actions [J].Mol Cel Endocrinol,2014,388(1/2):41-50.
[7] OH S H,MUZZONIGRO T M,BAE S H,etal.Adult bone marrow-derived cells trans differentiating into insulin-producing cells for the treatment of type I diabetes [J].Lab Invest,2004,84(5):607-617.
[8] CHEN L B,JIANG X B,YANG L.Differentiation of rat marrow mesenchymal stem cells into pancreatic islet beta-cells [J].World J Gastroenterol,2004,10(20):3016-3020.
[9] SIMS E,EVANS-MOLINA C.Stem cells as a tool to improve outcomes of islet transplantation [J].J Transplant,2012,2012:736491.
[10] YAO V,PLATELL C,HALL J C.Dendritic cells [J].ANZ J Sung,2002,72(7):501-506.
[11] THOMSON A W,O’CONNELL P J,STEPTOE R J,etal.Immunobiology of liver dendritic cells [J].Immunol Cell Biol,2002,80(1):65-73.
[12] XIAO L,JOO KI,LIM M,etal.Dendritic cell-directed vaccination with a lentivector encoding PSCA for prostate cancer in mice [J].PLOS One,2012,7(11):e48866.
[13] LOTT D G,DAN O,LU L,etal.Decoy NF-kappa B fortified immature dendritic cells maintain laryngeal allograft integrity and provide enhancement of regulatory T cells [J].Laryngoscope,2010,120(1):44-52.
[14] FIGLIUZZI M,CORNOLTI R,PERICO N,etal.Bone marrow-drived mesenchymal stem cells improve islet function in diabetic rats [J].Transplant Proc,2009,41(5):1797-1800.
[15] 高 峰,李國良,林雨佳,等.骨髓間充質干細胞移植途徑對胰島移植物免疫排斥反應的影響[J].中國普通外科雜志,2012,9(12):1080-1085.
[16] SAKATA N,CHAN N K,CHRISLER J,etal.Bone marrow cell co-transplantation with islets improves their vascularization and function [J].Transplantion,2010,89(6):686-693.
[17] DING Y,XU D,FENG G,etal.Mesenchymal stem cells prevent the rejection of fully allogenic islet grafts by the immunosuppressive activity of matrix metalloproteinase-2 and -9 [J].Diabetes,2009,58(8):1797-1806.
[18] 周 華,王 默,金 星,等.間充質干細胞聯合肝細胞生長因子基因治療兔肢體缺血[J].中國普通外科雜志,2011,20(12):1342-1346.
[19] GAO X D,SONG L J,SHEN K T,etal.Bone marrow mensenchymal stem cells promote the repair of islets from diabetic mice though paracrine actions [J].Mol Cell Endocrinol,2014,388(1/2):41-50.
[20] LIU Y,YIN Z L,ZHANG R,etal.MSCs inhibit bone marrow-derived DC maturation and function through the release of TSG-6 [J].Biochem Biophys Res Commun,2014,450(4):1409-1415.
[21] DJOUAD F,CHARBONNIER L M,BOUFFI C.Mesenchymal stem cells inhibit the differentiation of dendritic cells through an interleukin-6-dependent mechanism [J].Stem Cells,2007,25(8):2025-2032.
[22] SPAGGIARI G M,ABDELRAZIK H,BECCHETTI F,etal.MSCs inhibit monocyte-derived DC maturation and function by selectively interfering with the generation of immature DCs:central role of MSC-derived prostaglandin E2 [J].Blood,2009,113(26):6576-6583.
[23] ZHANG B,LIU R,SHI D,etal.Mesenchymal stem cells induce mature dendritic cells into a novel Jagged-2-dependent regulatory dendritic cell population [J].Blood,2009,113(1):46-57.
[24] CHEN C,QU Q X,ZHANG X G,etal.Expression of programmed-death receptor ligands 1 and 2 may contribute to the poor stimulatory potential of murine immature dendritic cells [J].Immunobiology,2007,212(3):159-165.
[25] BROWN J A,DORFMAN D M,MA F R.Blockade of programmed death-1 ligands on dendritic cells enhances T cell activation and cytokine production [J].J Immunol,2003,170(3):1257-1266.
(編輯 WJ)
Co-Transplantation of Islets with Mesenchymal Stem Cells and Immature Dendritic Cells in the Treatment of Mouse Diabetes
WANGTing-ting1,WANGHong-can1,LUYu-rong2,YEDong-shuo2,YANGDeng-ke2,ZHANGGuang-tao3,ZHANGFang-ting3,LONGGuang-hui3,ZhangJian1,YANGYin-ke1*
(1.College of Biology,Hunan University,Changsha 410082,China; 2.Shenzhen BioScien Pharmaceutical Ltd.,Shenzhen 518000,China;3.Shenzhen Hospital,Peking University,Shenzhen 518000,China)
To establish an effective plan for immune tolerance of islets transplantation,immature dendritic cells (imDCs) were identified by flow cytometry (FCM).Mesenchymal stem cells (MSCs) were incubated to differentiate into osteoblasts and islets were identified with dithizone (DTZ) staining method.From the results of three co-transplantation groups,it was found that transplantation did not significantly prolong graft survival (7±2.65 d),but remarkedly decreased blood glucose and glycosylated hemoglobin concentration in the diabetes of mouse by co-transplantation of 200 islets and 2×105imDCs.Co-transplantation of 200 islets with 2×105MSCs could significantly decrease blood glucose level and prolong graft survival for 8±2.31 days.Transplantation of 200 islets with 2×105MSCs and 2×105imDCs could not only restore normal blood glucose level,but also significantly prolong graft survival for 12.6±3.48 days.This result indicates that co-transplantation of islets with imDCs or MSCs can promote graft survival and reverse blood glucose level,and at the meanwhile effectively control the glycosylated hemoglobin concentration as well,which is better than islets transplantation alone.
dendritic cell; mesenchymal stem cells; islets transplantation; diabetes; HbA1c
10.7612/j.issn.1000-2537.2017.01.007
2016-03-15
深圳科技創新委技術研究開發攻關項目(2012026154206)
* 通訊作者,E-mail:ykyang99@hnu.edu.cn
R392.4
A
1000-2537(2017)01-0044-07

