大豆蛋白-溶血磷脂O/W型復合乳液的乳化特性
李秋慧,王中江,李佳妮,隋曉楠,齊寶坤,江連洲,李 楊*
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
大豆蛋白-溶血磷脂O/W型復合乳液的乳化特性
李秋慧,王中江,李佳妮,隋曉楠,齊寶坤,江連洲,李 楊*
(東北農業大學食品學院,黑龍江 哈爾濱 150030)
針對大豆溶血磷脂添加量對大豆分離蛋白-溶血磷脂復合乳化體系乳化特性的影響進行探究。對復合乳化體系分別進行了界面蛋白吸附量、界面張力、乳化活性、乳化穩定性、粒徑分布、Zeta電位的測定,并采用光學顯微鏡對乳液中油滴分布及微觀結構變化進行觀察。結果表明:隨著溶血磷脂添加量的增加,乳化特性指標均基本呈現先升高后降低的趨勢。其中,當溶血磷脂添加量為10%時,乳液的乳化特性表現最佳,這表明添加適量溶血磷脂會促進其與大豆分離蛋白的相互作用,降低界面張力,在油-水界面上形成較穩定的界面膜,形成穩定的復合乳狀液。
大豆分離蛋白;溶血磷脂;乳化特性
大豆分離蛋白(soybean protein isolate,SPI)因其具有多種功能特性而在食品加工中得以廣泛應用,其中較為重要的功能就是乳化特性,食品加工過程中常常通過添加SPI提高產品的乳化穩定性等,然而單一的天然SPI由于其結構的限制以及其易變性等缺點使其不能很好地滿足食品工業對乳化劑的多重需求[1-2]。大豆溶血磷脂(lysophospholipids,LPC)是既具有普通磷脂的雙親兩性結構,又由于非極性基團的減少而增強了親水性能的一種純天然、高營養乳化劑。因此,LPC除了擁有普通磷脂的優良乳化特性以外,更在一定程度上改善了由于親水親油平衡(hydrophile lipophilic balance,HLB)值偏低導致普通磷脂應用范圍受限的狀況[3]。國內有研究表明由于磷脂及LPC結構中同時具有親水基團和親油基團,可以添加到蛋白當中增強食品的乳化活性及乳化穩定性[4-7]。同時,國外有研究表明磷脂經磷脂酶A2酶解后所產生的LPC可以與乳中蛋白通過疏水及靜電作用結合,使咖啡乳等乳狀液表現出更好的乳化特性,二者形成的復合體系更有利于維持乳液的乳化穩定性,延長貨架期[8-10]。但目前的研究對LPC與蛋白的添加比例及穩定性影響機理尚不明確,且在此問題上的研究仍較少。因此,本研究在前期研究基礎上采用磷脂酶A2自制LPC,再將一定量LPC與SPI共建復合乳化體系,通過對復合體系的界面蛋白含量、界面張力、乳化活性、乳化穩定性、流體動力學半徑、Zeta電位等乳化性質進行測定,同時通過光學顯微鏡對乳狀液的微觀結構進行觀察,解析LPC添加量對SPI乳狀液乳化特性的影響機理,為天然復合乳液的工業生產應用提供理論依據。
1 材料與方法
1.1 材料與試劑
脫脂豆粕 哈爾濱高科技股份有限公司;LPC東北農業大學食品學院糧油加工實驗室自制;磷脂酶A2(1 100 U/mL) 丹麥諾維信生物技術有限公司;十二烷基硫酸鈉(sodium dodecyl sulfate,SDS)、Tris-HCl美國Sigma公司;磷酸二氫鈉、磷酸氫二鈉、鹽酸、氫氧化鈉等化學試劑均為國產分析純。
1.2 儀器與設備
磁力攪拌器 廣州儀科實驗儀器有限公司;T18 basic高速乳化均質機 德國IKA公司;TU-1800紫外-可見分光光度計 北京普析通用儀器有限責任公司;ZetaPALS-Zeta電位儀 美國布魯克海文儀器公司;Mastersize 2000激光粒度分析儀 英國馬爾文公司;Allegra64R臺式高速冷凍離心機 美國貝克曼公司;IX71倒置顯微鏡 日本奧林巴斯公司。
1.3 方法
1.3.1 SPI的制備
參考Molina等[11]的方法并稍加修改,按照質量比1∶10將脫脂豆粕與水混合,加入濃度為2 mol/L NaOH溶液調節pH值至8.0,磁力攪拌1 h后在4 000×g室溫條件下離心30 min。去除殘渣取上清液,加入1 mol/L的HCl溶液調節pH值至4.5,攪拌1 h后室溫條件下靜置15 min。在6 000×g、室溫條件下離心30 min,取沉淀水洗3 次,最后將沉淀溶于水中加入1 mol/L NaOH溶液調節pH值至7,再次在6 000×g室溫條件下離心30 min濾去不溶物,得蛋白質溶液,將蛋白質溶液進行冷凍干燥得SPI粉末,經凱式定氮儀測得蛋白含量為90.08%(氮溶解指數按照6.25計算)。
1.3.2 LPC的制備
參考潘麗等[12]的方法并稍加修改,準確稱取75 mg大豆粉末磷脂于250 mL錐形瓶中,加入75 mL、pH 7.2的Tris-HCl緩沖溶液,然后加入磷脂酶A2(V(酶)∶V(磷脂)=1∶20),再加入質量分數0.1% CaCl2溶液,將其密封后置于水浴恒溫振蕩器中,30 ℃酶解反應8 h,反應完成后,90 ℃條件下滅酶30 min。然后加入冷丙酮,用玻璃棒攪拌脫脂后離心濾去上層清液,如此進行反復脫脂,將樣品進行抽真空脫溶,溶液快速揮干即得LPC。
1.3.3 SPI-LPC乳狀液的制備
參考李楊等[5]的方法,精確稱取100 mg SPI,分別加入質量分數為0%、5%、10%、15%、20%的LPC樣品,溶解于30 mL濃度為0.1 mol/L pH 7.2的磷酸鹽緩沖溶液中,在1 000 r/min、室溫條件下攪拌溶液1 h。取9 mL攪拌均勻的SPI-LPC復合體系與3 mL葵花籽油混合攪拌,預乳化后倒入25 mL燒杯中,用高速乳化均質機在20 000 r/min條件下乳化1 min,制備乳液及空白對照樣品。其中樣品分別為 SPI、SPI-5 mg LPC乳液(SPI-5LPC)、SPI-10 mg LPC乳液(SPI-10LPC)、SPI-15 mg LPC乳液(SPI-15LPC)、SPI-20 mg LPC乳液(SPI-20LPC)。
1.3.4 界面蛋白吸附量的測定
參考Palazolo等[13]的測定方法。乳液在室溫條件下10 000×g離心30 min,用注射器將清液取出,測定清液中的蛋白質量濃度。乳液界面蛋白吸附量計算見公式(1):
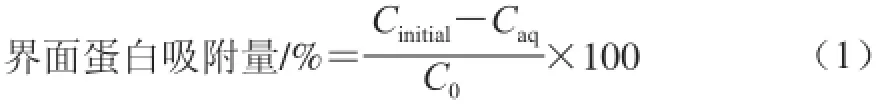
式中:Cinitial和Caq分別是蛋白溶液質量濃度和乳液離心后清液中的蛋白質量濃度/(mg/mL);C0是蛋白溶液經相同條件離心后(10 000×g,30 min)上清液中的蛋白質量濃度/(mg/mL)。每個樣品重復3 次測定。
1.3.5 油-水界面張力的測定
油-水界面張力的測定參考Romero等[14]的方法。精確稱取SPI和LPC各90 mg,溶于9 mL的0.1 mol/L磷酸鈉緩沖液中,室溫條件下攪拌溶液(1 000 r/min,1 h),用注射器將溶液注射到樣品管中,在通過細長針頭吸取葵花籽油,將油樣注入到樣品管中,使用TVT1旋轉滴界面張力儀測定,測定溫度20 ℃。
1.3.6 乳液活性及乳化穩定性的測定
參考Comas等[15]的方法。將均質的乳狀液用0.1%的SDS溶液稀釋到確定倍數,在500 nm波長處用紫外分光光度計測定吸光度,計算乳化活性指數(emulsifying activity index,EAI)。靜置30 min后測定吸光度,計算乳化穩定性指數(emulsion stability index,ESI)。EAI、ESI計算見公式(2)、(3):
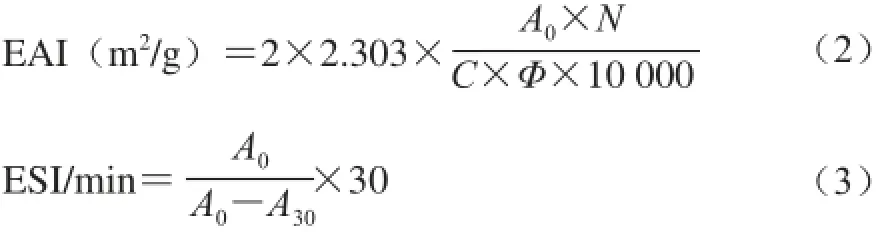
式中:N為稀釋倍數(250);C為乳化液形成前蛋白質水溶液中蛋白質質量濃度/(g/mL);Φ為乳化液中油相體積分數;A0為0 min時的吸光度;A30為30 min時的吸光度。
1.3.7 流體動力學半徑及其分布的測定
參考王金梅等[16]的測定方法。采用動態光散射技術,利用Mastersize 2000激光粒度分析儀測定新鮮制備的乳狀液的流體動力學半徑及其分布,測定溫度25 ℃。參數設置為:顆粒折射率1.520,顆粒吸收率0.001,分散劑為水,分散劑折射率1.330。實驗采用D4,3,即體積平均直徑表征液滴粒度的大小,樣品均質后立即測定,每個樣品重復3 次。
1.3.8 Zeta電位的測定
參考Crudden[17]的方法,采用Zeta電位分析儀測定,乳液質量濃度為0.1 mg/mL,上樣體積1 mL,測定溫度25 ℃。重復測量6 次,計算平均值為測定值。
1.3.9 光學顯微鏡觀察
乳液制備后,取一滴新鮮乳液樣品放置于顯微鏡載物臺上,用載玻片固定,用100 倍光學顯微鏡觀察,用電荷耦合元件圖像傳感器獲取照片,照片從連接到電腦的數字圖像處理軟件中獲得。
1.4 數據統計分析
每個實驗均重復3 次,采用ANOVA進行誤差分析,并用Origin 8.5軟件統計分析數據并作圖。
2 結果與分析
2.1 LPC對界面蛋白吸附量的影響

圖1 LPCLPC添加量對界面蛋白吸附量的影響Fig.1 Effect of lysophospholipid addition on the interfacial adsorption of protein
界面蛋白吸附量表示界面吸附蛋白的覆蓋率,它是界面性質的一個重要指標[18]。有研究表明,LPC乳化活性大小與界面上乳化劑的吸附量有一定關聯[19]。由圖1可知,隨著LPC添加量的增加,體系中界面蛋白質吸附量呈現先增大后減少的趨勢,其中SPI-10LPC體系中界面蛋白吸附量最多。Li Jufang等[20]在研究大豆蛋白與磷脂相互作用時指出,磷脂與蛋白的相互作用可能是將蛋白結合到磷脂分子形成的膠束或囊泡中去,或者是磷脂中的磷脂酰膽堿形成的片層結構與SPI表面疏水區域結合形成蛋白-磷脂復合物,還有可能是磷脂取代界面上部分蛋白質形成磷脂和蛋白的混合界面層。由此結果結合分析可知,由于大豆蛋白會與LPC發生疏水相互作用,作用力的存在會使大豆蛋白更易吸附在油-水界面上,但由于LPC與大豆蛋白之間具有一定的結合常數,當更多LPC加入,LPC會部分替代界面上大豆蛋白的位置,導致界面蛋白含量的降低。
2.2 LPC對界面張力的影響
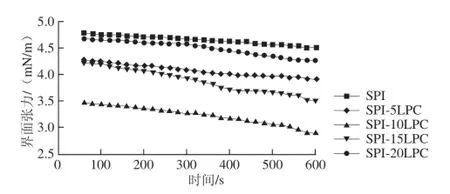
圖2 LPC對界面張力的影響Fig.2 Effect of lysophospholipid addition on interfacial tension
水油相間的界面張力通常在30~35 mN/m之間,這種高界面張力導致水油兩相不相容使乳狀液的穩定性較差,通常通過添加乳化劑來降低界面張力使乳化體系易于自發進行[21]。界面張力是研究乳狀液性質的重要基礎數據,本實驗采用的旋轉液滴法是用于測量兩種完全不互溶液體的界面張力隨時間的變化,廣泛應用于低界面張力的測定。
由圖2可知,5 種乳化體系中油-水界面的界面張力在一定時間范圍內均有所降低,乳液的界面張力穩定值相差不大,平衡值在3~5 mN/m之間。SPI-10LPC體系在同一時刻界面張力低于SPI-15LPC和SPI-5LPC體系;而SPI-15LPC和SPI-5LPC體系明顯低于SPI和SPI-20LPC體系的界面張力。由此可知,LPC的加入可以降低SPI乳狀液的界面張力,但加入量過多時反而會使界面張力有所上升。
造成上述結果可能是由于SPI-LPC的交互作用會降低界面的吸附能,吸引更多分子在界面上。在SPI-LPC復合乳化體系中,蛋白質分子比LPC分子優先吸附到界面上,蛋白質和LPC分子先后吸附到界面上,界面張力降低,直到界面張力達到平衡值[22]。有研究表明蛋白-磷脂復合體系降低界面張力的能力與表面疏水性相關,疏水性的提高會增強界面的活性,進而使乳化劑更易吸附在油-水界面,能更好地降低界面張力[23]。然而由于LPC較磷脂相比疏水基團減少,過多的LPC會替代界面上的蛋白導致界面吸附能力下降。這可能是造成SPI-15LPC和SPI-20LPC體系界面張力較高的主要原因。

圖3 LPC對復合體系乳化活性及乳化穩定性的影響Fig.3 Effect of lysophospholipid addition on emulsifying activity and emulsion stability
2.3 LPC對復合體系乳化活性及乳化穩定性的影響乳化活性及乳化穩定性是表征乳狀液乳化特性及穩定狀態的重要指標。乳化體系的乳化活性及乳化穩定性與界面蛋白吸附量和界面張力有關,界面張力越低乳化劑的乳化性能越高[24]。在本研究中,由圖2和圖3對比可知界面張力平衡值與乳化活性呈負相關性。隨著LPC的量的增加,乳化活性及穩定性指數先上升后下降,該趨勢與界面蛋白吸附量的趨勢相一致。其中,SPI-10LPC乳化體系具有最好EAI及ESI,分別為37.6 m2/g和76 min,與SPI乳化體系相比分別提高25.3%和26.6%。其他3 種樣品的乳化活性及穩定性較SPI組有所提高,但不如
SPI-10LPC組提高顯著。由此可知,LPC添加量的不同對乳狀液的乳化特性及乳化穩定性有一定的影響。這是由于LPC疏水基團的減少,親水性增強,其通過與SPI的相互作用形成SPI-LPC復合體系,構成雙親性結構,使疏水性蛋白區域更好地包裹油滴,親水性的磷脂頭部更好地伸入水相當中,降低水油間的界面張力,使其乳化特性有所提高[25]。當LPC添加過多時,LPC會替代界面上的部分蛋白,導致體系界面蛋白含量下降,界面張力上升,界面膜無法完全包裹油滴,使得乳狀液乳化活性及穩定性反而有所下降[26]。
2.4 LPC對復合體系流體動力學粒徑分布的影響

圖4 LPC添加量對復合體系流體動力學粒徑分布的影響Fig.4 Effect of lysophospholipid addition on particle size distribution of emulsion systems

圖5 LPC對復合體系D44,,33的影響Fig.5 Effect of lysophospholipid addition on D4,3of emulsion systems
流體動力學粒徑分布是能更好地評價乳化性的重要指標,本實驗中采用動態光散射技術探究不同LPC添加量對SPI-LPC復合乳化體系的液滴分布情況及平均粒徑的大小的影響。一般地,乳液中分散越均勻,油滴的體積平均粒徑越小,表示乳液的乳化特性越好[27]。由圖4可知,SPI體系大致為單峰分布,出現在60~80 μm處,對于實驗中的其他4 種乳液,在LPC添加量分別為5%、10%、15%的乳液樣品中粒徑分布的峰值較SPI樣品均有向較小粒徑方向移動的趨勢,但當LPC添加量達到20%時,出現了顯著的峰形變化,雙峰分別出現在10~20 μm和100~150 μm,且峰值與SPI樣品相比出現了向較大粒徑方向移動現象,即在一定范圍內,磷脂質量分數越大,乳液油滴粒徑在較小的粒徑范圍內分布,但質量分數過高會產生不利影響。
相應地,乳液油滴的D4,3也在一定質量分數下隨LPC質量分數的增大呈現先減小后增大的趨勢,對于SPI-5LPC、SPI-10LPC和SPI-15LPC乳化體系來說,乳液的體積平均粒徑均顯著小于未添加磷脂的大豆蛋白乳液,且三者的粒徑分布趨勢較為相似。這說明,在一定質量分數范圍條件下,LPC的加入會與蛋白結合,降低界面張力,最終形成較小的油滴粒徑,起到維持乳液穩定的作用[28]。但對于SPI-20LPC乳化體系來說,20% LPC的加入并沒有進一步降低乳液粒徑的大小,反而使粒徑分布出現不均勻、粒徑變大的趨勢。這說明,質量分數過高的LPC會黏連或聚集在蛋白質外不能很好地結合,進而使乳液液滴粒徑增大,且粒徑變大的原因主要是由于大于100 μm的粒子引起的,這也是造成SPI-20LPC乳液穩定性下降的原因。
上述結果證明適量LPC的加入會使蛋白與其較好地結合,使蛋白與LPC間通過相互作用力結合,穩定了水、油界面的平衡,有助于提高蛋白的乳化能力和穩定性[12]。
2.5 LPC對復合體系Zeta電位的影響
有研究表明乳液絮凝主要受界面層上發生的吸引和排斥作用影響,增強液滴間的靜電作用可以提高乳液抗絮凝能力,液滴Zeta電位絕對值越大乳液穩定性越好[13]。一般情況下,蛋白質表面帶正電荷的氨基酸多于帶負電荷氨基酸,其蛋白質溶液Zeta電位為正值[29]。本實驗采用Zeta電位儀對不同LPC添加量條件下的SPI-LPC復合乳化體系的Zeta電位進行測定,由圖6可知,LPC的加入使乳液液滴的Zeta電位值由正電位變為負電位,且隨著LPC添加量的增加,電荷量不斷增大,之后基本保持不變。說明添加磷脂后能增加乳狀液的負Zeta電位,使乳液液滴之間的斥力增大,從而提高乳液的穩定性。LPC能改變乳液的負Zeta電位,可能是由于與大豆蛋白發生疏水相互作用,使蛋白結構改變,更多的帶負電荷氨基酸暴露出來,從而引起Zeta電位的改變,使復合乳化體系更多的帶負電。而對于SPI-20LPC樣品,雖然Zeta電位負電位的絕對值較大,但由于液滴的粒徑分布不均且粒徑較大,液滴與液滴之間的斥力難以抵抗液滴的重力作用,因此乳液的穩定性下降。

圖6 LPC添加量對復合體系Zeta電位的影響Fig.6 Effect of lysophospholipid addition on zeta potential of emulsion systems
2.6 乳液微觀結構

圖7 LPC添加量對復合乳液微觀結構的影響Fig.7 Effect of lysophospholipid addition on microstructure of emulsion systems
乳液微觀結構的觀察是最為直觀的表征乳液穩定性的方法。本實驗采用倒置光學顯微鏡對5 種乳液樣品進行觀察。由圖7可知,SPI和SPI-20LPC乳化體系中乳滴分布較為不均,且乳滴大小不均一,有少量乳滴發生輕微聚集現象,這可能與乳液中乳滴較大、促進了絮凝現象的產生有關。而SPI-5LPC、SPI-10LPC以及SPI-15LPC乳液液滴大小較為均一,分布較為一致,乳液乳化穩定性較強,與之前乳化穩定性測定結果相似,但3 種樣品間區別并不十分明顯。乳滴微觀結構的實驗結果與粒徑分布趨勢相一致。
3 結 論
在SPI中加入一定比例的LPC可以改善乳液的乳化活性及乳化穩定性,促使乳液液滴粒徑分布更均勻。
在LPC添加量為10%條件下制備的相關乳液具有最多的界面蛋白含量、最低的界面張力以及最高的乳化穩定性。然而,當LPC質量分數增加至20%時,相關乳液的穩定性變差。這是由于界面上蛋白吸附含量減少、相互作用減弱、粒徑較大、分布不均造成的。
LPC的復合及添加比例對SPI乳狀液會產生一定的影響。適量添加LPC會明顯改善SPI乳狀液的乳化性質,這將為現今食品工業中蛋白的生產以及乳狀液的制備提供參考。
[1] 張根生, 岳曉霞, 李繼光, 等. 大豆分離蛋白乳化性影響因素的研究[J]. 食品科學, 2006, 27(7): 48-50. DOI:10.3321/ j.issn:1002-6630.2006.07.005.
[2] 李玉珍, 肖懷秋, 蘭立新. 大豆分離蛋白功能特性及其在食品工業中的應用[J]. 中國食品添加劑, 2008, 18(1): 121-124. DOI:10.3969/ j.issn.1006-2513.2008.01.027.
[3] 劉曄, 劉靂, 陳亮. 高穩定性磷脂的酶催化合成及應用[J]. 日用化學品科學, 2000(增刊): 196-199.
[4] 李菊芳, 呂瑩, 徐婧婷, 等. 磷脂-大豆分離蛋白復合物溶液理化與流變特性[J]. 農業機械學報, 2013, 44(8): 207-212. DOI:10.6041/ j.issn.1000-1298.2013.08.035.
[5] 李楊, 李秋慧, 王海晴, 等. 大豆蛋白-磷脂酶解物共建乳化體系性質研究[J]. 中國食品學報, 2015, 15(11): 41-47. DOI:10.16429/j.1009-7848.2015.11.007.
[6] 王迎新, 遲玉杰. 磷脂酶修飾提高蛋黃磷脂乳化性及穩定性的研究[J].中國糧油學報, 2009, 24(10): 107-111.
[7] 潘麗, 谷克仁, 常振剛. 溶血磷脂乳化穩定性研究[J]. 糧食與油脂, 2007, 20(3): 23-25. DOI:10.3969/j.issn.1008-9578.2007.03.008.
[8] CABEZAS D M, MADOERY R, DIEHL B W K, et al. Emulsifying properties of different modif i ed sunf l ower lecithins[J]. Journal of the American Oil Chemists’ Society, 2012, 89(2): 355-361. DOI:10.1007/ s11746-011-1915-8.
[9] KASINOS M, GONI M L, NGUYEN M T, et al. Effect of hydrolysed sunflower lecithin on the heat-induced coagulation of recombined concentrated milk emulsions[J]. International Dairy Journal, 2014, 38(2): 187-194. DOI:10.1016/j.idairyj.2013.12.001.
[10] van der MEEREN P, El-BAKRY M, NEIRYNCK N, et al. Inf l uence of hydrolysed lecithin addition on protein adsorption and heat stability of a sterilised coffee cream simulant[J]. International Dairy Journal, 2005, 15(12): 1235-1243. DOI:10.1016/j.idairyj.2013.12.001.
[11] MOLINA O S E, PUPPO M C, WAGNER J R. Relationship between structural changes and functional properties of soy protein isolatescarrageenan systems[J]. Food Hydrocolloids, 2004, 18(6): 1045-1053. DOI:10.1016/j.foodhyd.2004.04.011.
[12] 潘麗, 谷克仁, 武曉. 酶法制備溶血磷脂的研究[J]. 食品科技, 2007, 32(5): 276-280. DOI:10.3969/j.issn.1005-9989.2007.05.083.
[13] PALAZOLO G G, SOBRAL P A, WAGNER J R. Freeze-thaw stability of oil-in-water emulsions prepared with native and thermally-denatured soybean isolates[J]. Food Hydrocolloids, 2011, 25(3): 398-409. DOI:10.1016/j.foodhyd.2010.07.008.
[14] ROMERO A, BEAUMAL V. Interfacial and emulsifying behaviour of crayf i sh protein isolate[J]. LWT-Food Science and Technology, 2011, 44(7): 1603-1610. DOI:10.1016/j.lwt.2011.03.005.
[15] COMAS D I, WAGNER J R, TOMAS M C. Creaming stability of oil in water (O/W) emulsions: inf l uence of pH on soybean protein-lecithin interaction[J]. Food Hydrocolloid, 2006, 20(7): 990-996. DOI:10.1016/ j.foodhyd.2005.11.006.
[16] 王金梅. 大豆蛋白熱聚集行為及界面、乳化性質研究[D]. 廣州: 華南理工大學, 2012: 59-63.
[17] CRUDDEN A. Effect of hydrolysis of casein by plasmin on the heat stability of milk[J]. International Dairy Journal, 2005, 15(10): 1017-1025. DOI:10.1016/j.idairyj.2004.11.001.
[18] 邵云. 大豆蛋白穩定乳液的物化性質及油脂氧化穩定性研究[D]. 廣州: 華南理工大學, 2014: 14-23.
[19] PUPPO M C, BEAUMAL V, SPERONI F, et al. β-Conglycinin and glycinin soybean protein emulsions treated by combined temperaturehigh-pressure treatment[J]. Food Hydrocolloids, 2011, 25(3): 389-397. DOI:10.1016/j.foodhyd.2010.07.005.
[20] LI J F, LI Y T, GUO S T. Exploring the binding mechanism of lecithin to soybean 11S and 7S globulin by fl uorescence spectroscopy[J]. Food Science and Biotechnology, 2014, 23(6): 1785-1791. DOI:10.1007/ s10068-014-0244-8.
[21] SUN H H, SUNDARAM G. Effects of protein concentration and oilphase volume fraction on the stability and rheology of menhaden oilin-water emulsions stabilized by whey protein isolate with xanthan gum[J]. Food Hydrocolloids, 2009, 23(1): 165-174. DOI:10.1016/ j.foodhyd.2007.12.006.
[22] MEZDOUR S, LEPINE A. Oil/water surface rheological properties of hydroxypropyl cellulose (HPC) alone and mixed with lecithin:contribution to emulsion stability[J]. Colloids and Surfaces A Physicochemical and Engineering Aspects, 2008, 331(1/2): 76-83. DOI:10.1016/j.colsurfa.2008.07.023.
[23] CROGUENNEC T, RENAULT A, BEAUFILS S, et al. Interfacial properties of heat-treated ovalbumin[J]. Journal of Colloid Interface Science, 2007, 315(2): 627-636. DOI:10.1016/j.jcis.2007.07.041.
[24] YE A. Interfacial composition and stability of emulsions made with mixtures of commercial sodium caseinate and whey protein concentrate[J]. Food Chemistry, 2008, 110(4): 946-952 DOI:10.1016/ j.foodchem.2008.02.091.
[25] SCURIATTI M P, TOMAS M C, WAGNER J R. Inf l uence of soybean protein isolates-phosphatidycholine interaction on the stability on oilin-water emulsions[J]. Journal of the American Oil Chemists’ Society, 2003, 20(11): 1093-1100. DOI:10.1007/s11746-003-0825-7.
[26] PATINO J. Interfacial and foaming characteristic of protein-lipid systems[J]. Food Hydrocolloids, 1997, 11(1): 49-58. DOI:10.1016/ S0268-005X(97)80010-0.
[27] RELKIN P, SOURDET S. Factors affecting fat droplet aggregation in whipped frozen protein-stabilized emulsions[J]. Food Hydrocolloids, 2005, 19(3): 503-511. DOI:10.1016/j.foodhyd.2004.10.015.
[28] BRYGIDA E. Properties of milk protein concentrate stabilized oil-inwater emulsions[J]. Journal of Food Engineering, 2008, 88(4): 507-513. DOI:10.1016/j.jfoodeng.2008.03.010.
[29] SHEN L, TANG C H. Microfluidization as a potential technique to modify surface properties of soy protein isolate[J]. Food Research International, 2012, 48(1): 108-118 DOI:10.1016/ j.foodres.2012.03.006.
Emulsifying Properties of Soybean Protein Isolate-Lysophosphatide Oil-in-Water (O/W) Emulsion
LI Qiuhui, WANG Zhongjiang, LI Jiani, SUI Xiaonan, QI Baokun, JIANG Lianzhou, LI Yang*
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
The effect of the amount of added lysophospholipids on emulsifying properties of soy protein isolate (SPI)-lysophospholipid emulsion system was explored by determining the interfacial protein adsorption, interfacial tension, emulsifying activity, emulsion stability, particle size distribution, and zeta potential and by observing the microstructure and distribution of emulsion droplets under optical microscopy. The results showed that with increasing addition of lysophospholipids, the emulsifying characteristics were increased at first and then decreased. Among five samples, the emulsion with 10% lysophospholipids added presented the best emulsifying properties, suggesting that the proper addition of lysophospholipids could promote the interaction between soybean protein isolate and lysophospholipids, thereby reducing the interfacial tension, forming a stable interfacial fi lm at the water-oil interface, and fi nally forming a stable emulsion.
soybean protein isolate; lysophospholipids; emulsifying properties
10.7506/spkx1002-6630-201703004
TS214. 2
A
1002-6630(2017)03-0020-06
李秋慧, 王中江, 李佳妮, 等. 大豆蛋白-溶血磷脂O/W型復合乳液的乳化特性[J]. 食品科學, 2017, 38(3): 20-25. DOI:10.7506/spkx1002-6630-201703004. http://www.spkx.net.cn
LI Qiuhui, WANG Zhongjiang, LI Jiani, et al. Emulsifying properties of soybean protein isolate-lysophosphatide oil-inwater (O/W) emulsion[J]. Food Science, 2017, 38(3): 20-25. (in Chinese with English abstract)
10.7506/spkx1002-6630-201703004. http://www.spkx.net.cn
2016-03-11
“十二五”國家科技支撐計劃項目(2014BAD22B00);黑龍江省自然科學基金重點項目(ZD201302);高等學校博士生學科點專項科研基金博導類資助項目(20132325110013);國家自然科學基金面上項目(31571876)
李秋慧(1991—),女,碩士研究生,研究方向為糧食、油脂及植物蛋白工程。E-mail:cherish_lqh620@163.com
*通信作者:李楊(1981—),男,副教授,博士,研究方向為糧食、油脂及植物蛋白工程。E-mail:liyanghuangyu@163.com

