干擾素與腫瘤相關性研究進展
2017-03-07 15:45:28陳詩軍綜述陳余清審校
臨床肺科雜志
2017年4期
關鍵詞:研究
陳詩軍 綜述 陳余清 審校
干擾素與腫瘤相關性研究進展
陳詩軍 綜述 陳余清 審校
干擾素的結構與功能
根據干擾素蛋白質結構和來源的不同,干擾素(interferon,IFN)可分為I型(IFN-α和IFN-β)、Ⅱ型(IFN-γ)和Ⅲ型(IFN-λ)。高度的同源性和明顯的種族特異性是IFN-α的特點[1],其大約含有165個氨基酸殘基,無糖基,分子量約為19kD,主要來源于B淋巴細胞及部分巨噬細胞。IFN-β分子與IFN-α大小相似,約含有166個氨基酸,有糖基,分子量約為23kD,主要由成纖維細胞和上皮細胞產生,部分巨噬細胞也可以產生。 IFN-γ是一個含有六螺旋的α螺旋蛋白,主要由抗原刺激T細胞產生,參與誘導組織相容性抗原(MHC)的表達和免疫調節效應。 IFN-λ的主要結構特征是由A-F6個螺旋環連接組成一個標準的四螺旋束, 其構成IFN-λ的核心結構,主要來源于漿細胞樣樹突細胞(pDC)[2]。以上三種類型的干擾素具有相似的功能,即抗腫瘤、抗病毒疾病、增強機體免疫等能力[3],其可以通過與細胞膜上特異性受體結合,誘導機體或細胞分泌各種活性因子和酶類,從而間接發揮作用 。這些物質能夠促進機體細胞和體液免疫對多種病毒抗原的應答,從而抑制病毒的增殖和活性;能夠抑制腫瘤細胞周期的轉化以及激活干擾素調節因子等,并可以改變腫瘤細胞表面的某種性質,使其更加容易被機體免疫系統識別并清除;增強機體T、B細胞活性,有利于吞噬細胞發揮吞噬功能,增強機體的免疫應答能力。
干擾素與腫瘤
一、干擾素抑制腫瘤細胞增殖
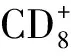
二、干擾素促進腫瘤細胞凋亡
登錄APP查看全文
猜你喜歡
體育科技文獻通報(2022年3期)2022-05-23 13:46:54
天津外國語大學學報(2021年3期)2021-08-13 08:32:18
遼金歷史與考古(2021年0期)2021-07-29 01:06:54
科技傳播(2019年22期)2020-01-14 03:06:54
遼金歷史與考古(2019年0期)2020-01-06 07:45:20
民用飛機設計與研究(2019年4期)2019-05-21 07:21:24
電子制作(2018年11期)2018-08-04 03:26:04
汽車工程學報(2017年2期)2017-07-05 08:13:02
國際商務財會(2017年8期)2017-06-21 06:14:14
電子制作(2017年23期)2017-02-02 07:17:19

