模擬生產工藝制作大腸桿菌苗課堂改革
任平 韓雙 張凱華
摘要:隨著高職教育課堂形式改革的不斷深入,理實一體化課堂形式已成為培養高職學生的主要運行模式。大腸桿菌疫苗的制作是《生物藥物制備技術課程》的主修內容,具有實踐性和應用性強的特點,為了使菌苗制作的工序過程更接近生產實際,讓學生“零距離”體驗生產崗位的操作標準,掌握操作過程的技能與技巧,經過多年來的探索和實踐,總結出模擬生產工藝制作大腸桿菌鋁膠滅活苗的一些經驗供相關學者參考。
關鍵詞:模似生產;流程;大腸桿菌
中圖分類號:G71 文獻標識碼:A
文章編號:1005-913X(2017)01-0143-02
大腸桿菌疫苗制作的課堂教學在內容設計上,由原來的零散實驗如:培養基的制作、菌種的培養、細菌的計數方法、鋁膠的配制、配苗和檢驗等,改為模擬大腸桿菌的生產工藝流程,按照生產崗位的操作標準,以生產上的工序過程,利用理實一體化課堂教學模式,完成大腸桿菌鋁膠滅活苗的制作和檢驗,全過程分基本知識介紹和基本技能操作兩部分。
一、基本知識介紹
讓學生課下復習大腸桿菌相關的理論知識,課堂上通過播放工業生產中大腸桿菌苗的視頻及課件了解大腸桿菌苗的整體制作過程;同時講清大腸桿菌每道工序操作的要點及注意事項。讓學生明晰在生產崗位所要從事的工作。
二、基本技能操作訓練
整個操作過程分6道工序完成。將學生分成6個小組,按工序的順序進行實施。完成每一道工序時,按生產上的操作標準(模擬生產要求)執行,同時按要求檢驗每道工序作品是否合格,合格后方可執行下一道工序。
(一)菌種的選擇與鑒定
可選用購買的大腸桿菌標準菌種或按常規制作血液瓊脂平板或營養瓊脂平板,分離培養含大腸桿菌的病料(死于大腸桿菌病的動物心血、腹水、肝滲出物、氣囊附著物或正常動物的腸道內容物),經伊紅美蘭瓊脂平板培養,挑選出黑色帶金屬光澤菌落;經靛基質試驗、甲基紅試驗,結果呈陽性,VP試驗,結果呈陰性;細菌經涂片、革蘭氏染色、顯微鏡檢查,結果呈中等大小革蘭氏陰性(紅色)的桿菌;經因子血清鑒定確定血清型后,可作為標準菌種使朋。菌種可保存在瓊脂斜面中(短期使用)或采用冷凍干燥法保存(長期使用),以免發生變異。
(二)種子培養及菌液的制備
取上述大腸桿菌菌種接種于伊紅美蘭瓊脂平板或麥康凱瓊脂平板上,置37℃溫箱中培養18~24 h,挑取單個典型菌落,移植于瓊脂斜面中作為種子。用滅菌吸管取5 mL馬丁肉湯加人大腸桿菌的瓊脂斜面中,用接種環刮取下菌體,研磨稀釋后倒入另一只滅菌試管中,置37%培養18~24h后,作為一級種子。將一級種子按10%的量再次接種馬丁肉湯中進一步擴大培養后,做為配苗菌液。取配苗菌液少量裝于滅菌試管中做菌數計數,其余菌液滅活待做配苗用(強毒細菌須在殺菌后,再行計數)。
(三)采用活菌計數法或比濁計數法對配苗菌液進行計數
活菌計數法可選用平板表面涂布法或傾注平板培養法。
1.活菌計數。活菌計數法是將待測菌液精確地作一系列稀釋,然后吸取一定量某稀釋度的菌液樣品,選用適當的方法進行培養。一個活的細菌經培養后,在平板培養基上大量繁殖可形成一個肉眼可見的菌落,從長出的菌落數及稀釋倍數,換算出每毫升待測菌液中的活菌數即細菌總數。
(1)平板表面涂布法
制備營養瓊脂平板。用商品化的營養瓊脂粉,按常規方法制作營養瓊脂平板8個,用前將營養瓊脂平板倒置在37℃溫箱中烘干1h,使其表面的水分蒸發。取出后將其分為4組,每組2個平板,第4組為對照組。
稀釋菌液。根據待測菌液中菌數含量的多少,在做培養之前,用普通肉湯或生理鹽水將被測菌液作10倍遞進稀釋即10-1、10-2、10-3、10-4……。稀釋方法為:取滅菌試管6~10支,分別標明稀釋倍數;每支試管中加入滅菌生理鹽水或肉湯9mL;另取滅菌吸管吸取待測菌液1mL,加入第1支試管中,充分混勻,稀釋倍數為10-1;從第1支試管中吸取稀釋菌液1mL加入到第2支試管中,充分混勻,稀釋倍數為10-2,如此一直稀釋到最后一支試管。
涂樣。另取三支滅菌吸管,分別吸取后三個稀釋度試管中的菌懸液0.1mL,對應加在3組營養瓊脂平板上,每一個稀釋度菌液接種2個平板,用滅菌L形玻璃棒將菌液涂勻。在平皿底作好與試管稀釋度相同的標記。第4組作對照,加稀釋液0.1mL。
培養。將上述各組的平板置37℃溫箱中培養1~2h,使菌液滲透于培養基內,然后倒置培養24h。
計數。從培養箱中取出培養皿,用肉眼觀察計算每個平板上的菌落數,必要時可用5-10倍放大鏡觀察,以免遺漏。一般選擇菌落數在30~300之間的平皿用以計數,每個稀釋度應取其菌落平均數,并求3個稀釋度之和再取其平均值,得出每毫升待測菌液所含的活菌數。按下式計算活菌數。
活菌數/mL=2個平板平均菌落數×10×稀釋倍數。舉例:在10-8稀釋的平板中所得平均菌落數為85個。計算結果:85×10×108=8.5×1010個活菌/mL
說明:對照組應無菌落生長,否則試驗結果不準確,應重做。
前一稀釋度的平均菌落數應大致為后一稀釋度平均菌落數的10倍左右,如差別太大,則說明試驗不準確,應重做。
(2)傾注平板培養法
待檢菌液稀釋方法同上。分別吸取后三個稀釋度試管中的菌懸液1mL加在滅菌平皿中,然后取預先融化且冷卻至50℃~55℃的營養瓊脂培養基分別傾入上述平皿中,立即搖勻平放,待其冷凝后,置37℃培養24h。統計平皿上長出的菌落數,乘以稀釋倍數,計算出三個稀釋度的平均數,即為每毫升待測菌液所含的活菌數。
2.比濁計數法
比濁計數法是通過對比待測菌液與標準比濁管的濁度,求出大致的細菌總數。標準比濁管由國家生物制品檢定部門提供,每套包括一支細菌比濁標準管、數支對照空管和一張比濁用的圖片,說明書上注明標準管相當于不同細菌種類的菌數,使用期為1年。也可自行制作標準比濁管。比濁計數法節時方便,但誤差大。
(1)標準比濁管的制備
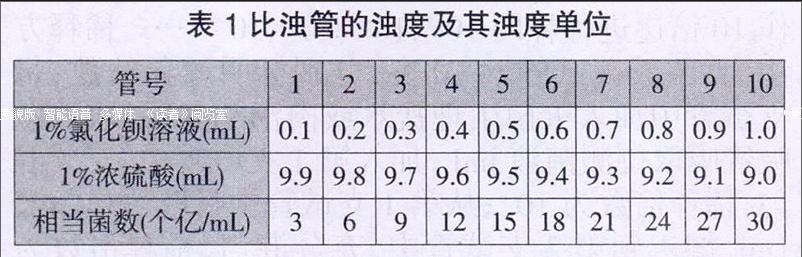
選取口徑和管壁厚薄一致的潔凈試管10支,分別加入1%氯化鋇溶液,然后加入1%濃硫酸溶液,使各管總液量為10mL,加塞并用石蠟封固,保存備用。各管加液量及濁度單位見表1。
(2)比濁方法
取待測菌液1mL加入空試管中,與標準管并列緊貼在圖片前,使兩管受光均勻,透過兩管管壁對比觀察,目測圖片的清晰度。比濁時標準管與待測菌液管應經常搖勻。若待測菌液管較標準管過濃時,可在待測管中加適量生理鹽水進行調整,直至兩管背后的圖片清晰度相同為止。
例如:測定大腸桿菌的菌數,若1mL菌液加入4mL的生理鹽水后,與標準管的濁度相同,即表示該菌液經5倍稀釋后相當于標準管。大腸桿菌標準管的菌數相當于8億個/mL,故被測菌數為8×5=40億個/mL,
(四)滅活與檢驗
滅活在疫苗制造上是將細菌及其產生的毒素用物理或化學方法處理,使其喪失毒力或致病性,而保留其抗原性的過程。滅活時,根據細菌的特性選用有效的滅活劑和最適的滅活條件。甲醛是大腸桿菌滅活中最有效的滅活劑,向上述培養的大量菌液中加人終濃度0.3%甲醛溶液,置37℃溫箱滅活24~48h。取少量滅活后菌液接種于營養瓊脂斜面培養3天,檢查無細菌生長,證明滅活完全。
(五)配制氫氧化鋁膠與配苗
將滅活后的菌液按5份菌液加入1份氫氧化鋁膠進行配苗,大腸桿菌的菌液濃度為100億-400億個/ml。配苗時應充分振蕩,加入0.01%硫柳汞防腐,置2~8℃靜置2-3天,抽棄上清液,濃縮成全量的60%。塞上膠塞,用固體石蠟溶化封口,貼上標簽,注明菌苗名稱,使用前充分搖勻。在菌液中加入氫氧化鋁膠(佐劑),是為了增強免疫效果。
氫氧化鋁膠的制作:先用去離子水將無水A1Cl3配成25%溶液,加熱溶化,使用時稀釋成8%的溶液;另配4%NaOH溶液,將兩種溶液同時加溫至56℃~60℃。在此溫度下,將NaOH溶液緩慢加入于8%AlCl3溶液中,邊加邊攪拌,當pH值達5.6-6.0時,即為終點,繼續攪拌10分鐘,置高壓滅菌器內121.3℃滅菌20分鐘,氫氧化鋁膠呈透明略帶乳光液體,保存期不超過3個月。
(六)成品檢驗
1.無菌檢查
取1ml鋁膠苗加入49ml硫乙醇酸鹽培養基中,培養72h后,移植于葡萄糖蛋白胨水培養基中和酪胨瓊脂培養基上培養5天,檢查無細菌生長。
2.安全檢驗
取1月齡健康易感雞5只,各頸部皮下或肌肉注射鋁膠苗2ml,同時設不接種疫苗的對照組,與免疫組同條件飼養,觀察14天,應健康存活,剖檢時,內臟器官及注射部位應無損傷。
3.效力檢驗
取1月齡健康非免疫雞5只,各頸部皮下注射鋁膠苗0.5ml,21天后,連同條件的對照組雞5只,各腹腔注射致病性大腸桿菌的肉湯培養物0.5ml(含活菌2億~5億個)。攻毒后觀察14天,對照組雞應全部發病或死亡,剖檢后具有典型病變;免疫組雞保護率在70%以上,為合格。
通過對學生模擬生產工藝制作大腸桿菌鋁膠滅活苗的理實一體化的課堂訓練,不僅讓學生掌握生產大腸桿菌疫苗的操作技巧,學會細菌性滅活苗的制作,同時讓學生感受到自己是在生產崗位上工作,即是學習,又是工作,鍛煉了學生對應職工作崗位的認知和了解。又因為是小組共同完成任務,又培養了學生共處共生、團結協助的關系。為學生今后走向工作崗位打下堅實基礎。
[責任編輯:馬欣]