叢枝菌根網絡對不同喀斯特適生植物生長及氮攝取的影響
楊 應,何躍軍,3,* ,董 鳴,王鵬鵬,司建朋,謝佩耘
1 貴州大學林學院/貴州大學貴州省森林資源與環境研究中心,貴陽 550025 2 杭州師范大學,生態系統保護與恢復杭州市重點實驗室,杭州 310036 3 中國科學院植物研究所,植被與環境變化國家重點實驗室,北京 100093
叢枝菌根真菌(Arbuscular Mycorrhizal Fungi, AMF)是一種能與世界上80%的維管束植物形成互利共生關系的微生物[1],AMF通過菌絲侵入到植物根系與宿主植物根系形成菌根,根系外延菌絲通過利用植物碳水化合物維持生長并吸收土壤養分供給宿主植物實現互利共生[2],外延菌絲還可以通過侵入點再度侵染其他植物根系后在不同植物間形成龐大的地下公共菌根網絡(Common Mycorrhizal Networks,CMN)[3- 4]。CMN能夠在不同植物個體之間傳遞營養元素[5],對植物個體間營養平衡[6- 7]和物種多樣性維持[8]等方面具有重要的生態功能,并對宿主植物的氮、磷等養分的轉移分配產生影響[9- 10],因此改變植物個體功能性狀如營養性狀和表型性狀等。
中國是世界上喀斯特分布面積最大的國家,分布的喀斯特面積達130萬km2,西南地區分布著最為典型的碳酸巖發育的喀斯特地理景觀[11],喀斯特生態系統包含一系列不同的微生境如石面、石溝、石縫、露頭等[12],因此喀斯特生態系統具有較高的生境異質性,生境異質性影響了喀斯特土壤微生物和地上植物群落的空間分布。Hutchinson[13]提出了一個重要的生態學問題:大量物種是如何持續共存于同一生境的?Tilman 和Pacala[14]認為植物個體的競爭是促進異質生境資源再分配實現多物種共存的重要原因。CMN影響植物功能性狀促進異質生境資源營養分配而對生態系統的穩定性產生影響,因此對高度異質的喀斯特生境而言CMN可能在調控生境資源方面也扮演著重要的角色。當前喀斯特地區菌根生態學的研究主要集中在菌根植物光合生理[15]、AMF與宿主植物的抗旱性[16]、AM植物的氮磷營養利用[17]等方面,高度異質的喀斯特生境中CMN對植物個體的影響還缺乏研究,該地區維持了較高的植物物種多樣性,這些物種的分布是與喀斯特異質生境高度適應的。在喀斯特生境中,不同物種形成的植物群落個體之間是如何實現養分資源分配是很多學者關注的問題,CMN在不同物種間如何調節分配養分資源的研究尚屬空白。雖然He等[6]、Fellbaum等[9]曾采用同位素示蹤研究發現灰松(Gray pine)和豆科苜蓿(Medicagotruncatula)植物氮轉移,但這兩類植物主要是外生菌根型植物和固氮型植物,并且他們的研究并沒有考慮同一生境條件下不同生長型植物間養分轉移。喀斯特植物群落由許多不同生長型物種構成,如喬木型香樟(Cinnamomumcamphora)、灌木型構樹(Broussonetiapapyrifera)和草本型鬼針草(Bidenspilosa)等植物常共存于同一喀斯特小生境,這些物種在喀斯特群落演替過程中,因生境資源異質性分布,個體之間可能存在養分濃度差異,不同的物種間是否通過CMN調節分配養分資源促進植物個體的營養平衡我們并不清楚,這一問題的明確對深入闡明喀斯特植被穩定性維持機制具有重要意義。此外,植物個體間養分資源在CMN作用下的再分配必然引起植物功能更性狀如營養性狀、表型性狀的改變,因此有必要通過同位素示蹤技術研究CMN介導的喀斯特不同植物個體間養分轉移分配與植物功能性狀調控適應對策。為此,提出如下假說:(1)CMN轉移了植物個體的養分;(2)CMN對同種生物個體和異種生物個體養分的轉移分配存在差異;(3)CMN對不同物種個體生長性狀和根系表型特征產生影響。為此,本研究采用同位素示蹤技術模擬自然環境構建微生態系(microcosms),探索CMN在喀斯特土壤中對不同物種個體養分轉移分配和植物生長性狀的影響。
1 材料及方法
1.1 試驗裝置
本研究模擬自然采用如圖1設置的試驗裝置構建微生態系,微生態系由1個聚丙烯材料制成的圓形大盆和7個11.8 cm× 14.0 cm(直徑×高度)的柱形隔室(厚度2 mm)構成。圓形大盆作為一個單元,每個單元內包含7個柱形隔室,其中1個隔室作為供體室放置在中間,另外6個隔室作為受體室放置在周圍,整個試驗共包含了6個微生態系單元作為實驗重復。供體室底部開4 cm直徑的圓孔連接大盆底部外側,并與6 cm直徑的外部同位素標記培養皿聯通,培養皿與供體室間用2 mm的尼龍網隔離以保證供體植物根系能夠穿透尼龍網進行同位素標記又阻隔土壤下滲。從每個隔室底部向上3—10 cm的柱壁上鉆1 cm的圓孔帶,孔間間隔2 cm,用20 μm或者0.45 μm的尼龍網(Amersham Hybond, USA)粘附在隔室柱壁兩側,其中20 μm尼龍網允許菌絲通過,卻阻止植物根系通過,0.45 μm網只允許土壤中的離子通過,卻阻止菌絲和植物根系通過[18]。供體室植物接種AMF,并采用20 μm尼龍網處理,這樣供體室內的AMF菌絲體能夠進入20 μm尼龍網處理的受體室,并侵染受體室植物根系,在微生態系裝置內不同植物個體間形成公用菌絲網CMN。
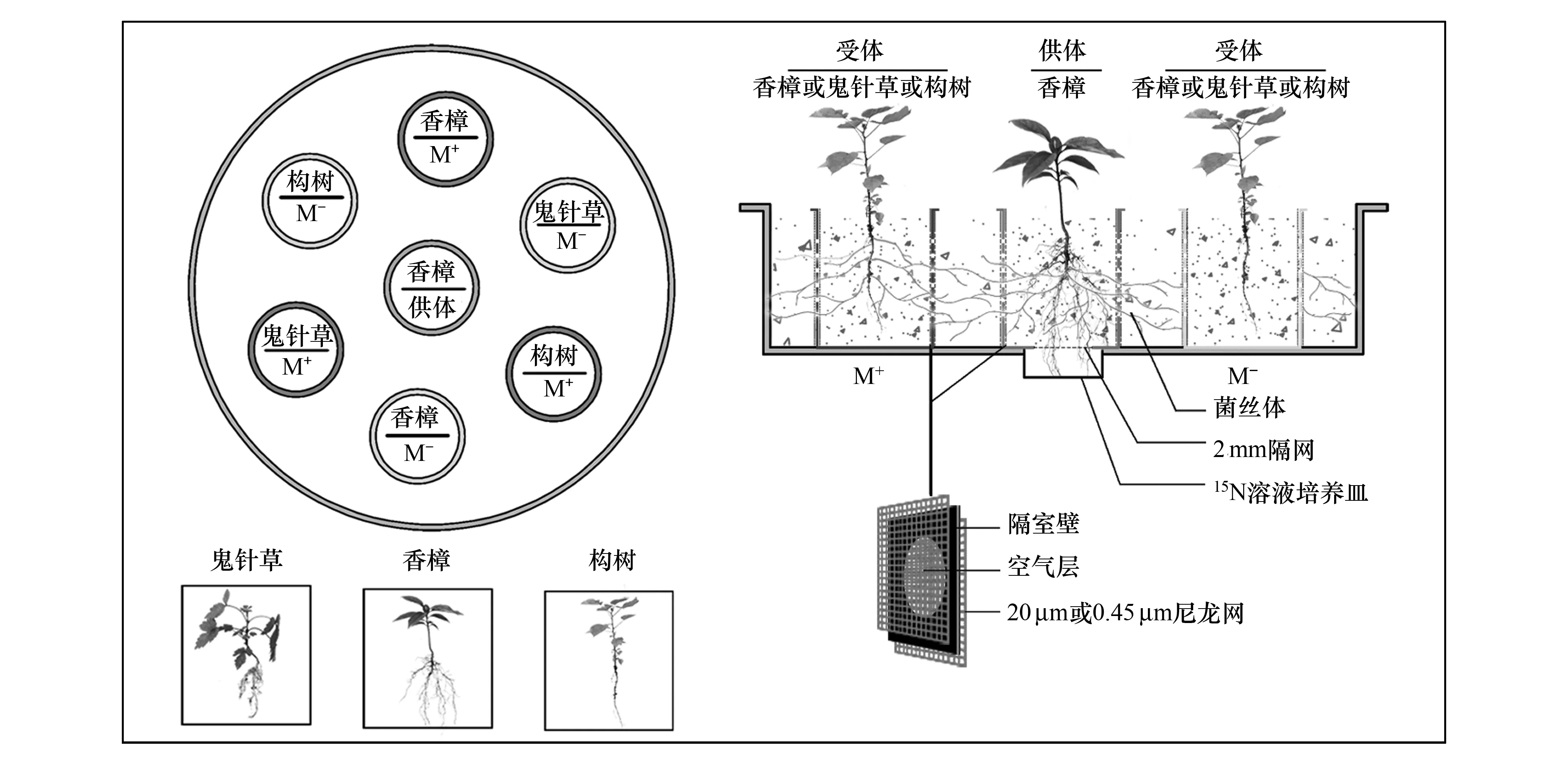
圖1 試驗生態系裝置示意圖Fig.1 The microcosm device design
1.2 試驗材料與處理
試驗材料:本試驗場所位于貴州大學林學院溫室大棚內進行,地理位置: 106°22′E,29°49′N, 海拔1120 m。試驗土壤采集于貴陽市花溪區典型喀斯特地段的石灰土,按石灰土∶河沙=3∶1的體積比充分混合作為植物培養基質。試驗基質在126℃,0.14 Mpa下連續濕熱滅菌1 h備用。基質理化性質為:pH6.92,全氮2160 mg/kg、堿解氮137.43 mg/kg、全磷170 mg/kg和速效磷19.58 mg/kg。土壤采樣地段分布有香樟(Cinnamomumcamphora)、構樹(Broussonetiapapyrifera)和鬼針草(Bidenspilosa)3種不同生長型的喀斯特適生植物,其中香樟是喬木樹種,構樹是灌木樹種,鬼針草是草本植物。本試驗3種植物種子分別采集于同一成年植株,試驗采用幼套球囊霉(Glomusetunicatum)作為供試菌種,購于北京農林科學院營養資源研究所(BGCAM 0046),試驗前將該菌種通過白三葉草(Trifoliumrepens)擴繁4個月獲得試驗菌劑,菌劑孢子密度≥10個/g,包含菌絲片段及侵染根段等。
試驗處理:所有隔室中放置2.5 kg的滅菌基質,隔室之間的空隙用滅菌基質填充,填充高度與隔室中土壤高度持平。先將種子在10%的H2O2溶液中消毒10 min,并在無菌水中清洗3次后播入隔室中。供體室播入5粒香樟種子并接種100 g的幼套球囊霉培養菌劑;6個受體隔室均不接種,其中3個隔室采用20 μm的尼龍網處理(M+處理),另外3個隔室采用0.45 μm的尼龍網處理(M-處理),每個M+和M-受體隔室分別播入5粒香樟、構樹和鬼針草種子,所有隔室在種子播入后澆足水分,放置在塑料大棚中常規培養。當幼苗出土2周后,在供體室中留置1株幼苗,受體室中各留置2株幼苗,當幼苗生長3個月后在培養皿中注入8 mL濃度為0.5%的(15NH4)2SO4(δ15N=99.14%,購于上海同位素工程研究中心)溶液標記供體植株根系,同位素標記2周后收獲所有的試驗土壤和植物材料進行指標分析。
1.3 指標測定及方法
菌根侵染率按照Kormanik等[19]和Brundrett等[20]所描述的染色觀察方法測定。生物量采用烘干法,將植株根、莖、葉放置在105℃下恒溫48 h至恒重后稱量。植氮含量采用凱氏定氮法(Büchi Distillation Unit B- 324全自動凱氏定氮儀)進行測定。同位素δ15N值的測定是將植株葉片在105℃烘干后采用球磨機粉碎,過篩100目后裝入錫箔紙作為待測樣品,送至國家海洋局第三海洋研究所進行測定,所用儀器為Thermal Finnigan TC/EA-IRMS 測試儀,型號DELTAV Advantage。根直徑、根總長、根表面積和根體積的測定是采用加拿大WinRHIZO_Pro LA2400根系分析系統測定,葉面積采用葉面積儀測定。
1.4 數據處理及分析
數據采用SPSS 13.0版本軟件分析,采用ANOVA最小極差法(LSD)分析δ15N值、氮攝取量、株高、地徑、葉面積、根直徑、根總長、根表面積和根體積等性狀指標值之間的差異,t檢驗比較分析M+與M-處理之間的性狀指標值差異,顯著性檢驗水平為5%,采用Origin 8.0作圖。
2 結果與分析
2.1 不同處理條件下受體植物菌根侵染率
試驗中3種不同的受體植物在M-處理下均未發現菌根真菌侵染,也未發現菌絲體片段或者AM孢子的存在。3種不同的受體植物在M+處理下侵染率表現為構樹>香樟>鬼針草,香樟、構樹和鬼針草菌根侵染率分別為55.50%、61.75%和43.50%,香樟與構樹菌根侵染率差異不顯著(P>0.05),但二者分別與鬼針草差異顯著,該結果表明0.45 μm的尼龍網有效阻隔了AM菌絲體向M-隔室生長。
2.2 CMN對植株個體葉片δ15N值的影響
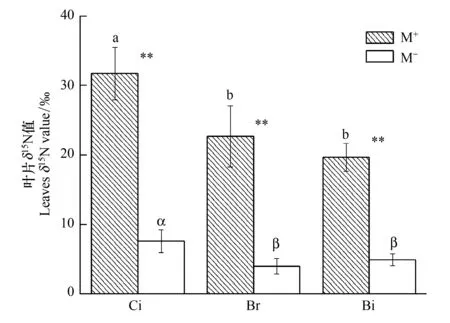
圖2 受體植物在M+與M-處理下的葉片δ15N值 Fig.2 The leaves δ15N value of receiver plants in the M+and M- treatmentsCi:香樟, Cinnamomum camphora; Br:構樹, Broussonetia papyrifera; Bi:鬼針草, Broussonetia papyrifera;英文字母(a,b,c)不同表示M+處理下不同植株幼苗葉片δ15N值之間差異顯著(P<0.05);希臘字母(α,β,γ)不同表示M-處理下不同植株幼苗葉片δ15N值之間差異顯著(P<0.05);**表示差異極顯著P<0.01
如圖2在M+處理下受體植物香樟、構樹和鬼針草葉片δ15N值分別顯著高于M-處理,3種受體植物分別提高了317.79%、394.96%和300.20%。在M+處理下,香樟幼苗葉片δ15N值顯著高于構樹和鬼針草,而構樹與鬼針草間葉片δ15N值沒有顯著差異,同樣地,M-處理的結果與M+處理相似,仍表現為香樟分別與構樹、鬼針草間存在顯著差異,但構樹與鬼針草間差異未達到顯著水平。該試驗結果表明,CMN顯著提高了香樟、構樹和鬼針草對供體香樟15N的轉移和利用,受體植物不同,對供體植物15N的轉移分配效應存在差異。
2.3 CMN對不同受體植物個體氮攝取量及其分配的影響
3種受體植株個體總氮攝取量如圖3所示,M+處理的香樟幼苗總氮攝取量顯著高于M-處理,但構樹和鬼針草幼苗各自的總氮攝取量在M+與M-處理間差異不顯著;在M+處理下,香樟總氮攝取量分別顯著低于構樹和鬼針草,但構樹與鬼針草間差異不顯著,在M-處理下也表現類似的結果。3種植物氮攝取量分配如圖3b所示,M+處理下香樟幼苗地上部分和地下部分氮攝取量分別顯著高于M-,但構樹和鬼針草各自的地上部分和地下部分氮攝取量在不同處理間差異均不顯著;就地上部分氮攝取量而言,M+處理下,構樹和鬼針草間氮攝取量沒有顯著差異,但均顯著高于香樟,M-處理也表現同樣結果;就地下部分氮攝取量而言,M+處理的構樹與鬼針草間氮攝取量沒有顯著差異,但均顯著高于香樟,而M-處理下,3個物種間彼此差異顯著。該結果表明,M+處理下CMN顯著提高了香樟幼苗地上部分、地下部分和植株總氮攝取量,對供體香樟相對的異種植物構樹和鬼針草沒有顯著效應,但構樹和鬼針草氮攝取量均顯著高于同種個體的香樟。
2.4 CMN對不同種受體植物個體生物量的影響
如圖4,M+處理的香樟總生物量顯著高于M-處理,但構樹和鬼針草各自的總生物量在M+與M-處理間差異未達到顯著水平;在M+處理下,構樹與鬼針草間總生物量差異不顯著,但二者顯著高于香樟,M-處理下,3個物種間彼此差異顯著。圖4為植株幼苗地上和地下生物量的分配。就地上生物量而言,M+處理下香樟和鬼針草分別顯著高于M-,其中香樟表現為極顯著差異,但構樹在不同處理間差異未達到顯著水平;M+處理下,構樹與鬼針草地上生物量差異不顯著,但二者顯著高于香樟,而M-處理下,3個物種間彼此差異顯著。就地下生物量而言,M+處理的香樟顯著高于M-,構樹和鬼針草的不同處理間差異不顯著;M+和M-處理的地下生物量均表現為3個物種間彼此差異顯著。由此可知,只有香樟幼苗在M+處理下其地上、地下和總生物量均顯著高于M-,與供體植物為同一物種的香樟生物量顯著低于異種個體的構樹和鬼針草。
2.5 CMN對不同種受體植物生長性狀的影響
如表1所示,比較分析香樟、構樹和鬼針草幼苗M+與M-處理下植株表型性狀特征,M+處理的香樟株高、地徑和葉面積均分別顯著高于M-,構樹株高、地徑和葉面積在不同處理間差異均未達到顯著水平,M+處理的鬼針草株高和地徑顯著高于M-,但葉面積差異不顯著。比較3種植物在相同處理下性狀差異,就株高而言,M+和M-處理的3個物種間彼此差異顯著,均表現為鬼針草>構樹>香樟;就地徑而言,M-處理下,香樟與構樹間差異顯著,二者分別與鬼針草無顯著差異;就葉面積而言,相同處理下香樟分別顯著低于構樹和鬼針草,但構樹與鬼針草間差異不顯著。該結果表明,CMN顯著提高了香樟幼苗株高、地徑和葉面積,顯著促進了鬼針草幼苗的高生長和莖生長,但對構樹沒有顯著影響。
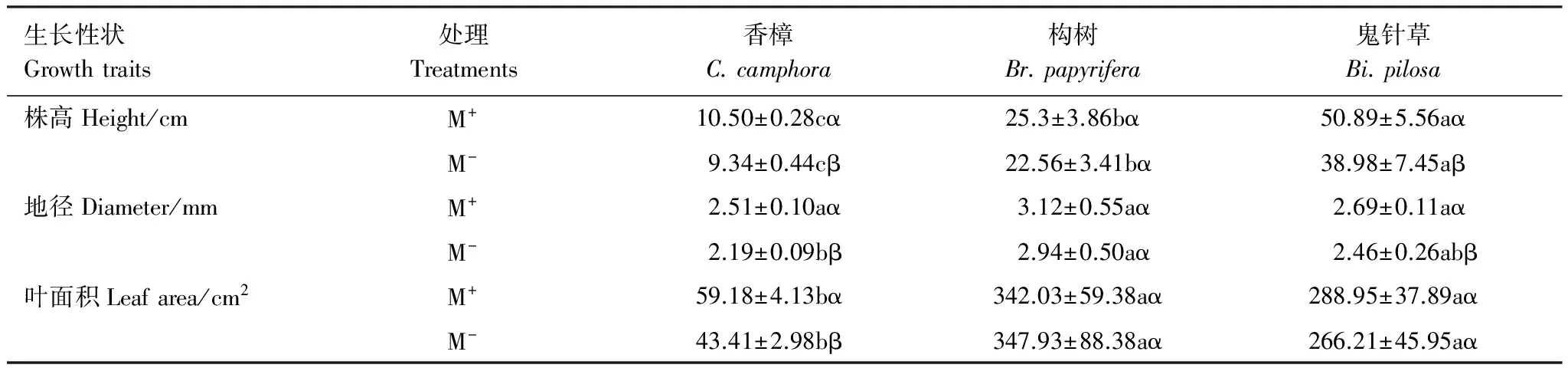
表1 不同受體植物株高、地徑和葉面積
同列中不同希臘字母(α、β)表示同一物種不同處理下差異顯著(P<0.05),同行中不同小寫字母(a、b、c)表示同一處理下不同物種相同器官間差異顯著
2.6 CMN對不同種受體植物根系性狀的影響
3種受體植物根系性狀特征如圖5所示,M+處理的香樟幼苗根平均直徑、根總長、根表面積、根體積分別顯著高于M-,構樹幼苗的根平均直徑、根總長、根表面積、根體積在M+處理下顯著低于M-,而鬼針草在不同處理間各根系性狀特征無顯著差異。M+處理下,香樟與構樹間根平均直徑差異顯著,但二者分別與鬼針草無顯著差異,M-處理下,三個樹種間彼此差異不顯著;M+和M-處理的三個物種間彼此差異顯著,根總長表現為鬼針草>構樹>香樟;植物根表面積和根體積的變化規律與根總長相似。該結果表明,CMN顯著提高了香樟幼苗根系平均直徑、根總長,根表面積和根體積,顯著降低構樹幼苗的,而對鬼針草的影響并不顯著。
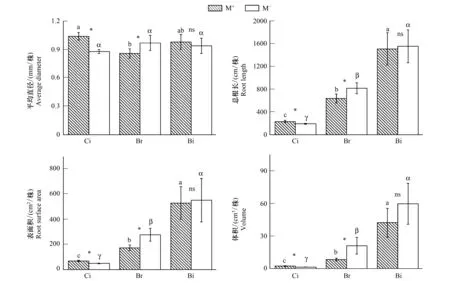
圖5 在M+與M-處理下的受體植物根系平均直徑、根總長、根表面積和根體積Fig.5 The root traits on average diameter, root length, root surface area and root volume of receiver plants in the M+ and M- treatments
3 討論與結論
本試驗結果表明,微生態系中AM菌絲體形成的菌根菌絲網CMN提高了受體室植株的氮含量,CMN轉移供體香樟15N分配給受體香樟、構樹和鬼針草幼苗,這一結果與He等[6]在加利佛利亞橡樹林內用同位素標記技術研究外生菌根植物和叢枝菌根植物之間通過CMN移動15N的結果相一致,Cheng等[21]的研究結果也表明,通過AMF菌絲網作用在雀麥等作物相鄰葡萄樹中發現15N的存在。然而,CMN對15N的轉移可能是供體植物和受體植物根系聯結的菌絲橋直接轉移,也可能通過植物根系細胞剝離溶解或者根系分泌物將氮釋放在土壤中被菌絲體間接吸收轉移[22- 23],亦或菌絲體從供體植物根系將氮轉移到土壤,再從土壤轉移到受體植物根系[24]。He等[25]認為AM真菌和植物個體間可能存在氮的雙向轉移,這種雙向轉移正如Lu等[26]報道7個月大的黃檀Dalbergiaodorifera在接種固氮細菌Bradyrhizobiumelkanii后,通過同位素示蹤技術標記15N發現半寄生植物白檀Santalumalbum與黃檀幼苗之間存在雙向15N轉移的結果一樣,這種轉移是通過根系分泌物釋放轉移的。這就使得CMN促進鄰體植物之間氮的轉移和利用過程變得十分復雜,而我們的試驗僅是對供體香樟幼苗根系單向標記了15N同位素,個體之間的氮轉移也可能從受體的香樟、構樹和鬼針草向供體香樟發生,甚至通過微生態系隔室之間的土壤間接吸收轉移,或者通過CMN在受體植物如香樟、構樹和鬼針草之間相互轉移,因此更為深入的研究是十分必要的。
本試驗中CMN對3種受體植物各部分氮攝取量的影響存在差異性,CMN對同種植物的香樟具有顯著正效應,而對異種植物的構樹和鬼針草的影響不顯著,引起不同物種個體氮攝取量差異的原因可能是宿主植物生活型不同引起AMF對不同植物的功能選擇差異[27- 28],導致CMN對氮的分配存在差異性。Weremijewicz等[29]認為CMN具有增大植物物種個體對資源分配的非平衡性,Burke[30]發現Maianthemumracemosum幼苗在生長和養分攝取上通過CMN受益于鄰近的同種個體,但異種的個體則對之是負效應,本試驗中氮攝取量在3個物種上的差異支持了他們觀點,從AMF對物種的生活型功能選擇支持了Yang等[28]的研究。植物可通過生物和非生物過程競爭土壤中的礦質營養,并改變各部分的生物量積累及分配格局以適應土壤養分變化,從而最大限度獲取土壤中的養分資源[31],在植株個體養分資源分配上,3種植物地上部分的氮攝取量高于地下部分的氮攝取量,因而可能促進地上部分生物量高于地下部分生物量。
根長,根表面積,根平均直徑以及根體積是度量根系表型性狀的常規指標[32],而AMF對宿主植物根系的空間結構和形態特征具有重要影響,并直接影響了植物對土壤水分和礦質養分的吸收[33]。如宋會興等[34]的研究表明接種摩西球囊霉Glomusmosseae后提高了構樹的根總長、根平均直徑、根表面積和根體積;鄒英寧等[35]對枳苗Poncirustrifoliate接種AMF后發現其根表面積、體積和根長增加,但平均直徑降低。CMN可能對資源進行非平衡再分配而改變不同植物個體原有性狀表現,而CMN對不同植物而言可能是正效應,也可能是負效應,甚至對一些物種沒有影響,本實驗中菌絲網絡顯著促進了香樟幼苗根系的生長,顯著抑制了構樹幼苗根系的生長,而對鬼針草沒有顯著影響,各根系性狀特征在3個物種上的差異正好支持Burke[30]的異種個體菌根功能貢獻觀點。研究表明CMN通過菌絲體轉移養分并改變植物個體養分的攝取,從而影響植物生長性狀和表型性狀,如Fellbaum等[9]認為CMN對宿主植物個體間氮、磷等養分的轉移分配具有重要生態功能;Merrild等[36]則認為CMN增加了物種間對養分競爭從而影響了植物個體性狀,如營養性狀和表型性狀等的改變,這種競爭是實現異質生境中資源再分配和多物種共存的重要原因[13],這與本試驗中CMN促進了香樟和鬼針草幼苗的地上部分高和莖生長,提高香樟葉面積的研究結果相符合。本試驗中不同物種的氮攝取和分配、表型性狀等存在差異性,其原因可能是3種不同生長型的植物生物性和生長特征差異較大,同時進行4個月的試驗,香樟還處在幼苗期、而構樹和鬼針草可能已經進入生長旺盛期,各自對于養分資源的吸收利用速率和生物量積累速率不一致,當然更為深入的研究是必要的。CMN往往會對不同大小個體的植株非平衡性資源分配,從而實現同種個體或異種個體因菌絲網絡的調節共存于同一生境[37- 38]。生境異質性影響了喀斯特土壤微生物和地上植物群落的空間分布[39], 喀斯特地區不連續的土被和特殊的地表形態決定了生境異質性高,這種異質生境中的養分資源呈現不均勻分布,因此由CMN介導的植物個體間資源再分配可能是促進喀斯特異質生境物種共存的重要因素之一。在本試驗的模擬微生態系中,結果表明CMN影響了植物個體間氮轉移, 植株氮的攝取量依賴于植物個體生物量強度;CMN對植物個體的養分吸收和表型性狀影響具有非平衡性,同種和異種植物個體養分轉移和分配對CMN具有不同的響應,同種個體的香樟對CMN具有生長和氮攝取方面顯著正效應;CMN改變了植物個體生長和生理性狀,導致植物生長性狀和根系表型性狀的差異。
[1] 李曉林, 馮固. 叢枝菌根生理生態. 北京: 華文出版社, 2001: 345- 358.
[2] Smith S E, Read D J. Mycorrhizal Symbiosis. 3rd. New York: Academic Press, 2008.
[3] Newman E I. Mycorrhizal links between plants: their functioning and ecological significance. Advances in Ecological Research, 1988, 18: 243- 270.
[4] He X H, Critchley C, Bledsoe C. Nitrogen transfer within and between plants through common mycorrhizal networks (CMNs). Critical Reviews in Plant Sciences, 2003, 22(6): 531- 567.
[5] Booth M G. Mycorrhizal networks mediate overstorey-understorey competition in a temperate forest. Ecology Letters, 2004, 7(7): 538- 546.
[6] He X H, Bledsoe C S, Zasoski R J, Southworth D, Horwath W R. Rapid nitrogen transfer from ectomycorrhizal pines to adjacent ectomycorrhizal and arbuscular mycorrhizal plants in a California oak woodland. New Phytologist, 2006, 170(1): 143- 151.
[7] 陳永亮, 陳保冬, 劉蕾, 胡亞軍, 徐天樂, 張莘. 叢枝菌根真菌在土壤氮素循環中的作用. 生態學報, 2014, 34(17): 4807- 4815.
[8] Selosse M A, Richard F, He X H, Simard S W. Mycorrhizal networks:desliaisonsdangereuses. Trends in Ecology & Evolution, 2006, 21(11): 621- 628.
[9] Fellbaum C R, Mensah J A, Cloos A J, Strahan G E, Pfeffer P E, Kiers E T, Bücking H. Fungal nutrient allocation in common mycorrhizal networks is regulated by the carbon source strength of individual host plants. New Phytologist, 2014, 203(2): 646- 656.
[10] Weremijewicz J, Sternberg L D S L O, Janos D P. Common mycorrhizal networks amplify competition by preferential mineral nutrient allocation to large host plants. New Phytologist, 2016, 212(2): 461- 471.
[11] Wang S J, Liu Q M, Zhang D F. Karst rocky desertification in southwestern China: geomorphology, landuse, impact and rehabilitation. Land Degradation & Development, 2004, 15(2): 115- 121.
[12] Zhang X Y, Sui Y Y, Zhang X D, Meng K, Herbert S J. Spatial variability of nutrient properties in black soil of northeast China. Pedosphere, 2007, 17(1): 19- 29.
[13] Hutchinson G E. Homage to Santa Rosalia or why are there so many kinds of animals. The American Naturalist, 1959, 93(870): 145- 159.
[14] Tilman D, Pacala S. The Maintenance of Species Richness in Plant Communities//Ricklefs R E, Schluter D, eds. Species Diversity in Ecological Communities. Chicago: University of Chicago Press, 1993.
[15] Chen K, Shi S M, Yang X H, Huang X Z. Contribution of arbuscular mycorrhizal inoculation to the growth and photosynthesis of mulberry in karst rocky desertification area. Applied Mechanics and Materials, 2014, 488- 489: 769- 773.
[16] 何躍軍, 鐘章成. 喀斯特土壤上香樟幼苗接種不同AM真菌后的耐旱性效應. 植物研究, 2011, 31(5): 597- 602, 622- 622.
[17] 何躍軍, 鐘章成, 劉濟明, 劉錦春, 金靜, 宋會興. 構樹(Broussonetiapapyrifera)幼苗氮、磷吸收對接種AM真菌的響應. 生態學報, 2007, 27(11): 4840- 4847.
[18] 吳強盛, 夏仁學. 水分脅迫下叢枝菌根真菌對枳實生苗生長和滲透調節物質含量的影響. 植物生理與分子生物學學報, 2004, 30(5): 583- 588.
[19] Kormanik P P, Bryan W C, Schultz R C. Procedures and equipment for staining large numbers of plant root samples for endomycorrhizal assay. Canadian Journal of Microbiology, 1980, 26(4): 536- 538.
[20] Brundrett M C, Piché Y, Peterson R L. A new method for observing the morphology of vesicular-arbuscular mycorrhizae. Canadian Journal of Botany, 1984, 62(10): 2128- 2134.
[21] Cheng X M, Baumgartner K. Arbuscular mycorrhizal fungi-mediated nitrogen transfer from vineyard cover crops to grapevines. Biology and Fertility of Soils, 2004, 40(6): 406- 412.
[22] Staddon P L, Ramsey C B, Ostle N, Ineson P, Fitter A H. Rapid turnover of hyphae of mycorrhizal fungi determined by AMS microanalysis of14C. Science, 2003, 300(5622): 1138- 1140.
[23] Jones D L, Hodge A, Kuzyakov Y. Plant and mycorrhizal regulation of rhizodeposition. New Phytologist, 2004, 163(3): 459- 480.
[24] Johnson D, Leake J R, Ostle N, Ineson P, Read D J.Insitu13CO2pulse-labelling of upland grassland demonstrates a rapid pathway of carbon flux from arbuscular mycorrhizal mycelia to the soil. New Phytologist, 2002, 153(2): 327- 334.
[25] He X H, Xu M G, Qiu G Y, Zhou J B. Use of15N stable isotope to quantify nitrogen transfer between mycorrhizal plants. Journal of Plant Ecology, 2009, 2(3): 107- 118.
[26] Lu J K, Kang L H, Sprent J I, Xu D P, He X H. Two-way transfer of nitrogen betweenDalbergiaodoriferaand its hemiparasiteSantalumalbumis enhanced when the host is effectively nodulated and fixing nitrogen. Tree Physiology, 2013, 33(5): 464- 474.
[27] Van Der Heijden M G A, Bardgett R D, Van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296- 310.
[28] Yang H S, Zang Y Y, Yuan Y G, Tang J J, Chen X. Selectivity by host plants affects the distribution of arbuscular mycorrhizal fungi: evidence from ITS rDNA sequence metadata. BMC Evolutionary Biology, 2012, 12: 50.
[29] Weremijewicz J, Janos D P. Common mycorrhizal networks amplify size inequality inAndropogongerardiimonocultures. New Phytologist, 2013, 198(1): 203- 213.
[30] Burke D J. Shared mycorrhizal networks of forest herbs: does the presence of conspecific and heterospecific adult plants affect seedling growth and nutrient acquisition. Botany, 2012, 90(10): 1048- 1057.
[31] 王慶成, 程云環. 土壤養分空間異質性與植物根系的覓食反應. 應用生態學報, 2004, 15(6): 1063- 1068.
[32] Murphy S L, Smucker A J M. Evaluation of video image analysis and line-intercept methods for measuring root systems of alfalfa and ryegrass. Agronomy Journal, 1995, 87(5): 865- 868.
[33] Atkinson D, Black K E, Forbes P J, Hooker J E, Baddeley J A, Watson C A. The influence of arbuscular mycorrhizal colonization and environment on root development in soil. European Journal of Soil Science, 2003, 54(4): 751- 757.
[34] 宋會興, 鐘章成, 王開發. 土壤水分和接種VA菌根對構樹根系形態和分形特征的影響. 林業科學, 2007, 43(7): 142- 147.
[35] 鄒英寧, 吳強盛, 李艷, 黃詠明. 叢枝菌根真菌對枳根系形態和蔗糖、葡萄糖含量的影響. 應用生態學報, 2014, 25(4): 1125- 1129.
[36] Merrild M P, Ambus P, Rosendahl S, Jakobsen I. Common arbuscular mycorrhizal networks amplify competition for phosphorus between seedlings and established plants. New Phytologist, 2013, 200(1): 229- 240.
[37] Shumway D L, Koide R T. Size and reproductive inequality in mycorrhizal and nonmycorrhizal populations ofAbutilontheophrasti. Journal of Ecology, 1995, 83(4): 613- 620.
[38] Facelli E, Facelli J M. Soil phosphorus heterogeneity and mycorrhizal symbiosis regulate plant intra-specific competition and size distribution. Oecologia, 2002, 133(1): 54- 61.
[39] Zhang Z H, Hu B Q, Hu G. Spatial heterogeneity of soil chemical properties in a subtropical karst forest, southwest China. The Scientific World Journal, 2014, 2014: 473651.

