Red/ET同源重組技術在載體構建中的應用
郭善軍 張曉林 陳章寶 曾吉
摘 要 Red/ET同源重組技術是以原有的重組技術為基礎,利用Rac噬菌體ET系統或者 噬菌體的Red系統進行外源基因重組的重組方法。該方法使同源重組過程變得更方便快捷。本文對Red/ET同源重組技術的原理,改進和載體構建方面的應用做了綜述。
關鍵詞 Red/ET同源重組 噬菌體 載體構建
中圖分類號:Q392 文獻標識碼:A
2001年人類基因組測序完成,基因中所含有的大量的功能信息越來越受到人們的關注。為了解這些復雜的人類密碼的含義,對單個基因功能的研究也顯得越來越重要。然而,對于真核生物基因片段而言,其序列中除了包含具有功能、能表達的外顯子之外,還含有很多調控序列等內含子,如此一個基因片段則可能大至幾十或上百Kb。雖然現今有相應的載體,如BAC(人工染色體)和PAC(P1人工染色體)能裝載如此大量的基因信息,但是要找到這些基因片段的限制性內切位點,并在體外對其進行長距離的片段擴增的難度比較大。
Red/ET重組技術是以傳統的同源重組技術為基礎,但是,相對于普通的同源重組技術而言,它具有簡單、快速、高效等特點,而且整個重組過程不需要經過體外擴增階段,這樣可以避免外界環境引起的不必要的突變。
1傳統同源重組
自然發生的同源重組是兩個DNA分子之間進行片段交換,從而使序列重排。同源重組分析最早開始于1956年。在大腸桿菌中,A John Clark發現了兩種與同源重組有關的酶,RacA和RecBCD。在同源重組發生的時候,RecA結合DNA單鏈或雙鏈,對雙鏈DNA進攻,把原來配對的互補鏈分開,并嘗試自身與被入侵DNA鏈配對。當配對成功后,RecA蛋白脫落。或者在RecBCD的引導下,使目標DNA解旋,以便使外源DNA分子插入并在RecA的幫助下進行重組。當兩條鏈發生重組時,會產生holliday中間體,該中間體在重組完成時由RuvAB和RecG蛋白進行拆分。至此,形成兩條含有異源序列的雙鏈DNA。
在質粒或噬菌體轉入大腸桿菌的實驗中,當同源區段小于75bp時會使重組率顯著降低。但是實際上,在RecA重組系統中,要求同源臂的長度在1kb左右,且反應條件要求比較苛刻。
2 Red/ET同源重組技術
Red/ET同源重組系統,其實是Red同源重組系統和ET同源重組系統的總稱,其中ET系統于1998年由Stewart等在大腸桿菌中誘導的Rac噬菌體中發現,隨后又在 噬菌體中發現了Red系統。在這兩個系統中,整個重組過程由DNA重組酶參與而不需要限制性內切酶,且對同源臂長度的要求低,僅需35-50bp的同源序列,而傳統的RecA同源重組則需要大約1kb的同源序列。并且該系統介導的整個同源重組過程都是在細內進行,避免了因胞外反應引起的不必要突變。
2.1 ET同源重組系統
該系統于1998年由Stewart等在大腸桿菌中誘導的Rac噬菌體中發現,其所需的單側同源臂長度僅為35-50 bp,該噬菌體通過表達蛋白RecE和RecT來介導重組反應。其中RecE蛋白有5′-3′外切酶活性,能夠從5′-3′端依次切下雙鏈DNA上的堿基,使DNA分子形成3′粘性末端。RecT是一種單鏈結合蛋白,保護單鏈核苷酸不被降解,能在退火時指導單鏈入侵。
在ET系統中,帶有同源臂的外援DNA分子可以直接通過同源臂找到同源區域,然后進行DNA的互換。
2.2 Red同源重組系統
Red重組系統也是由Stewart的實驗小組在 噬菌體中發現,它是由Red 和Red 兩種蛋白組成的同源重組系統。Red 由三個蛋白質亞基組成,中間的空隙能消化DNA分子,與ET系統中的RecE蛋白相似,它具有5′-3′端核酸外切酶活性,能形成3′粘性末端。Red 也是一種單鏈結合蛋白,作用相似于ET系統中的RecT蛋白。
3 重組原理及操作
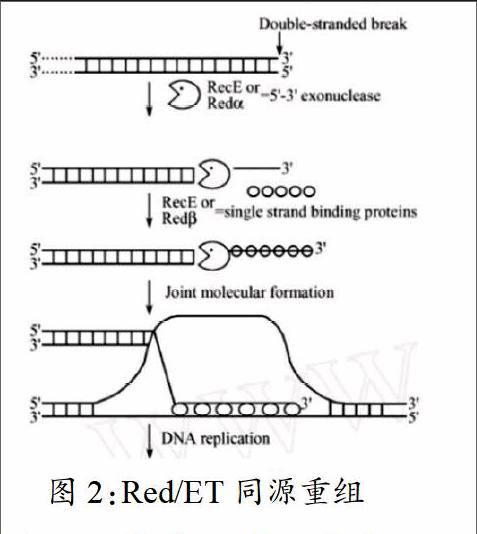
3.1 Red/ET同源重組的原理
根據Red/ET中Red 及RecE、Red 及RecT的功能,推測了該同源重組系統的作用機理。
當帶有同源臂的外源DNA分子進入到大腸桿菌中時,Red 或RecE發揮其5′-3′端核酸外切酶功能,由5′端開始降解DNA序列,產生的3′粘性末端,這時外源DNA具備了與受體DNA發生重組的條件。產生的粘性末端被RecT或者Red 結合35bp的單鏈核苷酸序列,同時防止被細胞內存在的核酸內切酶降解。在DNA退火時,含有粘性末端的3′單鏈進攻雙鏈DNA片段,重組。發生重組的兩條DNA鏈經過剪切和DNA聚合酶的修復作用后,重組DNA形成,外源DNA成功導入受體DNA中。
但是在大腸桿菌中有一種RecBCD蛋白,它具有極強的核酸外切酶活性,能將外源線性DNA降解掉,從而降低重組的成功率。所以在RecBCD蛋白缺失的大腸桿菌中Red/ET同源重組的方法才能最大可能的發揮作用。為了能提高外源DNA在大腸桿菌中的重組率,首先應該抑制RecBCD在大腸桿菌中的表達量,為此將 噬菌體Gam蛋白的基因導入到重組系統中。Gam蛋白能與RecBCD形成RecBCD-Gam符合體,抑制RecBCD的核酸外切酶活性。
3.2操作方式
該重組技術在的操作方式主要有兩種。(1)建立含有將 基因的ET系統或Red系統的質粒,在實施重組時將三者共同導入受體分子中,共同表達。(2)直接在受體菌中篩選出能進行Red/ET重組的菌株。前者的重組成功率更高,但是當受體分子不容易接受外源DNA時,后一種方式就顯得更加便捷。
4系統優化
最初Red/RT系統采用的是pDAB-ET 依托型質粒載體,在該載體中,recE、recT以及 基因分放在PBAD、EM7和Tn-5啟動子下共表達。在之后構建的pDAB-ETg和pDAB-gba載體中,RecE/RecT/Red 和Red /Red /Red 被放在PBAD啟動子后面共表達,該啟動子受L-阿拉伯糖誘導調控。但是在實際應用過程中卻發現了一些問題。
(1)在發生重組后該載體不容易從宿主細胞中去除,影響后續的研究工作。為此,研究人員開發了溫控性質粒。其原理是將Red /Red 與 基因放在含有PL啟動子和cI857基因的載體上,然后導入大腸桿菌中表達。在溫度為30℃時,cI857基因啟動PL啟動子,使Red系統不表達。當溫度為42℃時,cI857基因的作用被抑制,Red系統得以重新表達。
(2)由于工程用大腸桿菌一般都缺乏RecA蛋白,在這樣的情況下重組的發生率會降低。在最初的目的中使RecA缺失,其目的是讓真個表達系統中外源DNA復制更穩定。但是為了避免RecA缺失對重組率的影響又從新引入了RecA蛋白。
(3) 基因在表達的過程中不易控制,它的過度表達會影響RecBCD的活性,進而影響質粒表達的穩定性(Gam蛋白與RecBCD蛋白結合只是抑制了RecBCD對核酸的降解能力,但仍然能對同源重組起促進作用)。為了解決這樣的問題,研究者將 基因和Red/ET系統共表達,從而對 基因進行調控。
此外,有研究發現, 基因上的5′端的非翻譯區域對重組效率有很大的影響。將含有5′端的非翻譯區突變的基因與Red 和Red 連接,可以很大程度的提高重組效率。
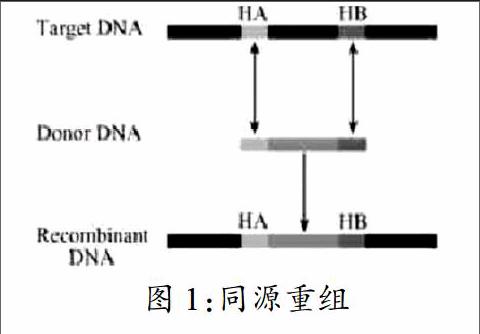
5在載體構建中的應用
2006年Osterrieder等運用Red/ET系統和反篩選系統(I-SceI蛋白)設計出了兩步重組方法。首先設計一個含有I-SceI同源臂的基因片段,通過Red/ET系統轉入載體之中。構建好的重組載體通過誘導I-SceI蛋白的表達,使雙鏈產生切口。切口處可作為同源臂,進行下一次的異源重組。這種兩步重組系統大大地提高了重組的精確性。
在對致病菌基因的研究中,朱善元等對禽致病大腸桿菌的ibeA基因進行缺失,用缺失該基因的大腸桿菌粘附與侵襲人微血管內皮細胞。結果顯示,缺失ibeA基因的大腸桿菌與微血管內皮細胞的粘附能力顯著下降,侵襲率也顯著下降。Murphy等還通過該技術對致病大腸桿菌的有毒基因進行敲除,以為免疫制劑的進一步研究提供理論方法。
蘭德松等,利用Red/ET同源重組技術,通過兩步重組法構建了禽流感A/Goose/Guangdong/3/96(H5N1)毒株的血凝素(HA)基因的重組火雞皰疹病毒。他們的研究為新型禽流感重載活性疫苗的開發奠定了基礎。
6展望
Red/ET同源重組技術的使用,為外源基基因的重組表達提供了一種快捷、簡單的方法。在抗生素的開發中,使抗生素異源表達,提高產量也是研究中的重點。該技術除了能方便的運用于抗生素的異源表達方面,還可以通過對基因簇的修飾、重排、刪除等來創造新的抗生素。現在已有該方面的研究。
參考文獻
[1] 馬先勇,姚開泰.同源重組技術研究進展[J].生物工程進展,1996,16(3):16-23.
[2] 王軍平, 張友明. Red/ET重組及其在生物醫學中的應用[J].生物工程學報,2000,18(12):502-506.

