Ras信號通路在HIV-1 Tat誘導ZO-1及腦啡肽酶破壞的作用
蔣文琳, 黃 文, 陳艷蘭, 彭定越, 陳德斌, 鄒 敏
Ras信號通路在HIV-1 Tat誘導ZO-1及腦啡肽酶破壞的作用
蔣文琳1, 黃 文1, 陳艷蘭2, 彭定越1, 陳德斌1, 鄒 敏1
目的 探討Ras信號傳導通路在人類免疫缺陷病毒-1型反式轉錄激活因子(HIV-1 transactivator of transcription,HIV-1 Tat)誘導血腦屏障(BBB)中緊密連接蛋白Zonula Occludens(ZO)-1及腦啡肽酶(Neprilysin,NEP)破壞的作用。方法 以不同濃度Ras信號傳導通路抑制劑法尼基硫代水楊酸(farnesylthiosalicylic acid,FTS)刺激培養好的人腦微血管內皮細胞(human cerebral microvascular endothelium cells,HBEC-5i),并設立對照組,觀察其對細胞活力的影響。分別予以HIV-1 Tat、FTS刺激細胞,以蛋白免疫印跡法及實時反轉錄聚合酶鏈式反應(real-time reverse transcription polymerase chain reaction,RT-PCR )檢測HIV-1 Tat誘導的緊密連接蛋白ZO-1及NEP(腦內降解β淀粉樣蛋白Amyloid-beta,Aβ的限速酶)的蛋白和mRNA表達的變化。結果 FTS在20 μmol/L(0.35±0.06)以下時對HBEC-5i活力無明顯影響(P>0.05),HIV-1 Tat能抑制HBEC-5i的ZO-1、NEP蛋白(0.53±0.07,P<0.01;0.40±0.04,P<0.05)與mRNA(0.42±0.10,P<0.05;0.31±0.09,P<0.05)的表達。用FTS阻斷Ras信號通路后可顯著增加ZO-1、NEP蛋白(1.20±0.22,P<0.01;0.58±0.03,P<0.05)及mRNA(1.10±0.19,P<0.05;0.97±0.38,P<0.05)的表達。結論 HIV-1 Tat可促進緊密連接蛋白ZO-1蛋白和mRNA下調而導致血腦屏障破壞,同時誘導腦內腦啡肽酶NEP蛋白和mRNA下調,可能導致Aβ在腦內沉積增加。阻斷Ras信號傳導通路可抑制HIV-1 Tat誘導的ZO-1和NEP破壞,可能減少Aβ在腦內的沉積。
HIV-1 Tat; Ras信號通路; ZO-1; NEP
HIV-1流行病學顯示,感染人類免疫缺陷病毒(human immunodeficiency virus-1,HIV-1)的老年人口不斷增加,成為一個新興發展的感染人群[1]。已證實,HIV-1感染者大腦一個顯著特點是腦內β淀粉樣蛋白(Amyloid-beta,Aβ)沉積增加[2~4]。老年人感染HIV-1病毒后更易發展為HIV-1相關性癡呆(HIV-associated dementia,HAD)[3,5]。HIV-1反式轉錄因子(HIV transactivator of transcription,HIV-1 Tat)能輕易進入腦血管內皮細胞,刺激炎癥反應,改變緊密連接蛋白的表達[6]。有研究證實HIV-1 Tat可通過激活Ras信號通路而影響腦血管內皮細胞[1]。HIV-1 Tat蛋白能抑制腦啡肽酶(neprilysin,NEP),抑制小神經膠質細胞吞噬Aβ,損害神經細胞,促使Aβ斑塊形成[7],導致神經功能紊亂[8]。NEP是主要的內源性Aβ降解酶[9],NEP對腦中Aβ1-40的降解部分通過血腦屏障的流出轉運[10]。我們既往研究發現HIV-1 Tat能破壞人腦微血管細胞中的緊密連接蛋白Occludin,促進晚期糖基化終產物受體(RAGE)過表達[11]并下調脂蛋白受體相關蛋白(LRP1),而阻斷Rho/ROCK信號通路可有效抑制HIV-1 Tat對腦微血管細胞的不利影響,從而可能減少Aβ在腦微血管細胞中的沉積[12]。本研究以人腦微血管內皮細胞系(HBEC-5i)體外培養作為血腦屏障(BBB)模型,觀察Ras信號通路抑制劑法尼基硫代水楊酸(farnesylthiosalicylic acid,FTS)對HIV-1 Tat誘導緊密連接ZO-1蛋白破壞和NEP表達的影響,探討Ras信號通路在HIV-1 Tat誘導Aβ腦內沉積的作用機制,為臨床防治HIV-1相關性癡呆提供新的思路及依據。
1 材料與方法
1.1 實驗試劑 內皮細胞培養基(DMEM:F12 Medium)、0.1%明膠溶液、內皮細胞生長添加劑(endothelial growth supplement,ECGS)均購自ATCC公司,胎牛血清(FBS)購自Gibco公司,法尼基硫代水楊酸(FTS)、四甲基偶氮唑鹽(MTT)購自Sigma公司,重組HIV-1 Tat clade-B購自ProSpec公司,二喹啉甲酸(Bicinchoninic acid,BCA)蛋白濃度測定試劑盒購自碧云天生物技術研究所,ZO-1抗體、NEP抗體購自abcam公司,GAPDH內參蛋白抗體購自Proteintech公司,熒光二抗購自LI-COR公司,TRIzol、逆轉錄試劑盒、Taq PCR Master Mix kit均購自Takara公司。
1.2 主要試劑配制 DMEM:F12完全培養基的配制:100 ml DMEM:F12中需加入10%(體積分數)胎牛血清、40 μg/ml內皮細胞生長添加劑(ECGS)、1%青霉素-鏈霉素。HIV-1 Tat配制:HIV-1 Tat短暫離心后于超凈工作臺中用超純水完全溶解,制成100 μg/ml儲存液,分裝后于-80℃保存,HIV-1 Tat能與血清結合,HIV-1 Tat干預實驗都在無血清條件下進行。FTS配制:FTS短暫離心后于超凈臺中用二甲基亞砜(DMSO)完全溶解,制成0.1 mol/L儲存液,分裝后于-20 ℃保存。
1.3 細胞培養 人腦微血管內皮細胞系(HBEC-5i)來源于人腦微血管內皮細胞,購自ATCC公司。將人腦微血管內皮細胞系(HBEC-5i)種植于0.1%明膠溶液(ATCC)包被過的25 cm2培養瓶(Corning)內,加入3~4 ml DMEM:F12完全培養基,置于37 ℃、5%CO2培養箱內培養,根據培養基顏色及細胞生長情況,1~2 d換液一次,待細胞達80%以上融合即可傳代。
1.4 實驗分組及處理 (1)FTS對細胞活力影響的檢測:用不同濃度梯度的FTS(0、5、10、20、30、40、50 μmol/L)處理HBEC-5i細胞24 h,四甲基偶氮唑鹽(MTT法)檢測細胞活力;(2)蛋白免疫印跡法檢測HBEC-5i中ZO-1、NEP蛋白的表達:實驗分為4組:對照組(0.01%DMSO)、1 μg/ml HIV-1 Tat處理組、5 μmol/L FTS干預組、5 μmol/L FTS干預+1 μg/ml HIV-1 Tat處理組,處理細胞24 h后收集細胞提取細胞總蛋白;(3)實時反轉錄聚合酶鏈式反應(RT-PCR法)檢測HBEC-5i中ZO-1、NEP的mRNA表達:實驗分組同上,處理細胞12 h后收集細胞提取總RNA。FTS預處理細胞3 h后再加入HIV-1 Tat[13]。
1.5 四甲基偶氮唑鹽(MTT法)檢測細胞活力 對數生長期HBEC-5i細胞達80%~90%融合時,用0.25%胰蛋白酶消化,離心后重懸,以每孔1×104個細胞接種于96孔板(Corning),每個濃度梯度設6個復孔,置于培養箱中培養12 h,待細胞貼壁生長良好,在無血清條件下以不同濃度FTS(0 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L、30 μmol/L、40 μmol/L、50 μmol/L)處理細胞24 h,每孔加入20 μl MTT(5 mg/ml)放入培養箱中繼續培養,4 h后輕柔吸棄上清,每孔加入150 μl二甲基亞砜(DMSO),振蕩10 min使結晶充分溶解,用酶標儀測定吸光度值(波長570 nm)。
1.6 Western blot法檢測HBEC-5i中ZO-1、NEP蛋白的表達量 將HBEC-5i接種于六孔板(JET BIOFIL),按實驗方案處理后,用預冷的1×磷酸鹽緩沖液(PBS)清洗細胞3次,冰上用RIPA裂解液提取細胞總蛋白,4 ℃ 12000 r/min離心15 min,收集上清液,BCA蛋白定量試劑盒測定總蛋白濃度,每道上樣20 μg蛋白,在8%或5%SDS聚丙酰胺凝膠電泳分離蛋白后轉移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用5%脫脂奶粉封閉30 min,分別加入ZO-1一抗(1∶400)、NEP一抗(1∶400)、內參GAPDH(1∶5000),4 ℃孵育過夜,次日用1×三乙醇胺緩沖鹽水加吐溫20溶液(Tris Buffered Saline,with Tween-20,TBST)緩沖液洗膜5 min×4次后加入熒光二抗,室溫搖床孵育1 h,1×TBST緩沖液洗膜5 min×4次,用熒光掃膜儀掃膜,用Image-J圖像分析軟件對電泳條帶進行分析,以ZO-1、NEP灰度值與內參GAPDH灰度值的比值反映ZO-1、NEP蛋白相對表達量。
1.7 實時反轉錄聚合酶鏈式反應(RT-PCR法)檢測HBEC-5i中ZO-1、NEP的mRNA表達 將HBEC-5i接種于六孔板,按實驗方案處理細胞,用TRIzol法提取細胞總RNA,按逆轉錄試劑盒說明書逆轉錄合成cDNA,應用StepOne Plus序列檢測系統進行PCR擴增,程序為:95 ℃預變性30 s,然后進行PCR反應95 ℃ 5 s、60 ℃ 30 s,20 μl體系共進行40個循環。引物序列分別為:ZO-1:5’-GACCAATAGCTGATGTTGCCAGAG-3’和5’-TGCAGGCGAATAATGCCAGA-3’;NEP:5’-TAAGCAGCCTCAGCCGAACC-3’和5’-TTGACATAGTTTGCACAACGTCTCC-3’;GAPDH:5’-GCACCGTCAAGGCTGAGAAC-3’和5’-TGGTGAAGACGCCAGTGGA-3’。每組實驗結果取至少3個復孔的均值作為一次獨立實驗結果,取3次獨立實驗結果做統計學分析,以2-△△Ct法計算mRNA相對表達量。每個樣品通過管家基因GAPDH作為內參使目標基因標準化。
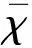
2 結 果
2.1 不同濃度FTS對人腦微血管內皮細胞活力的影響 不同濃度梯度FTS處理HBEC-5i 24 h后,以空白組為對照(0.38±0.03),當FTS濃度大于20 μmol/L(0.35±0.06)時,對HBEC-5i有明顯的抑制作用,且隨著FTS濃度增高,其對HBEC-5i活性的抑制作用增強。因此,選擇FTS5 μmol/L(0.41±0.07,P>0.05)作為后續實驗的處理濃度(見圖1)。
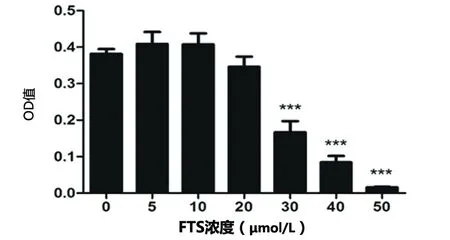
2.2 不同處理對HBEC-5i中ZO-1、NEP蛋白水平的影響 與對照組(1.24±0.37,0.55±0.05)相比,HIV-1 Tat組ZO-1蛋白(0.53±0.07,P<0.01)、NEP蛋白(0.40±0.04,P<0.05)水平顯著降低;與HIV-1 Tat組相比,FTS預處理組ZO-1蛋白(1.20±0.22,P<0.01)、NEP蛋白(0.58±0.03,P<0.05)水平顯著增加(見圖2)。
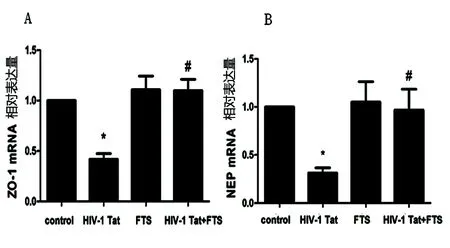
2.3 不同處理對HBEC-5i中ZO-1、NEP mRNA水平的影響 與對照組(1.00±0.00)相比,HIV-1 Tat組的ZO-1(0.42±0.10,P<0.05)、NEP(0.31±0.09,P<0.05)的mRNA顯著降低;與HIV-1 Tat組相比,FTS預處理組的ZO-1(1.10±0.19,P<0.05)、NEP(0.97±0.38,P<0.05)mRNA水平顯著增加(見圖3)。
與對照組相比*P<0.05,**P<0.01,***P<0.001
圖1 MTT法檢測不同濃度FTS對HBEC-5i細胞活力的影響(n=4,F=46.311)
與對照組相比*P<0.05,**P<0.01;與HIV-1 Tat組相比#P<0.05,##P<0.01
圖2 不同處理對人腦微血管內皮細胞HBEC-5i中ZO-1、NEP蛋白表達的影響(A:n=3,F=6.816;B:n=3,F=12.25)
與對照組相比*P<0.05;與HIV-1 Tat組相比#P<0.05
圖3 不同處理對人腦微血管內皮細胞HBEC-5i中ZO-1、NEP mRNA表達的影響(A:n=3,F=12.95;B:n=3,F=5.108)
3 討 論
血腦屏障由腦微血管內皮細胞、星形膠質細胞終足和周細胞構成,緊密連接是其必不可少的組成部分,在血腦屏障完整性的調節中緊密連接是主要的結構和功能基礎[14]。正常情況下,腦血管內皮細胞與內皮細胞間的緊密連接相結合形成一層無孔的內皮使血腦屏障能選擇性滲透外圍蛋白質和其他分子,緊密連接提供了高跨內皮細胞電阻(transendothelial electrical resistance,TEER),進一步限制多種類型的大分子物質通透[15]。
ZO-1作為支架分子調節跨膜緊密連接與肌動蛋白細胞骨架之間的聯系,在維持血腦屏障的重要屬性包括阻力和滲透率中起著重要作用[16]。HIV-1 Tat蛋白是一種轉錄調節因子,對病毒的生命周期至關重要,能誘導炎癥、毒性以及損傷多種細胞類型包括神經元、星形膠質細胞、單核細胞和腦血管內皮細胞[17]。
血腦屏障在HIV-1感染與淀粉樣變性中都有很重要的作用,調節血源性淀粉樣蛋白進入腦內以及大腦對淀粉樣蛋白的清除[4]。血腦屏障被認為在艾滋病相關性癡呆(HAD)的發展中發揮重要作用,有研究顯示,相比于非癡呆艾滋病患者或對照組患者,艾滋病相關性癡呆患者中血腦屏障破壞更常見[18]。Tat蛋白不僅具有神經毒性,也已被證明能夠破壞血腦屏障的完整性[19]。Lei Chen等人研究觀察到HIV-1 Tat時間依賴性地提高小鼠血腦屏障(BBB)通透性,在人腦微血管內皮細胞中也同樣觀察到HIV-1 Tat誘導的血腦屏障(BBB)通透性增加及白細胞的黏附與遷移增加[5]。
本研究也觀察到,HIV-1 Tat刺激HBEC-5i后ZO-1蛋白和mRNA的表達量下降(見圖2A、圖3A),從而驗證了HIV-1 Tat在轉錄和翻譯水平可誘導ZO-1蛋白和mRNA表達的下調,進而影響HBEC-5i細胞間的緊密連接形成。
腦啡肽酶(neprilysin,NEP)也稱為CD10,是一種細胞表面含鋅的金屬內切酶,能夠降解小分子肽如緩激肽、P物質、腦啡肽等[20,21]。近年來,NEP在Aβ分解代謝中的作用逐漸引起重視,被認為是腦內關鍵的Aβ降解酶[20~22],已證實能夠降解Aβ單體[22],在類似NEP的同系物中NEP具有降解Aβ1-40與Aβ1-42最強活性[21],在NEP敲除小鼠腦內Aβ40與Aβ42水平顯著上升[22]。Rempel HC等人研究觀察到腦內NEP蛋白表達量與NEP酶活性成線性關系,HIV-1 Tat能夠特定地抑制NEP活性,增加腦組織內Aβ沉積[21]。本研究中也觀察到HIV-1 Tat能誘導HBEC-5i中NEP蛋白與mRNA的下調,使NEP降解Aβ的活性降低,同時誘導ZO-1蛋白下調、破壞血腦屏障,導致腦內Aβ沉積增加。Ras信號通路抑制劑法尼基硫代水楊酸(FTS)能夠減弱HIV-1 Tat的作用,使ZO-1表達上調,保護血腦屏障,上調NEP蛋白水平,可能減少Aβ在腦細胞內的沉積。
HIV-1 Tat能促進Aβ在腦內的沉積,但在艾滋病患者中艾滋病相關性癡呆發生的介導機制目前尚不清楚[7]。已證實,許多的細胞信號通路參與緊密連接蛋白的調節,而Ras信號轉導通路與氧化應激有關[23]。Ras信號通路調節細胞生長、分化、運動和死亡等細胞過程,是許多信號通路的主要交叉點,Ras信號通過下游效應器Mitogen-activated protein kinase kinase(MEK)/Extracellular signal-regulated kinases(ERK)發揮作用,有研究顯示Ras信號通路參與緊密連接蛋白表達的調節,與血腦屏障通透性密切相關[13]。有研究顯示,在Tat刺激的腦血管內皮細胞中觀察到劑量依賴性氧化應激增加及細胞內谷胱甘肽減少[18],細胞內活性氧(reactive oxygen species,ROS)是Ras/ERK信號轉導通路重要的第二信使,HIV-1 Tat能激活Ras,誘導細胞內活性氧增加,通過Ras/ERK介導緊密連接蛋白的破壞[23],然而目前尚不清楚Ras信號通路是否參與調節HIV-1 Tat蛋白誘導Aβ沉積。
本研究中用Ras信號通路抑制劑FTS預處理HBEC-5i細胞,與HIV-1 Tat共培養發現FTS可減弱HIV-1 Tat對ZO-1及NEP蛋白與mRNA的抑制作用,上調ZO-1與NEP蛋白及mRNA表達(見圖2、圖3),推測可能與抑制Ras信號通路活性減少HIV-1 Tat誘導的氧化應激有關。
綜上,HIV-1 Tat可誘導緊密連接蛋白ZO-1下調導致血腦屏障破壞,同時抑制NEP表達,本實驗研究證實HIV-1 Tat可通過激活Ras信號轉導通路下調人腦微血管內皮細胞(HBEC-5i)緊密連接ZO-1蛋白與mRNA,導致血腦屏障破壞,同時抑制NEP的表達,影響Aβ在腦內的沉積。這些發現對HIV-1感染促進中樞系統Aβ沉積的可能機制提供了新的認識,將Ras信號通路作為目標可能對艾滋病相關性癡呆提供一個新的治療途徑。
[1]Andras IE,Eum SY,Toborek M.Lipid rafts and functional caveolae regulate HIV-induced amyloid beta accumulation in brain endothelial cells[J].Biochem Biophys Res Commun,2012,421(2):177-183.
[2]Andras IE,Eum SY,Huang W,et al.HIV-1-induced amyloid beta accumulation in brain endothelial cells is attenuated by simvastatin[J].Mol Cell Neurosci,2010,43(2):232-243.
[3]Chen X,Hui L,Geiger NH,et al.Endolysosome involvement in HIV-1 transactivator protein-induced neuronal amyloid beta production[J].Neurobiol Aging,2013,34(10):2370-2378.
[4]Andras IE,Toborek M.HIV-1 stimulates nuclear entry of amyloid beta via dynamin dependent EEA1 and TGF-beta/Smad signaling[J].Exp Cell Res,2014,323(1):66-76.
[5]Chen L,Choi JJ,Choi YJ,et al.HIV-1 Tat-induced cerebrovascular toxicity is enhanced in mice with amyloid deposits[J].Neurobiol Aging,2012,33(8):1579-1590.
[6]Andras IE,Rha G,Huang W,et al.Simvastatin protects against amyloid beta and HIV-1 Tat-induced promoter activities of inflammatory genes in brain endothelial cells[J].Mol Pharmacol,2008,73(5):1424-1433.
[7]Kim J,Yoon JH,Kim YS.HIV-1 Tat interacts with and regulates the localization and processing of amyloid precursor protein [J].PLoS One,2013,8(11):e77972.
[8]Huang W,Rha GB,Han MJ,et al.PPARalpha and PPARgamma effectively protect against HIV-induced inflammatory responses in brain endothelial cells[J].J Neurochem,2008,107(2):497-509.
[9]Chen PT,Chen CL,Lin LT,et al.Design of peptide substrate for sensitively and specifically detecting two abeta-degrading enzymes:neprilysin and angiotensin-converting enzyme[J].PLoS One,2016,11(4):e0153360.
[10]Ito S,Matsumiya K,Ohtsuki S,et al.Contributions of degradation and brain-to-blood elimination across the blood-brain barrier to cerebral clearance of human amyloid-beta peptide(1-40) in mouse brain[J].J Cereb Blood Flow Metab,2013,33(11):1770-1777.
[11]陳艷蘭,黃 文,巫相宏,等.Rho/ROCK信號通路在HIV-1 Tat誘導血腦屏障破壞及β淀粉樣蛋白沉積中的作用[J].中風與神經疾病雜志,2015,32(12):1060-1063.
[12]Chen Y,Huang W,Jiang W,et al.HIV-1 Tat regulates occludin and abeta transfer receptor expression in brain endothelial cells via Rho/ROCK signaling pathway[J].Oxid Med Cell Longev,2016,4196572.
[13]Zhong Y,Smart EJ,Weksler B,et al.Caveolin-1 regulates human immunodeficiency virus-1 Tat-induced alterations of tight junction protein expression via modulation of the Ras signaling[J].J Neurosci,2008,28(31):7788-7796.
[14]Huang W,Eum SY,Andras IE,et al.PPARalpha and PPARgamma attenuate HIV-induced dysregulation of tight junction proteins by modulations of matrix metalloproteinase and proteasome activities[J].FASEB J,2009,23(5):1596-1606.
[15]Strazza M,Pirrone V,Wigdahl B,et al.Breaking down the barrier: the effects of HIV-1 on the blood-brain barrier[J].Brain Res,2011,1399:96-115.
[16]Alluri H,Wilson RL,Anasooya Shaji C,et al.Melatonin Prpserves blood-brain barrier integrity and permeability via matrix metalloproteinase-9 inhibition[J].PLoS One,2016,11(5):e0154427.
[17]Woollard SM,Bhargavan B,Yu F,et al.Differential effects of Tat proteins derived from HIV-1 subtypes B and recombinant CRF02_AG on human brain microvascular endothelial cells: implications for blood-brain barrier dysfunction[J].J Cereb Blood Flow Metab,2014,34(6):1047-1059.
[18]Banerjee A,Zhang X,Manda KR,et al.HIV proteins (gp120 and Tat) and methamphetamine in oxidative stress-induced damage in the brain:potential role of the thiol antioxidant N-acetylcysteine amide[J].Free Radic Biol Med,2010,48(10):1388-1398.
[19]Niu F,Yao H,Zhang W,et al.Tat 101-mediated enhancement of brain pericyte migration involves platelet-derived growth factor subunit B homodimer: implications for human immunodeficiency virus-associated neurocognitive disorders[J].J Neurosci,2014,34(35):11812-11825.
[20]Brian Spencer RaM,Ryan Gindi,et al.Peripheral delivery of a CNS targeted,metalo-protease reduces Aβ toxicity in a mouse of Alzheimer’s disease [J].PLoS One,2011,6(1):e16575.
[21]Rempel HC,Pulliam L.HIV-1 Tat inhibits neprilysin and elevates amyloid beta[J].AIDS,2005,19:127-135.
[22]Liu M,Guo H,Li C,et al.Cognitive improvement of compound danshen in an Abeta25-35 peptide-induced rat model of Alzheimer’s isease[J].BMC Complement Altern Med,2015,15:382-391.
[23]Dalvi P,Wang K,Mermis J,et al.HIV-1/cocaine induced oxidative stress disrupts tight junction protein-1 in human pulmonary microvascular endothelial cells:role of Ras/ERK1/2 pathway[J].PLoS One,2014,9(1):e85246.
The role of Ras signaling pathway in HIV-1 Tat induced dysfunction of ZO-1 and Neprilysin
JIANGWenlin,HUANGWen,CHENYanlan,etal.
(DepartmentofNeurology,FirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To evaluate the role of Ras singnaling pathway in HIV-1 Tat-induced dysfunction of ZO-1 and neprilysin (NEP,endogenous Aβ-degrading enzyme) in human cerebral microvascular endothelium cells (HBEC-5i). Methods HBEC-5i viability was tested by MTT assay,with the exposure of different concentrations of Ras inhibitor farnesylthiosalicylic acid (FTS).The levels of protein and mRNA of ZO-1 and NEP in HBEC-5i were evaluated with Western blot and Real-time reverse transcription polymerase chain reaction (qRT-PCR) assay respectively.Results Farnesylthiosalicylic acid at 20 μmol/L (0.35±0.06,P>0.05) or less had no significant effect on the HBEC-5i cell viability as determined by the MTT assay.Treatment with HIV-1 Tat decreased protein and mRNA levels of ZO-1 (0.53±0.07,P<0.01 in protein levels;0.42±0.10,P<0.05 in mRNA levels) and NEP (0.40±0.04,P<0.05 in protein levels;0.31±0.09,P<0.05 in mRNA levels).While inhibition of Ras by FTS effectively protected against HIV-1 Tat-induced downregulation of ZO-1 (1.20±0.22,P<0.01 in protein levels;1.10±0.19,P<0.05,in mRNA levels) and NEP(0.58±0.03,P<0.05 in protein levels;0.97±0.38,P<0.05 in mRNA levels) expression.Conclusion These results show that HIV-1 Tat induces dysfunction of ZO-1 and neprilysin in both protein and mRNA levels and these effects can be attenuated by FTS.Ras signaling pathway plays a role in HIV-1 Tat-induced ZO-1 dysfunction and neprilysin in cerebral microvascular endothelial cells.
HIV-1 Tat; Ras signaling pathway; ZO-1; NEP
2016-10-14;
2016-11-29
國家自然科學基金(No.81371333)
(1.廣西醫科大學第一附屬醫院神經內科,廣西 南寧 530021;2.廣西廣西壯族自治區南溪山醫院神經內科,廣西 桂林 541000)
黃 文,E-mail:hwen1229@163.com
1003-2754(2017)02-0100-05
R749.1+1
A

