基于化學基本觀念“微粒觀”的教學設計
董靜++李峰

摘要:魯教版義務教育教科書對微粒觀這一化學基本觀念,在不同的單元中都有滲透,其中“酸的性質”這一節尤為突出.我們從微粒觀的視角進行教學,能夠更好的把握問題的本質,明確酸具有通性的原因.
關鍵詞:鹽酸、硫酸,微粒觀
作者簡介:董靜(1971-),1971年3月生,女,山東省淄博市高青雙語學校化學教師,大學學歷,中學一級教師;李峰(1973-),男,山東省淄博市高青縣教學研究室化學教研員,大學學歷,中學一級教師.微粒觀是化學的基本觀念之一,微粒觀包括微粒的構成觀、運動觀、變化觀等,而酸的性質就是由構成酸的微粒H+決定的,下面以魯教版初中化學教材“酸的性質”教學為例加以設計.
一、教學目標
1.知識與技能
(1)了解酸的涵義.(2)了解酸的化學性質,能認識到酸的性質實質就是H+的性質.(3)能用化學方程式表述鹽酸和硫酸的化學性質.
2.過程與方法
(1)初步學會運用比較、分類、歸納、概括等方法.
(2)初步學會運用觀察、實驗等方法獲取信息.
(3)初步學會運用微粒觀學習物質的化學性質.
3.情感態度價值觀
(1)培養學生實事求是的科學態度.
(2)發展學生善于合作、勤于思考、嚴謹求實、勇于創新和實踐的科學精神.
二、教學過程
1.導入
【教師】以食醋為例,引入一類化學物質——酸,在組成、結構、性質上有什么特點呢?酸溶于水后都能解離出相同的陽離子氫離子(H+),下面我們就以鹽酸為例來探究酸的性質.
2.實驗探究
【投影】鹽酸溶液中存在的微粒有哪些?投影模擬展示溶液中自由運動的微粒:水分子、H+、Cl-
【學生】實驗探究2-1:鹽酸能與哪些物質發生化學反應?學生分組實驗,填寫實驗報告(表1,表2).
表1
操作取少量稀鹽酸,滴入石蕊試液取少量稀鹽酸,滴入酚酞試液現象試液變紅無明顯現象表2
物質鎂條生銹鐵釘硝酸銀溶液氯化鋇溶液加入稀鹽酸后
的現象有氣泡產生鐵釘容解溶
液為黃色產生白色
沉淀無明顯
現象【教師】哪位同學匯報一下實驗中觀察到的現象?
【學生】取少量稀鹽酸,滴加石蕊試液,現象為試液變紅色;取少量稀鹽酸,滴加酚酞試液,無明顯現象;鎂條遇稀鹽酸,有氣泡產生;碳酸鈉遇稀鹽酸,現象為有氣泡產生,碳酸鈉粉末消失;生銹鐵釘遇稀鹽酸,現象為鐵銹溶解,溶液變為黃色;硝酸銀溶液遇稀鹽酸,有白色沉淀產生;氯化鋇溶液遇稀鹽酸,無明顯現象.
【教師追問】依據實驗現象,你能猜想一下這些物質與稀鹽酸反應生成了什么物質嗎?你能嘗試寫出這個反應的化學方程式嗎?
【教師板書】Mg+2HClMgCl2+H2↑Na2CO3+2HCl= 2NaCl+H2O+CO2↑
Fe2O3+6HCl2FeCl3+3H2O
AgNO3+ HClAgCl↓+HNO3
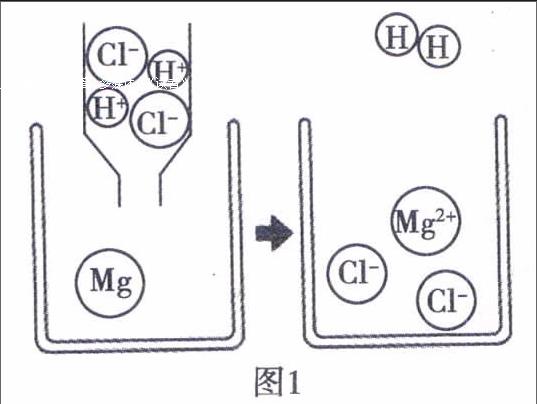
【教師】從微觀上分析,請大家觀察圖1,鎂與稀鹽酸反應產生的氣泡是氫氣,另一種物質是氯化鎂,該反應的實質是鎂與氫離子反應,生成了鎂離子和氫氣.
【教師追問】如果從原子結構的角度進一步分析,這個反應的實質是什么呢?
【學生】學生畫出鎂原子的原子結構示意圖.
【教師】鎂原子失去最外層上的兩個電子,變成鎂離子,鹽酸溶液中的氫離子得到電子變成氫原子,每兩個氫原子構成一個氫分子,大量的氫分子聚集成氫氣.所以,我們可以說該反應的本質是鎂原子的最外層電子轉移給了氫離子,是電子的轉移.
【教師】碳酸鈉遇稀鹽酸,產生的氣體是什么呢?我們如何檢驗生成的氣體?同時還生成了什么物質?
【學生】可將生成的氣體通入澄清的石灰水中,觀察現象.
【學生實驗】將生成的氣體通入澄清石灰水中,石灰水變渾濁.
【實驗結論】碳酸鈉與稀鹽酸反應,產生的氣體是二氧化碳.
【教師】碳酸鈉與稀鹽酸反應除了生成二氧化氣體外,同時還生成了氯化鈉和水.
【教師追問】如果從微粒的角度分析,該反應的實質是怎樣的呢?
請觀察右圖所示,稀鹽酸中有氫離子和氯離子,碳酸鈉溶于水解離出鈉離子
和碳酸根離子,當氫離子遇到碳酸根離子后,會結合成碳酸,碳酸分解成二氧化碳和水,此反應前后氯離子和鈉離子沒有發生變化,所以該反應的實質是氫離子與碳
酸根離子反應,生成了水和二氧化碳.
【教師】當生銹鐵釘遇到稀鹽酸后,觀察到鐵銹消失了,溶液變成黃色.鐵銹的主要成分是Fe2O3,Fe2O3和稀鹽酸反應生成了氯化鐵和水,氯化鐵溶液呈黃色.
【教師追問】如果從微粒的角度分析,該反應的實質是怎樣的呢?請同學們試著出從微粒變化角度分析一下.
【學生】鐵銹與稀鹽酸反應生成了氯化鐵和水.反應后氯化鐵在溶液中解離出鐵離子和氯離子,氯離子反應前后沒有變,所以該反應的實質是氫離子與氧化鐵反應,生成了水和鐵離子.
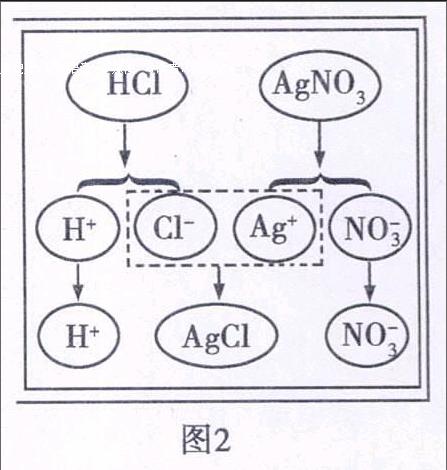
【教師】硝酸銀溶液與稀鹽酸反應,有白色沉淀生成.觀察圖2,請同學們從微粒觀分析反應實質.
【學生】學生書寫化學方程式,AgNO3+ HCl= AgCl↓+HNO3
【投影】提示:氯化銀是一種白色沉淀,既不溶于水也不溶于硝酸.
【教師追問】該反應的實質是什么呢?大家對照著右邊的
示意圖能試著分析一下嗎?
【學生】硝酸銀與稀鹽酸反應生成了氯化銀和硝酸,反應過程硝酸銀解離出銀離子和鹽酸解離出氯離子,結合成難解離的新物質氯化銀,生成白色沉淀,而氫離子和硝酸根離子在反應前后沒有改變,所以該反應的實質是氯離子與銀離子反應,生成了難溶解的氯化銀沉淀.
【教師】分析的很好.下面我再給大家補充一個實驗,向滴有酚酞的氫氧化鈉溶液中滴加稀鹽酸,請同學們注意觀察實驗現象.
【教師演示】小燒杯中加入少量氫氧化鈉溶液,滴入兩滴無色酚酞試液,
溶液變為紅色.然后再向小燒杯中逐滴加入稀鹽酸,觀察現象.
【學生回答】紅色溶液褪成無色.
【教師追問】同學們能寫出該反應的化學方程式嗎?
【學生】學生板書:NaOH+ HCl= NaCl+H2O
【教師追問】同學們能根據右邊的微觀示意圖,解釋該反應的
實質嗎?
【學生】氫氧化鈉在溶液中解離出鈉離子和氫氧根離子,
稀鹽酸解離出氫離子和氯離子.當氫離子遇到氫氧根離子時,
立即結合成難解離的物質水.而溶液中的鈉離子和氯離子并
沒有發生變化.所以該反應的實質是氫離子和氫氧根離子反應
生成水.
【教師】解釋的非常棒.
3.歸納總結
【得出結論】綜上我們研究了稀鹽酸的化學性質,即稀鹽酸能夠與酸堿指示劑、鎂條、硝酸銀溶液、氧化鐵等發生化學反應.我們從微觀角度深入認識了這些反應的實質,可以發現,鹽酸的化學性質,主要就是發生在氫離子或者是氯離子身上.
四、教學反思與啟示
實驗是一種重要的感性認識方法,本節課通過實驗探究培養了學生的動手能力,讓學生在實驗中學會了合作,對學生合作能力的培養起到了很好的作用,鮮明的現象帶給了學生深刻的印象.
微粒觀是化學教學中的重要基本觀念之一,從微粒觀的角度認識化學,能夠深刻認識化學反應的本質,這節課中微觀粒子在反應前后發生的變化,通過圖示或動畫的形式形象、直觀展示出來,學生容易理解,更容易使問題簡單化和實質化.
參考文獻:
[1]畢華林 盧巍.義務教育段八年級化學教科書[M].濟南:山東教育出版社,2016.
[2] 叢祥滋. 義務教育段八年級化學教師教學用書[M].濟南:山東教育出版社,2016.
[3]中華人民共和國教育部. 義務教育化學課程標準(2011年版).[M].北京:人民教育出版社,2011.

