運動性骨骼肌損傷致細胞凋亡的機制
韋雪亮 黃 玲 岑人軍
(廣西大學體育學院體育訓練系,廣西 桂林 530004)
運動性骨骼肌損傷致細胞凋亡的機制
韋雪亮 黃 玲1岑人軍
(廣西大學體育學院體育訓練系,廣西 桂林 530004)
目的 探討運動性骨骼肌損傷引起細胞凋亡的機制。方法 選取健康8周齡雄性SD大鼠40只,隨機分為安靜對照組和力竭運動組,每組20只。采用一次力竭性跑臺運動。力竭運動后24 h,應用流式細胞儀AnnexinV-FITC雙染法檢測細胞膜表面的磷酯酰絲氨酸測定骨骼肌細胞凋亡率。應用Western印跡技術測定骨骼肌細胞Bcl-2及Bax表達水平。結果 力竭運動后24 h,力竭運動組與安靜對照組比較,骨骼肌細胞凋亡率明顯增加(P<0.01),Bcl-2表達水平降低(P<0.01),Bax表達水平升高(P<0.01)。結論 力竭運動可以引起骨骼肌細胞損傷發生細胞凋亡,其機制可能為下調Bcl-2表達、上調Bax表達,促進細胞凋亡。
力竭運動;骨骼肌;凋亡;Bcl-2;Bax
力竭運動可以導致骨骼肌的損傷。近年研究發現這種損傷不僅表現為機體氧化應激反應增強、氧化與抗氧化系統失衡、影響骨骼肌正常功能,還可使骨骼肌細胞凋亡增加〔1〕。但關于運動性骨骼肌損傷后細胞凋亡機制的研究較少。基于此,本課題通過觀察一次力竭運動對大鼠骨骼肌細胞凋亡及Bcl-2及Bax表達的影響,探討運動性骨骼肌損傷引起細胞凋亡的機制。
1 材料與方法
1.1 動物 選取健康8周齡雄性SD大鼠40只,平均體重(200±20)g。給大鼠編號,按照數字表隨機分為安靜對照組和力竭運動組,每組20只。各組大鼠體重無統計學差異,飼養條件:室內溫度20℃~25℃,濕度45%±5%,分籠飼養,自由飲水,自然晝夜節律變化光照。
1.2 方法 實驗前3 d對全部大鼠進行預適應跑臺訓練,參數:坡度0°,速度10 m/min,時間10 min。正式實驗采用一次力竭性跑臺運動,參數:坡度-16°,速度16 m/min,總運動時間200 min(中間5 min休息)。在運動初始,大鼠行為無異常,跑步速度均勻,步態穩定;隨著時間推移開始出現不能持續運動,四肢沉重無力,漸漸不能支撐軀體,腹部接近跑臺。當運動至200 min時,大鼠腹部皮毛濕潤,四足腫脹,呼吸不均,精神呆滯,反應變慢,基本無逃避反應。此時,根據大鼠力竭判斷標準確定大鼠已經力竭。
1.3 標本的取材處理與觀察指標
1.3.1 流式細胞儀Annexin V/PI雙染技術測定大鼠骨骼肌細胞凋亡率 力竭運動后24 h,選取相應組別大鼠,腹腔麻醉,分離、切除肱三頭肌,小心修剪,剔除筋膜、血管、神經、脂肪等組織,然后將骨骼肌剪碎,通過不銹鋼網(100目)進行加壓過濾,加入RPMI1640培養液,4℃靜置5 min,收集上清液,4℃、3 500 r/min、10 min 離心,棄上清,加入細胞裂解液3 ml,吹打混勻,再次4℃、3 500 r/min、10 min 離心,再次用RPMI1640培養液洗滌2次,然后用全自動細胞計數器計數,調整細胞濃度,最終制成的骨骼肌單細胞混懸液濃度為5×105/ml。然后應用碧云天AnnexinV-FITC細胞凋亡檢測試劑盒,應用流式細胞儀檢測細胞膜表面的磷酯酰絲氨酸測定骨骼肌細胞凋亡率。具體操作步驟按照試劑說明書進行。結果判斷:正常細胞Annexin V及PI均低染(Annexin V-,PI-),分布在左下區;早期細胞凋亡Annexin V高染,PI低染(Annexin V+,PI-),分布在右下區;晚期凋亡及壞死細胞Annexin V及PI均高染(Annexin V+,P+),分布在右上區。
1.3.2 Western印跡技術測定骨骼肌細胞Bcl-2及Bax表達 同樣方法取大鼠肱三頭肌標本100 mg,在勻漿器中勻漿,加細胞裂解液后冰上裂解30 min,然后離心4℃、12 000 r/min、15 min,最后提取蛋白上清液,并進行濃度測定。測定結束后,加上樣緩沖液,然后混勻,100℃沸水中變性3 min,最后在-20℃冰箱中保存備用。Western印跡檢測依照配制分離膠和基層膠,制膠板;加樣;電泳;轉膜;封閉,一抗過夜孵育,二抗孵育,曝光順序進行。提取、變性、測定蛋白濃度按照碧云天Western及IP細胞裂解液說明書進行。配置分離膠的濃度為10%。加樣蛋白總量30 μg。電泳前半小時電壓為110 V,后1 h為75 V。轉膜時間為2 h。一抗Bcl-2、Bax選擇CST公司。二抗選擇北京中杉金橋公司。曝光選擇康為高靈敏度發光劑,具體操作按照試劑說明書進行。結果采用gel-pro圖像分析軟件進行分析,計算灰度值。
1.4 統計學方法 應用SPSS19.0軟件行t檢驗。
2 結 果
力竭運動后24 h,力竭運動組與安靜對照組比較骨骼肌細胞凋亡率明顯增加(P<0.01),Bcl-2表達水平降低(P<0.01),Bax表達水平升高(P<0.01)。見表1,圖1。
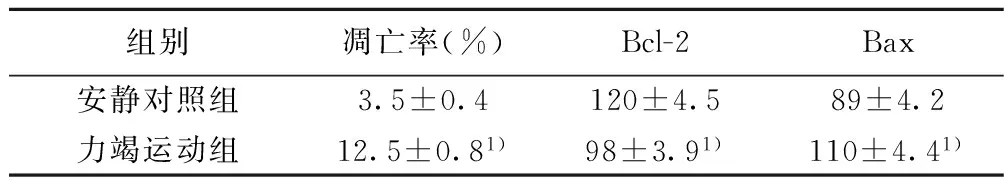
表1 力竭運動對大鼠骨骼肌細胞凋亡及Bcl-2、 Bax表達的影響(n=20)
與安靜對照組比較:1)P<0.01

圖1 力竭運動對大鼠骨骼肌細胞Bcl-2及Bax表達的影響
3 討 論
運動性骨骼肌損傷的概念是指在訓練或者運動的過程中,因局部骨骼肌過于用力或者負荷較大,超出了機體正常所能承受的范圍,同時運動后的肌肉未得到有效休息及恢復,從而導致骨骼肌組織發生損傷。運動性骨骼肌損傷不但包括骨骼肌解剖組織超微結構的異常,而且還可伴有分子、基因、蛋白水平的異常。雖然運動引起骨骼肌損傷的機制目前尚不完全清楚,但可能機制包括:①機械損傷假說;②自由基損傷學說;③鈣離子超載學說;④急性炎癥反應學說等。過去一段時間研究也大多集中在上述學說〔2~6〕。但近年相關研究發現骨骼肌損傷還與骨骼肌細胞凋亡有關。宋衛紅等〔7〕對大鼠進行重復3 d 的力竭離心運動,然后采用TUNNEL法檢測大鼠肱三頭肌細胞凋亡,發現運動組凋亡指數明顯高于對照組,運動即刻凋亡指數開始升高,24 h 達到峰值,48 h 凋亡指數有所下降。趙曉琴〔8〕實驗研究亦發現離心運動可以引起骨骼肌細胞凋亡。任文寧〔9〕實驗研究發現大強度有氧運動可以促進大鼠骨骼肌細胞凋亡,并且對比目魚肌細胞凋亡的促進程度大于腓腸肌細胞凋亡。本研究表明一次力竭運動可以引起骨骼肌細胞發生凋亡。
細胞凋亡是細胞程序化死亡,是機體不可或缺的生命過程,是機體進行正常新陳代謝的前提條件。機體介導細胞凋亡的途徑除了最常見的線粒體途徑外,還包括死亡受體途徑與內質網途徑。研究最多的線粒體途徑是指當細胞接收到凋亡信號刺激后,使Bax亞族蛋白寡聚化進入線粒體,線粒體釋放相應化學物質形成凋亡體,從而引起細胞凋亡。線粒體凋亡途徑的實現受多種基因調控,其中最重要的是Bcl-2家族。而Bcl-2家族最常見基因包括〔10〕:①抗細胞凋亡基因,以Bcl-2為代表,其又被稱為原癌基因。②促進細胞凋亡基因,以Bax為代表,又被稱為抑癌基因。③Bcl-2同源基因,以Bik、Blk、Bad和Bid等為代表,具有促進細胞凋亡作用。Bax促進細胞凋亡的機制除了與Bcl-2蛋白形成異源二聚體,進而失去抑制細胞凋亡活性,還可單獨形成同源二聚體達到促進細胞凋亡作用〔11〕。Bcl-2/Bax異源二聚體在細胞凋亡調節中發揮重要作用,兩者比值決定了細胞凋亡與否:通常來說比值升高可抑制細胞凋亡,而比值下降則促進細胞凋亡。鑒于此,本研究應用Western印跡法測定力竭運動后24 h肱三頭肌組織中Bcl-2及Bax表達情況,表明一次力竭運動引起骨骼肌細胞發生凋亡的機制可能為下調Bcl-2表達、上調Bax表達。李惠翔等〔12〕研究發現力竭訓練大鼠骨骼肌細胞中Bcl-2表達水平顯著下降,而Fas 蛋白表達水平增加,引起骨骼肌細胞發生凋亡,造成骨骼肌損傷。王冬梅等〔13〕研究運動對大鼠骨骼肌線粒體通透性轉換孔及相關凋亡調控基因Bcl-2和Bax表達水平的影響,一次游泳力竭組大鼠骨骼肌線粒體通透性轉換孔開放程度明顯增加(P<0.01),Bcl-2基因表達顯著減少,Bax 基因表達顯著增加,Bcl-2/Bax 比值顯著減小(P<0.01)。說明運動訓練可通過改變線粒體通透性轉換孔的開放、調節Bcl-2/Bax表達,調控骨骼肌細胞凋亡。劉寧寧等〔14〕研究發現有氧運動能優化Bcl-2/Bax的比值,降低骨骼肌細胞凋亡指數,有效減少衰老導致的骨骼肌過度凋亡。因此,通過本次實驗研究結果可得出力竭運動可以引起骨骼肌細胞發生凋亡,其機制可能為下調Bcl-2表達、上調Bax表達。本實驗可為制定適當合理強度運動方案提供科學依據,但本研究只是從線粒體途徑研究誘導凋亡機制,下一步將從其他凋亡途徑進一步探討力竭運動誘導骨骼肌細胞凋亡的機制。
1 王瑞元,苑玉和,馮煒權.一次力竭性離心運動后大鼠骨骼肌β-actin 基因表達及針刺對其影響〔J〕.北京體育大學學報,2002;25(2):189-90.
2 袁建琴,王瑞元,李肅反.離心運動對大鼠骨骼肌結蛋白分布和表達的影響——對骨骼肌損傷機制的研究〔J〕.體育科學,2005;25(6):63-6.
3 魏 源,李良鳴,邢文華,等.運動性骨骼肌微損傷和修復的機制研究〔J〕.廣州體育學院學報,2010;30(5):96-8.
4 Perez AC,Cabral de Oliveira AC,Estevez E,etal.Mitochondrial,sarcoplasmic membrane integrity and protein degradation in heart and skeletal muscle in exercised rats〔J〕.Comp Biochem Physiol Toxicol Pharmacol,2003;134(2):199-206.
5 劉 翔,熊正英.茜草提取物對大強度耐力訓練大鼠股四頭肌ATP酶活性及運動能力影響的實驗研究〔J〕.天津體育學院學報,2006;21(6):514-7.
6 Jonsdottir IH,Schjerling P,Ostrowski K,etal.Muscle contractions induce interleukin-6 mRNA production in rat skeletal muscles〔J〕.J Physiol,2000;528(1):157-63.
7 宋衛紅,湯長發,劉文鋒.離心運動對大鼠骨骼肌細胞凋亡和增殖的影響〔J〕.中國應用生理學雜志,2013;29(1):86-90.
8 趙曉琴.Omi在離心運動誘導骨骼肌細胞凋亡及針刺干預中的作用〔D〕.北京:北京體育大學,2014.
9 任文寧.TRPC1對運動大鼠骨骼肌細胞凋亡的影響研究〔D〕.長沙:湖南師范大學,2012.
10 Engelen MP,Deutz NE,Wouters EF,etal.Enhanced levels of whol-body Protein turnover in patients with chronic obstructive pulmonary disease〔J〕.Am J Res Pir Crit Care Med,2000;162(4 Pt1):1488-92.
11 Mayer B,Oberbauer R.Mitochondrial regulation of apoptosis 〔J〕.News Physiol Sci,2003;18(3):89-94.
12 李惠翔,趙紅軍,李曉莉.不同運動強度訓練對大鼠骨骼肌細胞Bcl-2、FAS表達的影響〔J〕.中外醫療,2008;27(33):12-3.
13 王冬梅,漆正堂,丁樹哲.骨骼肌細胞線粒體通透性轉換孔及bcl-2和bax mRNA表達與運動〔J〕.中國組織工程研究與臨床康復,2011;15(33):6182-6.
14 劉寧寧,李明學,金 雯.有氧運動對衰老大鼠骨骼肌細胞凋亡及Bcl-2和Bax表達的影響〔J〕.江蘇大學學報(醫學版),2013;23(3):229-32,237.
〔2016-08-31修回〕
(編輯 袁左鳴)
韋雪亮(1978-),男,講師,碩士,主要從事體育教學訓練研究。
R685.4
A
1005-9202(2017)04-0829-03;
10.3969/j.issn.1005-9202.2017.04.019
1 廣西醫科大學附屬腫瘤醫院重癥醫學科

