以豆粕粉為氮源的枯草芽孢桿菌液態(tài)發(fā)酵生產(chǎn)納豆激酶
董艷山,高麗,何加亨,胡彪群,范青云,王業(yè)富*
1(武漢大學(xué) 生命科學(xué)學(xué)院,病毒學(xué)國(guó)家重點(diǎn)實(shí)驗(yàn)室,湖北 武漢,430072) 2(武漢真福醫(yī)藥股份有限公司,湖北 武漢,430075)
以豆粕粉為氮源的枯草芽孢桿菌液態(tài)發(fā)酵生產(chǎn)納豆激酶
董艷山1,高麗2,何加亨2,胡彪群2,范青云2,王業(yè)富1*
1(武漢大學(xué) 生命科學(xué)學(xué)院,病毒學(xué)國(guó)家重點(diǎn)實(shí)驗(yàn)室,湖北 武漢,430072) 2(武漢真福醫(yī)藥股份有限公司,湖北 武漢,430075)
枯草芽孢桿菌液態(tài)發(fā)酵通常采用蛋白胨作為氮源生產(chǎn)納豆激酶,導(dǎo)致生產(chǎn)成本過(guò)高,發(fā)酵液中酶活性較低。采用價(jià)格低廉的豆粕粉作為氮源不僅大幅度降低了原料成本,而且顯著提高了發(fā)酵液中的酶活性。在搖瓶實(shí)驗(yàn)中優(yōu)化確定豆粕粉最佳添加量,并在此基礎(chǔ)上優(yōu)化確定了最佳接種量、發(fā)酵液初始pH、發(fā)酵時(shí)間。最終搖瓶發(fā)酵液中酶活達(dá)到5 471 IU/mL,是等量胰蛋白胨作為氮源發(fā)酵的3.6倍。上述搖瓶發(fā)酵參數(shù)進(jìn)一步在7 L發(fā)酵罐和200 L中試水平發(fā)酵罐進(jìn)行驗(yàn)證,并優(yōu)化確定發(fā)酵過(guò)程中控制溶氧水平為30%,納豆激酶活性分別達(dá)到6 717 IU/mL和4 236 IU/mL。
豆粕粉;枯草芽孢桿菌;納豆激酶;發(fā)酵
根據(jù)《中國(guó)居民營(yíng)養(yǎng)與慢性病狀況報(bào)告(2015)》報(bào)告數(shù)據(jù)顯示,我國(guó)心腦血管疾病的死亡率為271.8/10萬(wàn),已成為國(guó)民最主要死因[1]。誘發(fā)心腦血管疾病的根本原因是血栓的形成,而目前市場(chǎng)上溶栓藥物基本都是急救藥物,存在藥效時(shí)間短,出血性副作用等缺陷[2-3]。納豆激酶是由日本科學(xué)家1987年首次在古老的發(fā)酵食物納豆中發(fā)現(xiàn),該酶表現(xiàn)出非常強(qiáng)的纖維蛋白/原水解活性[4]。在動(dòng)物實(shí)驗(yàn)中,納豆激酶無(wú)論是注射還是口服給藥都具有溶解纖維蛋白/原,再通血管的功效[5-15]。并且,該酶制劑在人體試驗(yàn)中,通過(guò)口服用藥也得到了非常好的功效驗(yàn)證[16-19],具有非常好的安全性,基本不會(huì)引起毒副作用[20-23]。
因此,納豆激酶被認(rèn)為是最具發(fā)展前景和市場(chǎng)應(yīng)用價(jià)值的新一代預(yù)防和治療心腦血管疾病的理想天然溶栓藥物。但是,固體發(fā)酵產(chǎn)物納豆中納豆激酶含量非常低,且固體發(fā)酵工藝成本高且費(fèi)時(shí)耗力。近年來(lái)依靠枯草芽孢桿菌液體發(fā)酵生產(chǎn)納豆激酶已經(jīng)成為趨勢(shì)[24-28]。然而,枯草芽孢桿菌液體發(fā)酵存在的主要問(wèn)題是發(fā)酵培養(yǎng)基中使用蛋白胨作為氮源,造成成本過(guò)高,同時(shí)納豆激酶含量還有待進(jìn)一步提高。
綜上,本研究采用廉價(jià)的豆粕粉作為氮源,優(yōu)化了豆粕粉使用濃度。并在此基礎(chǔ)上進(jìn)行了搖瓶發(fā)酵參數(shù)的優(yōu)化,小試與中試規(guī)模的發(fā)酵罐發(fā)酵工藝優(yōu)化與驗(yàn)證。最終發(fā)酵液中納豆激酶活性得到了大幅度的提升,是現(xiàn)有發(fā)酵工藝的3倍以上。從而為枯草芽孢桿菌發(fā)酵生產(chǎn)納豆激酶進(jìn)行食品和藥物開(kāi)發(fā)大幅度縮減了生產(chǎn)成本,并提供了可靠的發(fā)酵工藝。
1 材料與方法
1.1 材料
1.1.1 原料
大豆豆粕粉,為黃豆榨油之后的廢料豆粕經(jīng)過(guò)粉碎制備得到,來(lái)源于山東萬(wàn)得福實(shí)業(yè)集團(tuán)有限公司。
1.1.2 菌種
本課題組自主篩選的1株產(chǎn)納豆激酶枯草芽孢桿菌,由本實(shí)驗(yàn)室自行保存。
1.1.3 主要試劑
胰蛋白胨、酵母提取物,英國(guó)Oxoid公司;葡萄糖、NaH2PO4、Na2HPO4,國(guó)藥集團(tuán)化學(xué)試劑有限公司。
1.2 實(shí)驗(yàn)設(shè)備
7 L發(fā)酵罐,上海保興生物設(shè)備有限公司;200 L發(fā)酵罐,江蘇科海生物設(shè)備有限公司;溶氧,pH電極,梅特勒-托利多儀器有限公司;5424 R離心機(jī),Eppendorf 公司;電子天平 JY,上海浦春計(jì)量?jī)x器有限公司;DH5000電熱恒溫培養(yǎng)箱,天津市泰斯特儀器有限公司;SA-300VA高壓滅菌鍋;SHZ-82氣浴恒溫培養(yǎng)箱,金壇市白塔新寶儀器廠。
1.3 分析方法
1.3.1 枯草芽孢桿菌種子液制備
保藏菌種在YPD固體培養(yǎng)基表面劃線,挑取單菌落接種于YPD液體培養(yǎng)基(250 mL三角瓶含有50 mL培養(yǎng)基)進(jìn)行培養(yǎng)。
1.3.2 枯草芽孢桿菌搖瓶發(fā)酵
所用三角瓶為250 mL量程,發(fā)酵裝液量為50 mL。
(1)豆粕粉濃度優(yōu)化實(shí)驗(yàn):所用發(fā)酵培養(yǎng)基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L,初始pH為7.0。此外,設(shè)置豆粕粉質(zhì)量體積百分比(m/v)分別為2%、3%、4%、5%。接種量為5%。
(2)接種量?jī)?yōu)化實(shí)驗(yàn):所用發(fā)酵培養(yǎng)基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L,初始pH為7.0。豆粕粉含量為豆粕粉濃度實(shí)驗(yàn)優(yōu)化的結(jié)果。接種量為5%。
(3)初始pH優(yōu)化實(shí)驗(yàn):所用發(fā)酵培養(yǎng)基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L,通過(guò)NaOH溶液和鹽酸調(diào)節(jié)發(fā)酵液初始pH分別為5、6、7、8、9。豆粕粉含量為豆粕粉濃度實(shí)驗(yàn)優(yōu)化的結(jié)果。接種量為接種量實(shí)驗(yàn)優(yōu)化結(jié)果。
(4)豆粕粉與胰蛋白胨發(fā)酵實(shí)驗(yàn)對(duì)比:所用發(fā)酵培養(yǎng)基含有葡萄糖10 g/L、 Na2HPO4·12H2O 3 g/L、NaH2PO4·2H2O 1 g/L、MgSO4·7H2O 1 .5 g/L、CaCl20.2 g/L。接種量為接種量?jī)?yōu)化實(shí)驗(yàn)結(jié)果。初始pH為pH實(shí)驗(yàn)優(yōu)化結(jié)果。豆粕粉含量為豆粕粉含量實(shí)驗(yàn)優(yōu)化的結(jié)果,等量胰蛋白胨代替豆粕粉研究?jī)煞N氮源對(duì)發(fā)酵的影響。
1.3.3 枯草芽孢桿菌小試與中試發(fā)酵罐發(fā)酵
發(fā)酵培養(yǎng)基與搖瓶相同,接種量、豆粕粉含量、初始pH為搖瓶實(shí)驗(yàn)優(yōu)化參數(shù)。通過(guò)溶氧與攪拌相關(guān)聯(lián)控制溶氧水平。
1.3.4 納豆激酶活性測(cè)定方法
2.成人及青少年初始抗反轉(zhuǎn)錄病毒治療方案:初治患者推薦方案為2種NRTIs類骨干藥物聯(lián)合第三類藥物治療 。第三類藥物可以為NNRTIs或者增強(qiáng)型PIs(含利托那韋或考比司他)或者INSTIs;有條件的患者可以選用復(fù)方單片制劑 (STR)。 基于我國(guó)可獲得的抗病毒藥物,對(duì)于未接受過(guò)HAART的患者推薦及替代方案見(jiàn)表4。
稱量0.15 g的瓊脂、0.175 5 g NaCl,加到50 mL小錐形瓶中;量取20 mL的20 mmol/L的pH為8.0的Tris-Hcl緩沖液,溶解瓊脂;錐形瓶加塞置于微波爐中加熱溶解;待錐形瓶冷卻至50 ℃時(shí)向瓶中加入1 mL 50 mg/mL的纖維蛋白原溶液及100 μL 100 U/mL的凝血酶,混合均勻后迅速傾入滅菌平皿中;室溫放置30 min,以形成纖維蛋白凝塊。用打孔器在纖維蛋白平板上打7個(gè)孔,并做好標(biāo)識(shí);取10 μL濃度為320、160、80、40、20 IU/mL的標(biāo)準(zhǔn)尿激酶溶液到對(duì)應(yīng)的孔中,放置10 min后轉(zhuǎn)至37 ℃恒溫培養(yǎng)箱中反應(yīng),18 h后取出測(cè)定各溶解圈的垂直兩直徑;上述操作設(shè)定3個(gè)平行組,測(cè)量后取其平均值;再用垂直直徑的乘積的常用對(duì)數(shù)為橫坐標(biāo),標(biāo)準(zhǔn)尿激酶濃度的常用對(duì)數(shù)為縱坐標(biāo),制作尿激酶酶活標(biāo)準(zhǔn)曲線。取待測(cè)樣品10 μL按上述操作上樣于同一平皿,37 ℃恒溫培養(yǎng)箱中反應(yīng),18 h后測(cè)量溶解圈的垂直兩直徑,根據(jù)標(biāo)準(zhǔn)曲線方法及稀釋濃度求出樣品的酶活力大小。
2 實(shí)驗(yàn)結(jié)果與分析
2.1 以豆粕粉為氮源的枯草芽孢桿菌搖瓶發(fā)酵參數(shù)優(yōu)化
2.1.1 基于枯草芽孢桿菌生長(zhǎng)曲線的最佳種子液生長(zhǎng)狀態(tài)的確定
將低溫保藏的枯草芽孢桿菌菌株平板劃線培養(yǎng),挑取1個(gè)單菌落接入搖瓶中進(jìn)行菌種活化培養(yǎng)。如圖1所示,培養(yǎng)前12 h為延滯期,在第14 h進(jìn)入對(duì)數(shù)生長(zhǎng)期,第20 h達(dá)到菌液濃度的頂峰,第22 h開(kāi)始進(jìn)入衰亡期。從種子液的生長(zhǎng)曲線可以看出,在14~20 h之間為對(duì)數(shù)生長(zhǎng)期,并且第18 h處于對(duì)數(shù)生長(zhǎng)期的中期,此時(shí)菌種生長(zhǎng)最活躍旺盛,OD600為0.63,因此,在后期發(fā)酵培養(yǎng)種子液活化過(guò)程中應(yīng)當(dāng)選擇活化18 h左右,菌液濃度OD600為0.6左右的菌液作為種子液用于發(fā)酵培養(yǎng)。
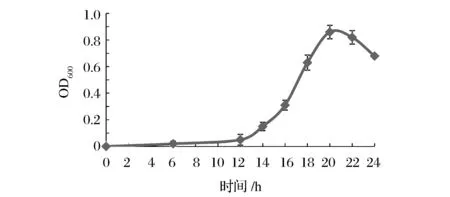
圖1 枯草芽孢桿菌在搖瓶中生長(zhǎng)曲線Fig.1 Growth curve of Bacillus subtilis in shake flask
2.1.2 枯草芽孢桿菌發(fā)酵最佳豆粕粉添加量的確定
根據(jù)枯草芽孢桿菌生長(zhǎng)曲線研究結(jié)果,取單菌落活化18 h的種子液用于后續(xù)的發(fā)酵試驗(yàn)研究。設(shè)置豆粕粉質(zhì)量體積百分比分別為2%、3%、4%、5%的4個(gè)濃度用于枯草芽孢桿菌發(fā)酵,結(jié)果如圖2所示。在4個(gè)豆粕粉濃度條件下,在前36 h內(nèi),發(fā)酵液中納豆激酶活性處于直線上升狀態(tài),除在2%豆粕粉條件下發(fā)酵液中納豆激酶活性在第36 h達(dá)到活性最高值的3 725 IU/mL之外,在3%、4%、5%豆粕粉濃度條件下,發(fā)酵液中納豆激酶活性在第42 h達(dá)到峰值,活性大小分別為5 480、5 019、4 015 IU/mL,其中3%豆粕粉發(fā)酵條件下,發(fā)酵液活性最高。
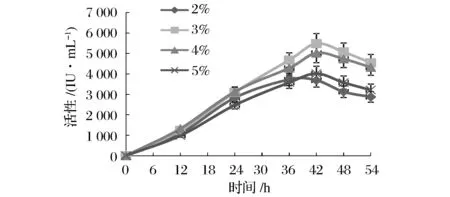
圖2 豆粕粉對(duì)發(fā)酵液納豆激酶酶活的影響Fig.2 The effects of soybean cake powder on nattokinase activities in media
2.1.3 枯草芽孢桿菌發(fā)酵豆粕粉最佳接種量和最適pH的確定
設(shè)置接種量分別為1%、2.5%、5%、7.5%、10%,發(fā)酵時(shí)間為42 h,對(duì)酶活影響結(jié)果如圖3所示。在接種量為5%的發(fā)酵條件下,酶活為5 513 IU/mL,分別是在接種量為1%、2.5%、7.5%、10%發(fā)酵條件下的1.44、1.21、1.14、1.31倍,因此 5%為最佳接種量。
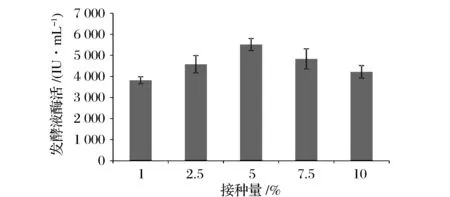
圖3 接種量對(duì)發(fā)酵液納豆激酶酶活的影響Fig.3 The effects of inoculum size on nattokinase activities in media

圖4 發(fā)酵液初始pH對(duì)發(fā)酵液納豆激酶酶活的影響Fig.4 The effects of initial pH on nattokinase activities in media
2.2 豆粕粉枯草芽孢桿菌發(fā)酵顯著優(yōu)于胰蛋白胨發(fā)酵
在傳統(tǒng)的枯草芽孢桿菌液體發(fā)酵過(guò)程中,一般使用蛋白胨作為重要的氮源物質(zhì),但是蛋白胨的高成本是必須面臨的問(wèn)題。本試驗(yàn)將豆粕粉發(fā)酵與傳統(tǒng)的蛋白胨發(fā)酵進(jìn)行比較,結(jié)果如圖5所示。在同樣都是3%濃度條件下,在第42 h發(fā)酵時(shí)間,胰蛋白胨發(fā)酵液中酶活為1 522 IU/mL,而豆粕粉發(fā)酵液中酶活高達(dá)5 471 IU/mL,是胰蛋白胨作為氮源發(fā)酵的3.6倍。此結(jié)果表明以價(jià)格低廉的豆粕粉作為枯草芽孢桿菌發(fā)酵氮源進(jìn)行納豆激酶生產(chǎn)綜合效果要遠(yuǎn)高于胰蛋白胨作為原料發(fā)酵。
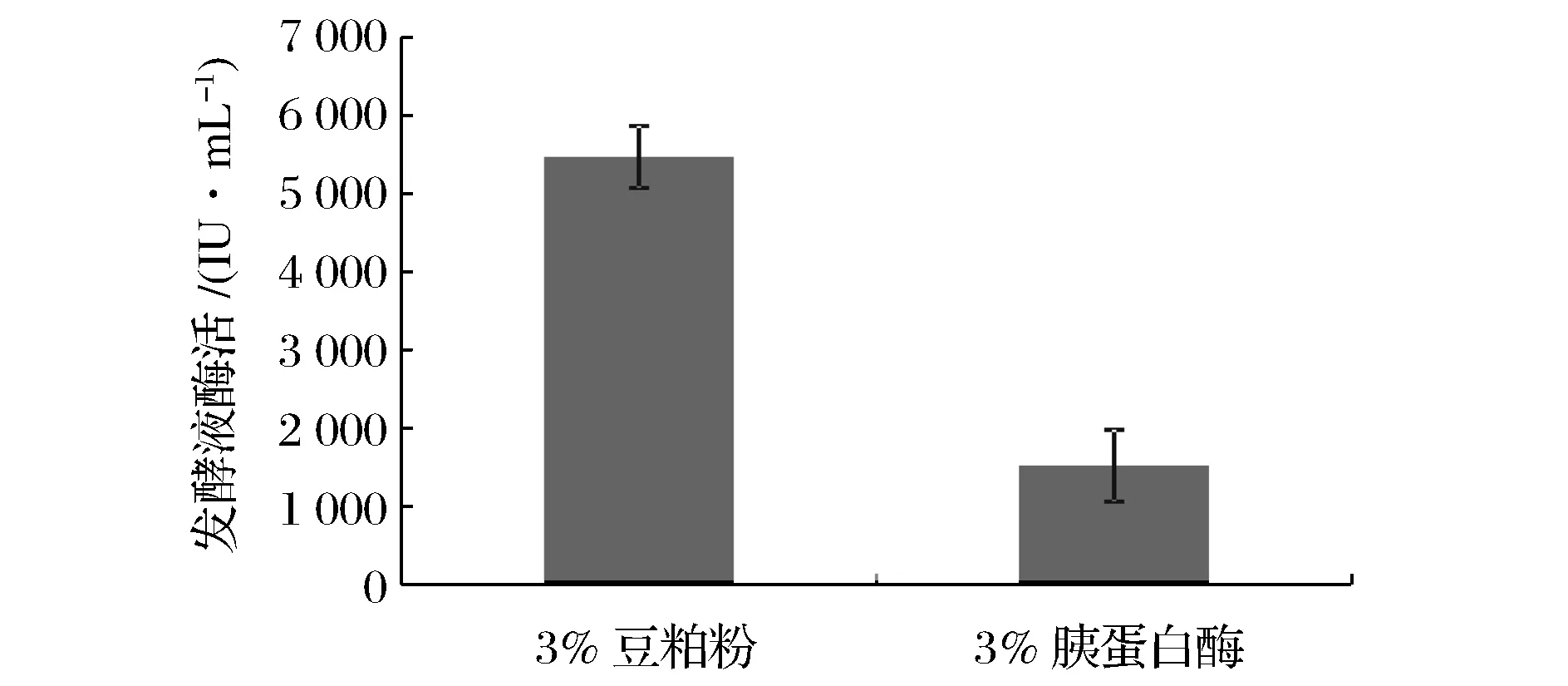
圖5 豆粕粉與胰蛋白胨對(duì)發(fā)酵液納豆激酶酶活的影響Fig.5 The effects of soybean cake powder and tryptone on nattokinase activities in media
2.3 枯草芽孢桿菌小試發(fā)酵工藝優(yōu)化和驗(yàn)證
7 L發(fā)酵罐工作體積為4 L,根據(jù)搖瓶發(fā)酵參數(shù)的優(yōu)化結(jié)果,設(shè)置培養(yǎng)基中豆粕粉含量為3%,初始pH 7.0,接種量為5%。設(shè)置溶氧與攪拌聯(lián)動(dòng),溶氧設(shè)定為50%。發(fā)酵液酶活曲線如圖6所示。同樣在第42 h發(fā)酵液中酶活達(dá)到最高峰值為6 519 IU/mL。
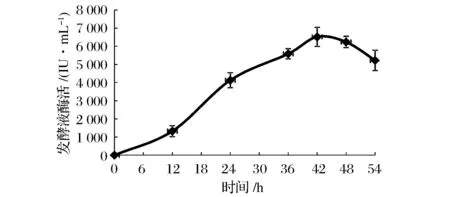
圖6 枯草芽孢桿菌在20 L發(fā)酵罐中的生長(zhǎng)曲線Fig.6 Growth curve of Bacillus subtilis in 20 L fermentation tank
對(duì)于枯草芽孢桿菌發(fā)酵罐的發(fā)酵培養(yǎng),溶氧是非常關(guān)鍵的工藝參數(shù),本試驗(yàn)進(jìn)一步通過(guò)溶氧與攪拌轉(zhuǎn)速相關(guān)聯(lián),研究了不同溶氧水平對(duì)發(fā)酵酶活的影響。根據(jù)上述實(shí)驗(yàn)結(jié)果,發(fā)酵第42 h在10%、30%、50%、70%溶氧水平下,發(fā)酵液中酶活分別為4 075、6 717、6 033、4 822 IU/mL。因此,枯草芽孢桿菌發(fā)酵罐發(fā)酵的最佳溶氧水平應(yīng)控制在30%左右。
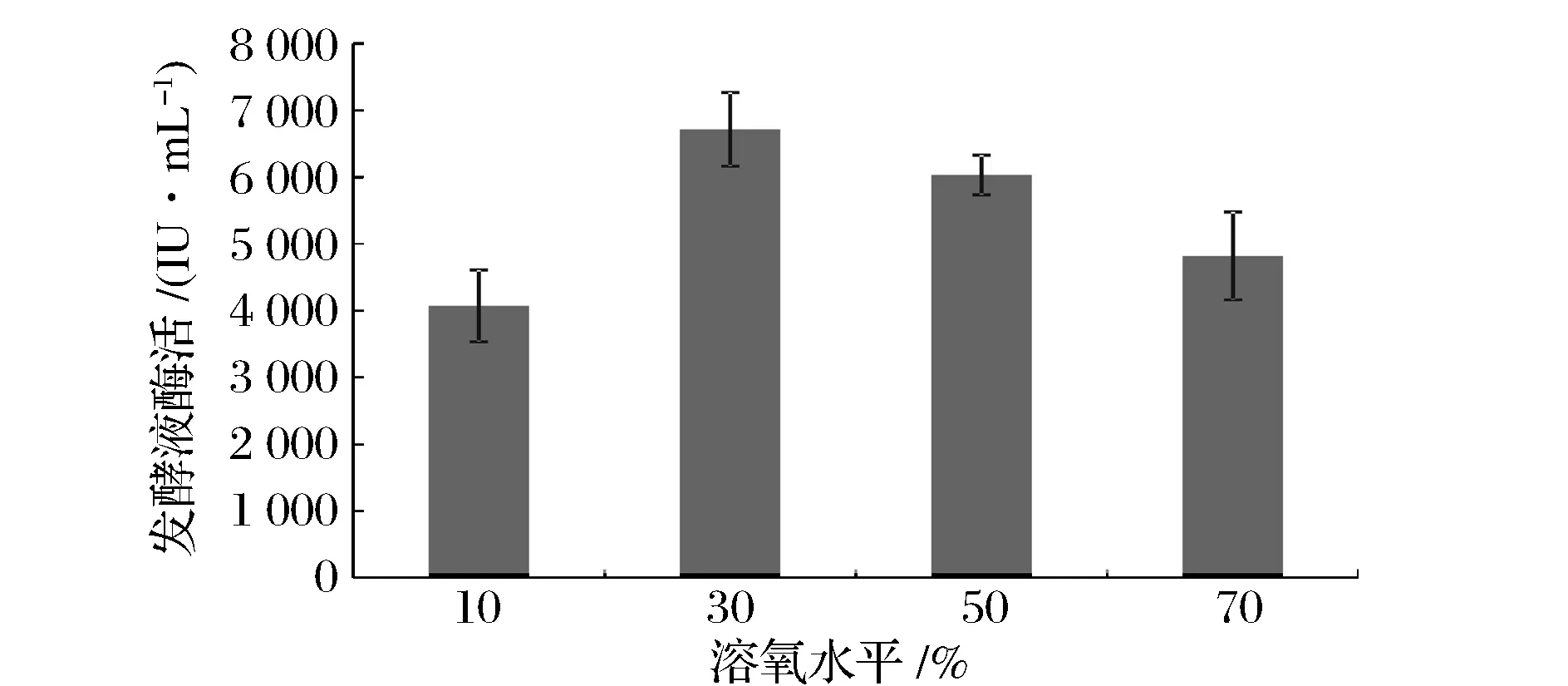
圖7 溶氧水平對(duì)發(fā)酵液納豆激酶酶活的影響Fig.7 The effects of dissolved oxygen level on nattokinase activities in media
2.4 枯草芽孢桿菌中試發(fā)酵工藝驗(yàn)證
為了進(jìn)一步驗(yàn)證前期搖瓶發(fā)酵參數(shù)與小試發(fā)酵罐發(fā)酵工藝,本試驗(yàn)采用中試規(guī)模的200 L發(fā)酵罐對(duì)上述參數(shù)和工藝進(jìn)行驗(yàn)證。200 L發(fā)酵罐工作體積為120 L,根據(jù)搖瓶發(fā)酵參數(shù)和工藝的優(yōu)化結(jié)果,設(shè)置培養(yǎng)基中豆粕粉含量為3%,初始pH 7.0,接種量為5%,溶氧為30%。與搖瓶與小試發(fā)酵罐相比,中試發(fā)酵規(guī)模過(guò)程中,發(fā)酵液酶活達(dá)到最高值時(shí)間為第48 h,大小為4 236 IU/mL。這一結(jié)果雖然與小試發(fā)酵水平相比,活性有所降低,但是仍然是有文獻(xiàn)報(bào)道實(shí)驗(yàn)結(jié)果中最高的納豆激酶生物學(xué)活性。

圖8 枯草芽孢桿菌在200 L發(fā)酵罐中的生長(zhǎng)曲線Fig.8 Growth curve of Bacillus subtilis in 200 L fermentation tank
3 討論
蛋白胨是目前枯草芽孢桿菌發(fā)酵生產(chǎn)納豆激酶的常用氮源[29],蛋白胨價(jià)格高昂,勢(shì)必造成生產(chǎn)成本過(guò)高。即使采用蛋白胨作為氮源用于液體發(fā)酵,發(fā)酵液中納豆激酶活性也非常有限[24-26,29-30]。張琳等采用胰蛋白胨作為氮源,搖瓶水平納豆激酶活性為1 004 IU/mL[24];任武賢等采用胰蛋白胨作為氮源,搖瓶水平納豆激酶活性為2 051 IU/mL[25];熊曉輝等采用胰蛋白胨作為氮源,5 L發(fā)酵罐水平納豆激酶活性為2 250 IU/mL[26];張鋒等采用大豆蛋白胨,搖瓶水平納豆激酶活性為1 000 IU/mL[30]。因此,目前以價(jià)格高昂的蛋白胨作為氮源的枯草芽孢桿菌液體發(fā)酵的納豆激酶活性普遍在1 000~2 000 IU/mL左右,仍待進(jìn)一步提高。
本研究采用價(jià)格低廉的豆粕粉作為枯草芽孢桿菌液體發(fā)酵的氮源生產(chǎn)納豆激酶,優(yōu)化確定了豆粕粉的添加量,并且優(yōu)化了系列發(fā)酵參數(shù),在搖瓶發(fā)酵水平,納豆激酶活性可達(dá)到5 471 IU/mL,與等量胰蛋白胨作為氮源發(fā)酵相比,酶活有了3.6倍的顯著提升。與蛋白胨相比,為什么豆粕粉作為氮源更有利于枯草芽孢桿菌表達(dá)分泌納豆激酶,其機(jī)理還不清楚。可能是由于豆粕粉與蛋白胨相比含有高含量的大豆纖維蛋白,因?yàn)榧{豆激酶可特異性水解纖維蛋白,只有纖維蛋白被水解成小分子短肽才能進(jìn)一步被枯草桿菌吸收利用,用于自身的生長(zhǎng)代謝。可能是大豆纖維蛋白對(duì)納豆激酶的產(chǎn)生具有誘導(dǎo)作用,這一作用需要在后續(xù)的試驗(yàn)中進(jìn)行研究驗(yàn)證。
任武賢等采用1%蛋白胨作為氮源,最佳接種量為3%,最適pH 7.0~7.2[25];熊曉輝等2%胰蛋白胨作為氮源,最佳接種量為5%,最適pH 7.0[26]。張立等采用2%胰蛋白胨作為氮源,最佳接種量為5%,最適pH 7.22[31]。本研究中,以3%豆粕粉作為氮源,最佳接種量為5%,最適pH 7.0。結(jié)果表明,蛋白胨或豆粕粉作為氮源,最佳發(fā)酵pH值均為pH 7.0左右,沒(méi)有差異。以蛋白胨作為氮源,當(dāng)?shù)鞍纂颂砑恿繛?%時(shí),最佳接種量為3%(比值為1∶3),當(dāng)添加量升高到2%時(shí),最佳接種量為5%(比值為2∶5)。本研究3%豆粕粉作為氮源,最佳接種量為5%(比值為3∶5),因此,豆粕粉與蛋白胨作為氮源相比,接種量要高。在后續(xù)的工業(yè)化發(fā)酵生產(chǎn)的實(shí)踐中,如果以豆粕粉為氮源,應(yīng)當(dāng)適當(dāng)增加接種量。
在搖瓶水平確定了最佳豆粕粉添加量和系列工藝參數(shù)的基礎(chǔ)之上,又進(jìn)一步在小試與中試發(fā)酵規(guī)模進(jìn)行了驗(yàn)證和放大,7 L發(fā)酵罐水平納豆激酶活性高達(dá)6 717 IU/mL,200 L中試發(fā)酵罐水平納豆激酶活性可達(dá)4 236 IU/mL。因此,本研究以價(jià)格低廉的豆粕粉為發(fā)酵原料不僅降低了生產(chǎn)成本,而且大幅度升高了發(fā)酵液中的納豆激酶活性,并且在豆粕粉作為氮源的基礎(chǔ)之上優(yōu)化了系列的發(fā)酵參數(shù)與工藝,實(shí)現(xiàn)了從搖瓶水平到中試水平的工藝驗(yàn)證與放大。為枯草芽孢桿菌產(chǎn)業(yè)化生產(chǎn)納豆激酶用于食品和藥物開(kāi)發(fā)提供了廉價(jià)的原料選擇和可靠的發(fā)酵工藝。
[1] 中國(guó)居民營(yíng)養(yǎng)與慢性病狀況報(bào)告(2015)[M]. 北京:中國(guó)衛(wèi)生與計(jì)劃生育委員會(huì), 2015.
[2] 李章立. 心腦血管疾病的防治與養(yǎng)生[C].中華中醫(yī)藥學(xué)會(huì)血栓病分會(huì)第七次學(xué)術(shù)研討會(huì).中華中醫(yī)藥學(xué)會(huì)血栓病分會(huì)第七次研討會(huì)暨河北省中醫(yī)藥學(xué)會(huì)健康營(yíng)養(yǎng)藥膳專業(yè)委員會(huì)學(xué)術(shù)會(huì)議論義集,河北邯鄲,中華中醫(yī)藥學(xué)會(huì),2013:487.
[3] UEDA M, KUBO T, MIYATAKE K, et al. Purification and characterization of fibrinolytic alkaline protease fromFusariumsp. BLB[J]. Applied Microbiology & Biotechnology, 2007, 74(2):331-338.
[4] SUMI H, HAMADAH, TSUSHIMA H, et al. A novel fibrinolytic enzyme (nattokinase) in the vegetable cheese Natto; a typical and popular soybean food in the Japanese diet[J]. Experientia, 1987, 43(10):1 110-1 111.
[5] KOU W, ZHANG Y N, XIN R, et al. Application of nattokinase in health drinks and its prospects[J]. Beverage Industry, 2006, 9(8):9-11.
[6] FUJITA M, NOMURA K, HONG K, et al. Purification and characterization of a strong fibrinolytic enzyme (Nattokinase) in the vegetable cheese Natto, a popular soybean fermented food in Japan[J]. Biochemical & Biophysical Research Communications, 1993, 197(3):1 340-1 347.
[7] URANO T, IHARA H, UMEMURA K, et al. The profibrinolytic enzyme subtilisin NAT purified fromBacillussubtilisCleaves and inactivates plasminogen activator inhibitor type 1.[J]. Journal of Biological Chemistry, 2001, 276(27):24 690-24 696.
[8] FUJTIA M, OHNISHI K, TAKAOKA S, et al. Antihypertensive effects of continuous oral administration of nattokinase and its fragments in spontaneously hypertensive rats.[J]. Biological & Pharmaceutical Bulletin, 2011, 34(11):1 696-1 701.
[9] JANG J Y, KIM T S, CAI J M, et al. Nattokinase improves blood flow by inhibiting platelet aggregation and thrombus formation[J]. Laboratory Animal Research, 2013, 29(4):221-225.
[10] FUJITA M, HONG K, ITO Y, et al. Thrombolytic effect of nattokinase on a chemically induced thrombosis model in rat.[J]. Biological & Pharmaceutical Bulletin, 1995, 18(10):1 387-1 391.
[11] XU J, DU M, YANG X, et al. Thrombolytic effects in vivo of Nattokinase in a carrageenan-induced rat model of thrombosis[J]. Acta Haematologica, 2014, 132(2):247-253.
[12] YAN F, YAN J, SUN W, et al. Thrombolytic effect of Subtilisin QK on carrageenan induced thrombosis model in mice[J]. Journal of Thrombosis & Thrombolysis, 2009, 28(4):444-448.
[13] LEE D L, HONG S Y, JANG Y S, et al. The evaluation of antithrombotic and fibrinolytic activities of nattokinase fromBacillussubtilisnatto[J]. Physics of Plasmas, 2012, 27(6):375-380.
[14] 張利, 成子強(qiáng), 李培鋒, 等. 納豆激酶溶血栓作用的研究[J]. 山東農(nóng)業(yè)大學(xué)學(xué)報(bào)(自然科學(xué)版), 2005,36(4):625-631.
[15] TAI M W, SWEET B V. Nattokinase for prevention of thrombosis[J]. American Journal of Health-System Pharmacy, 2006, 63(12):1 121-1 123.
[16] HSIA C H, ShEN M C, LIN J S, et al. Nattokinase decreases plasma levels of fibrinogen, factor VII, and factor VIII in human subjects[J]. Nutrition Research, 2009, 29(3):190-196.
[17] SUMI H, HAMADA H, Nakanishi K, et al. Enhancement of the fibrinolytic activity in plasma by oral administration of nattokinase[J]. Acta Haematologica, 1990, 84(84):139-143.
[18] YUKO K, SHINSUKE N, TOSHIYUKI H, et al. A single-dose of oral nattokinase potentiates thrombolysis and anti-coagulation profiles[J/OL]. Scientific Reports, 2015, 5[2016-09-09]. http://www.nature.com/articles/srep11601 DOI: 10.1038/srep11601.
[19] ERO M P, NG C M, MIHAILOVSKI T, et al. A pilot study on the serum pharmacokinetics of nattokinase in humans following a single, oral, daily dose[J]. Alternative Therapies in Health & Medicine, 2013, 19(3):16-19.
[20] LAMPE B J, ENGLISHI J C. Toxicological assessment of nattokinase derived fromBacillussubtilis, var. natto[J]. Food & Chemical Toxicology, 2015, 88:87-99.
[21] 胡景柱, 夏壽華, 吳林. 納豆凍干粉的安全性研究[J]. 安徽農(nóng)業(yè)科學(xué), 2000, 28(3):380-381.
[22] 黃曉曼, 楊鵲, 邱志健,等. 納豆激酶的安全性試驗(yàn)[J]. 中國(guó)食品添加劑, 2008(2):109-112.
[23] 付玉生, 李永利, 張焱,等. 納豆激酶膠囊毒理學(xué)安全性評(píng)價(jià)[J]. 實(shí)用預(yù)防醫(yī)學(xué), 2012, 19(11):1 714-1 716.
[24] 張琳, 王凱, 龐豐平,等. 納豆激酶的液體發(fā)酵條件優(yōu)化[J]. 基因組學(xué)與應(yīng)用生物學(xué), 2016(2):373-377.
[25] 任武賢, 王星星, 戴東升. 納豆激酶液態(tài)發(fā)酵工藝的優(yōu)化[J]. 大豆科學(xué), 2015, 34(1):128-130.
[26] 熊曉輝, 梁劍光, 熊強(qiáng). 納豆激酶液體發(fā)酵條件的優(yōu)化[J]. 食品與發(fā)酵工業(yè), 2004, 30(1):62-66.
[27] 王萍, 杜連祥, 路福平,等. 溶栓納豆芽孢桿菌的篩選鑒定及產(chǎn)納豆激酶條件的研究[J]. 食品與發(fā)酵工業(yè), 2006, 32(2):74-77.
[28] CONG W, MING D, ZHENG D, et al. Purification and characterization of Nattokinase fromBacillussubtilisNatto B-12[J]. Journal of Agricultural & Food Chemistry, 2009, 57(20):9 722-9 729.
[29] 許強(qiáng), 薛建. 納豆激酶液體發(fā)酵培養(yǎng)基優(yōu)化研究[J]. 北京農(nóng)業(yè), 2014(33):32-33.
[30] 張鋒, 金杰, 安瑩, 等. 納豆激酶液體發(fā)酵條件的優(yōu)化研究[J]. 食品與發(fā)酵科技, 2005, 41(4):22-25.
[31] 張立, 趙友云, 馬強(qiáng), 等. 枯草桿菌溶栓酶QK-2發(fā)酵工藝的優(yōu)化及其腸溶膠囊的研制[C]. 湖北生物產(chǎn)業(yè)發(fā)展高端論壇暨湖北省生物工程學(xué)會(huì)2012年度學(xué)術(shù)交流會(huì), 2012年湖北生物產(chǎn)業(yè)發(fā)展高端論壇暨湖北省生物工程學(xué)2012年度學(xué)術(shù)交流會(huì)論文匯編,湖北武漢,湖北省科學(xué)技術(shù)協(xié)會(huì),2012.
Process optimization and validation ofBacillussubtilisliquid fermentation for nattokinase production using soybean cake powder as the nitrogen source
DONG Yan-shan1, Gao Li2,HE Jia-heng2, HU Biao-qun2,FAN Qing-yun2, WANG Ye-fu1*
1(Wuhan University, College of Life Science, State Key Laboratory of Virology, Wuhan 430075,China)2(Wuhan Zhenfu Pharmaceutical Co. Ltd, Wuhan 430075,China)
Tryptone was selected as the nitrogen source in traditionalBacillussubtilisliquid fermentation, which led to high production costs and low nattokinase activities. In this study, tryptone was replaced with low-cost soybean cake powder as the nitrogen source inBacillussubtilisliquid fermentation to produce nattokinase.The amountof soybean cake powder, the optimal inoculum size, media initial pH and fermentation time were confirmed after optimization at shake flask level. The nattokinase activities in shake flask level arrived at 5 471 IU/mL, which was 3.6 times of that from fermentation with same amount of tryptone as nitrogen source. The above parameters at shake flask fermentation level were further verified in 7 L and 200 L fermentation tank, and the optimal dissolved oxygen level was confirmed to be 30%. The nattokinase activities in 7 L and 200 L fermentation tank respectively reached 6 717 IU/mL and 4 236 IU/mL.
soybean cake powder;Bacillussubtilis; nattokinase; fermentation
10.13995/j.cnki.11-1802/ts.201702019
博士,助理研究員(王業(yè)富教授為通訊作者,E-mail:wangyefu@whu.edu.cn)。
中國(guó)博士后科學(xué)(2016M592375);湖北省衛(wèi)計(jì)委青年人才項(xiàng)目(WJ2017Q002)
2016-09-09,改回日期:2016-10-14

