鋰空氣電池正極催化劑的研究進展
王娜,林鴻鵬,方新榮,宋曉娜,劉元剛,武俊偉
( 1.東莞市邁科新能源有限公司,廣東 東莞 523800;2.天津科技工作者創新創業服務中心,天津300041;3.哈爾濱工業大學(深圳) 材料科學與工程學院, 深圳 518101)
1 前言
不同于傳統的“搖椅式”鋰離子電池,基于電化學過程中的氧還原反應(ORR)和氧析出反應(OER),金屬空氣電池可以實現可逆的充放電過程。由于空氣及活性物質(氧氣)并不儲存在電池內部,而是來自于外界,因而金屬空氣電池具有極高的理論能量密度,其中鋰空氣電池是最具潛力成為下一代高能量密度的儲能系統。在考慮O2質量的條件下,鋰空氣電池理論能量密度為5210Wh/kg (不包括氧氣條件下能量密度高達11680Wh/kg),比傳統鋰離子電池能量密度高出5-10倍[1],是目前所有可充電電池體系中理論能量密度最高的。如圖1-1所示為不同電池體系實際能量密度及相應電動汽車續航里程和能源單價對比圖[2],可見在所有的儲能體系中,鋰空氣電池在理論上可以實現電動汽車接近現有燃油汽車的續航里程數(500km~600km)。基于此,鋰空氣電池入選了IBM公司“電池500項目”,并由此受到全世界科技工作者的廣泛研究。
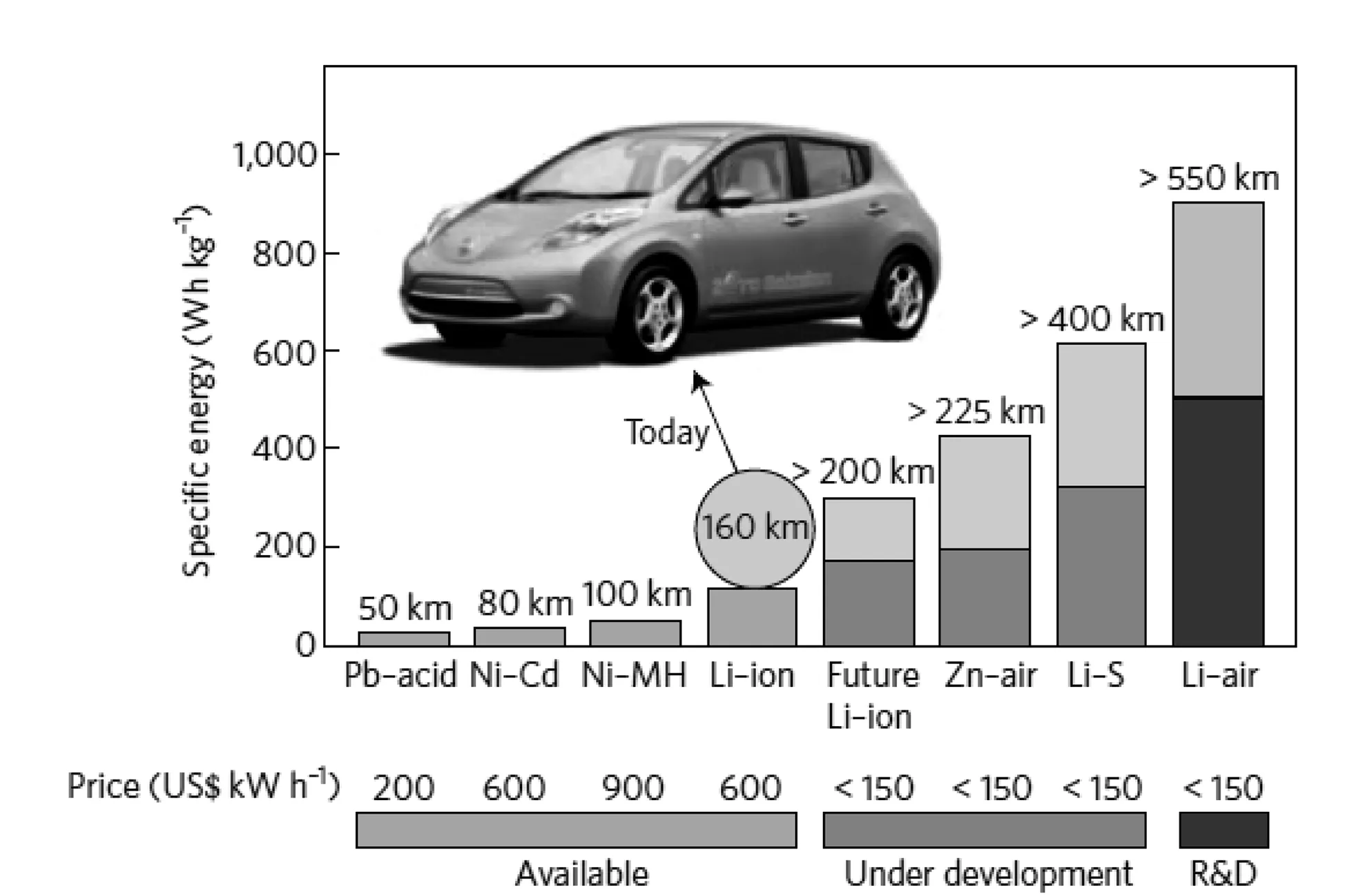
圖1-1 不同電池體系實際能量密度及相應電動汽車續航里程和價格對比[2]Fig.1-1 Comparison of range and price for different battery system energy density and its corresponding electric vehicle[2]
2 鋰空氣電池概述
2.1 鋰空氣電池結構與基本原理
最早在1976年有Lockheed的研究人員提出了鋰空氣電池的概念,整個體系包括金屬鋰負極、空氣(或氧氣)正極、以及堿性水溶液電解液。該體系電池的一個嚴重問題就是金屬鋰會與水溶液劇烈反應。1996年,有人提出了有機電解液體系的鋰空氣電池,該體系則包括金屬鋰負極、復合碳電極的正極、以及膠體電解質,其中酞青鈷被用作催化劑材料。此種體系的鋰空氣電池解決了金屬鋰負極與水發生劇烈反應的問題,但是又產生了新的問題,這也是當前鋰空氣電池發展所面臨的主要問題之一,即不溶于有機電解液的放電產物Li2O2或Li2O堆積在空氣電極上而堵塞材料的物質傳輸通道,最終導致正極失效,電池放電終止[3]。到2006年,T. Ogasawara等人[4]提出并驗證了鋰空氣電池在有機電解液體系下的可逆性,從此鋰空氣電池開始逐漸吸引越來越多研究人員的關注。
典型的鋰空氣電池包含以下幾個部分:負極金屬鋰、空氣正極多孔碳、正負極間隔膜以及鋰離子傳導電解液,其中空氣正極一般由碳基體材料和催化劑組成。發展至今,鋰空氣電池根據所使用電解液種類的不同可以分為以下四種:(a)有機電解液體系;(b)水溶液體系;(c)混合電解液體系;(d)全固態電解液體系,各體系電池結構如圖2-1所示[5]。其中有機電解液體系具有最簡單的電池結構和相對容易實現的實驗條件,同時具有最高的實際能量密度[6-9],因而成為鋰空氣電池領域的研究熱點。
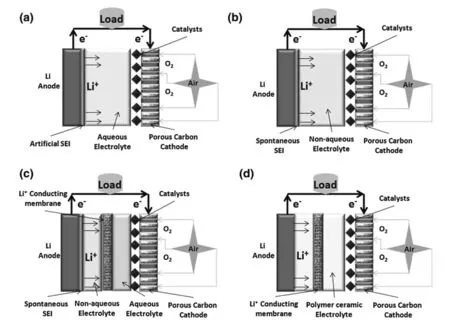
圖2-1 四種電池體系結構示意圖[5]Fig.2-1 Structure diagram of four battery system[5]
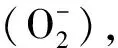
放電過程
陽極反應:
Li - e-→ Li+
(2-1)
陰極反應:
(2-2)
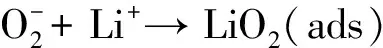
(2-3)
2LiO2→ Li2O2+ O2
(2-4)
LiO2+ Li++ e-→ Li2O2
(2-5)
充電過程
陽極反應:
Li++ e-→ Li
(2-6)
陰極反應:
Li2O2→ 2Li++ 2e-+ O2
(2-7)
在水系鋰空氣電池中,由于放電產物Li2O2會繼續與水發生反應生成LiOH,所以其最終的放電產物為LiOH,并且溶解在電解液中而不會阻礙放電反應的繼續進行。
有關鋰空氣電池充放電反應機理的研究,目前尚不成熟,仍需做大量的工作。可以說鋰空氣電池的發展仍然處在初級階段,由于電池各組成部分對電池性能的影響,使得當前鋰空氣電池所能實現的實際比能量還遠遠達不到理論水平。
2.2 鋰空氣電池研究現狀
大量研究結果使鋰空氣電池的基礎電化學反應過程以及電極和電解液等材料對電池性能的影響規律越來越明晰。然而時至今日,鋰空氣電池仍然難以實現商業化,是因為其仍然面臨很多問題和挑戰,包括實際容量低、倍率性能差、能量效率低(充放電電壓差大)以及循環壽命短等,具體原因可以歸結為以下幾個方面:
(1)有機體系電解液的分解
(2)鋰枝晶的生成以及與陽極鋰相關的副反應
(3)緩慢的氧反應動力學以及正極碳材料的腐蝕失效
目前,鋰空氣電池除了實際比容量比理論比容量低以外,還存在諸如能量效率低(充放電電壓差大)、倍率性能差等不足,這些不足很大程度上是由正極氧的還原反應(ORR)和析出反應(OER)緩慢的反應動力學造成的。此外,鋰空氣電池充放電過程中LiO2和Li2O2的存在是造成正極碳基材料腐蝕分解的重要原因[13,17]。正極多孔碳基材料的腐蝕分解會加快電池的容量衰減、縮短電池的循環壽命。
綜上所述,要實現鋰空氣電池技術的商業化還有很多的問題需要解決。圍繞這些存在的問題和挑戰,研究者們已經做了不少基礎研究工作,這其中包括對金屬鋰負極、電解液、空氣擴散正極等多方面的研究。其中空氣擴散正極作為鋰空氣電池的核心部分,一直是鋰空氣電池領域研究的熱點。好的正極材料能夠為電池充放電過程提供大量的活性位點,并催化電池ORR 和OER過程的快速進行,提高電池的比容量、提高電池的能量效率以及改善電池的倍率性能等。因此,對空氣正極催化劑材料的結構和電化學特性進行合理設計及調控對于改善鋰空氣電池的綜合性能具有非常重要的作用。
3 鋰空氣電池正極催化劑
如上所述,正極材料的好壞影響電池的綜合性能,好的正極材料能為電池充放電過程中物質的擴散傳輸提供通道,為放電產物的沉積提供容納空間,同時還能催化ORR和OER過程,提高電池的綜合性能。目前鋰空氣電池正極材料一般包括一些碳材料和非碳催化劑材料。
3.1 碳材料
碳材料具有很多特點,如具有良好的電子電導率、容易實現的高比表和高孔隙率、質量輕以及價格低等,此外,碳材料本身也有一定的ORR催化作用,因而其被廣泛用作鋰空氣電池正極材料,其可以單獨做正極催化劑使用,也可以作為催化劑載體使用。目前,對鋰空氣電池正極碳基材料的研究主要集中在兩個方向,一是對碳基材料的結構和形貌進行設計和調控,二是通過摻雜等方式對碳材料的電化學特性進行優化改性。這些碳材料包括一些商業碳黑、多孔碳材料[18,19]、碳納米管和納米纖維[20,21]以及石墨烯等[22,23]。
Hayashi[24]等人研究發現,電池的放電容量與材料的比表面積有關,大的比表面積更有利于獲得高的放電比容量。原因是高比表有利于形成更多的氣、液、固三相反應界面,以及更為均勻的催化劑負載,從而有利于更好的發揮材料的性能。而Tran[25]等人同樣對比了幾種碳作鋰空氣電池正極材料的性能。結果表明,具有相對最高比表的活性碳(2100m2/g),其放電容量僅為414mAh/g,低于小比表Super P碳的1736mAh/g。分析發現,活性碳具有較小的孔徑,而Super P的孔徑較大,在碳基體材料中微孔容易被放電產物堵塞,介孔和大孔才可以容納一定數量的放電產物而不影響物質的擴散。由此可知,鋰空氣電池的放電容量還與材料的孔徑大小有關。
最近,J. B. Park[26]等人采用模板法,通過三元共組裝合成一種孔徑可控的有序介孔碳,并用作鋰空氣電池正極材料。與Super P碳正極相比,這種有序介孔碳電極可以在200mA/g的電流密度以及2000mAh/g的比容量限定條件下連續循環25次,表現出優越的循環性能。B. Sun[27]等則利用多孔納米MnO做硬模板,通過化學氣相沉積法(CVD)制備了一種納米方形介孔碳,這種碳材料具有 492.3m2/g的比表面積,高達3.74cm3/g的孔容積,以及50nm~100nm的孔徑分布。與CB碳空氣正極首次放電比容量為6240mAh/g相比,該碳材料正極在200mA/g的電流密度下,首次放電容量可以達到26100mAh/g。
另外,一維碳材料如碳納米管、碳納米線等也被用于鋰空氣電池空氣正極。Yang[28]等人制備了一種無粘結劑的全碳纖維空氣正極,首次放電可以獲得高達2500Wh/kg的比能量。分析表明,此高比能量主要來自于碳材料及其孔徑結構的高效利用,不添加有機粘結劑,可以使正極有更多的空間來容納放電產物。Kang[29]研究小組利用有序排列的CNT纖維制備了一種孔結構可控的層狀碳空氣電極。其放電后電極的SEM圖表明,在充放電過程中,碳材料的結構可以很好的保留下來,這對于改善鋰空氣電池的循環效率和容量衰減都是很有幫助的。
基于計算機模擬技術,Zhang[30]等人稱多級孔徑結構的碳可以有效提升鋰空氣電池的放電容量,因為它有利于氧氣更快地進入到空氣電極的內部。Xia[31]等人合成了一種三維有序介孔/大孔碳球陣列,在限定比容量1000mAh/g的條件下,可以獲得很好的循環性能(持續循環30次)和倍率性能[32]。分析結果表明,這種有序介孔/大孔碳材料電化學性能的改善主要是由于孔的有序性更有利于氧氣的擴散和固、液、氣三相反應區的形成。
Rodrigues[33]等人成功制備了氮摻雜的活性碳材料,制備鋰空氣電池正極片并進行電化學性能測試。結果顯示:N原子的摻入使材料的放電容量和ORR催化活性都有明顯的提升。Nie[34]等人則以含氮前驅體三聚氰胺作為碳源,以氣相二氧化硅做模板劑,通過控制合成條件,合成了多種孔徑的富氮介孔碳材料N-MCS。與商業碳黑BP2000對比,N-MCS碳空氣正極放電容量更高,在30mA/g的電流密度下,獲得高達4500mAh/g的初始比容量。此外,其他元素(如P、S、B等)摻雜的碳材料對鋰空氣電池的影響也已有研究[33, 35],結果表明,對空氣擴散正極碳基體材料的雜原子摻雜也是提升鋰空氣電池性能的有效手段。
綜合來看,在鋰空氣電池中,對碳基材料的結構進行設計和調控是改善材料電化學性能,提高電池綜合性能的重要手段;同時,對碳材料進行雜原子摻雜是進一步提升材料ORR和OER催化活性的有效方式。
3.2 非碳催化劑
目前有關鋰空氣電池中催化劑的作用機理尚沒有一致的結論,但是很多的研究結論顯示,催化劑確實能夠減少電池的充放電過電勢以及改善電池循環性能,并影響放電產物的結構、形貌等。由于碳材料本身的催化效果有限,因此,研究人員常常在碳材料的基礎上通過機械混合或者原位負載的方式引入其他催化劑來進一步提升電池的綜合性能,這些催化劑包括過渡金屬氧化物、貴金屬及其合金、金屬氮化物以及導電聚合物等。
3.2.1 過渡金屬氧化物
過渡金屬氧化物包括單金屬氧化物和多金屬氧化物,其相對于貴金屬催化劑來說具有儲量大、價格低、制備簡單以及環境友好等優點。
錳氧化物是一種能同時催化ORR和OER過程的具有雙功能的電化學催化劑,其具有多種晶體形態,如一維隧道型、二維層狀結構以及三維尖晶石結構等,已有的大量研究表明錳氧化物的化學組分、形貌、氧化狀態以及晶體結構均會影響材料的電催化性能。Oloniyo[36]等人就合成了α、β、λ-MnO2納米線以及α-MnO2納米棒和納米球,此外通過在碳上負載催化劑合成了α-MnO2納米線復合材料(α-MnO2/C)。在1M LiTFSI/TEGDME電解液體系中研究各形態氧化錳的電催化性能,發現β-MnO2獲得最高2600mAh/g的放電容量,而α-MnO2/C電極則表現出低于1300mAh/g的容量。Song等人[37]則合成了分別具有納米顆粒、納米管以及納米線形貌的α-MnO2催化劑,相應材料的電極顯示出相同的放電平臺,但是α-MnO2納米線具有最低的充電平臺以及在200mA/g和5000mA/g電流密度下分別高達11000mAh/g和4500mAh/g的容量,而其他形式氧化錳在5000mA/g電流密度下則只有低至1000mAh/g的容量。研究者認為α-MnO2納米線的優越性能與大量暴露在材料表面的Mn3+有關,表明通過對材料表面的化學特性進行修飾是獲得高性能催化劑的有效方式。
結構缺陷對材料電催化性能也有很大影響,Nazar[38]等利用Na0.44MnO2納米線作為原始材料,通過酸浸漬法獲得一種有Na空位缺陷的Na0.44-xHxMnO2納米線材料,并將其用作鋰空氣電池正極催化劑。同純KB碳黑和原始Na0.44MnO2納米線相比,改性材料催化的鋰空氣電池表現出更高的可逆容量和更低的OER過電勢,其結果如圖所示3-1所示。

圖3-1 原始Na0.44MnO2納米線催化劑(P-Z-MnO2/KB)、酸浸漬得Na0.44-xHxMnO2納米線催化劑(AL-Z-MnO2/KB)、α-MnO2催化劑(P-α-MnO2/KB)以及導電碳黑(KB)催化劑正極初始充放電電壓容量曲線[38]Fig.3-1 First charge and discharge curve of original Na0.44MnO2 nano line catalytic(P-Z-MnO2/KB,acid solvent Na0.44-xHxMnO2 nano line catalytic(AL-Z-MnO2/KB), α-MnO2 catalytic (P-α-MnO2/KB) and electric conduction carbon (KB) catalytic as cathode[38]
鈷的氧化物是另外一種具有高ORR和OER雙功能催化活性的氧化物,材料的催化性能也與其相貌和結構等相關。G.Gnana.kumar[39]等人合成了一種rGO/Co3O4復合材料,其中Co3O4為具有面心立方晶體結構的平均直徑在220nm左右的納米片,平均分布在石墨烯片上。用作鋰空氣電池正極催化劑表現出4150mAh/g的比容量,并具有優越的循環性能。分析表明,該材料的優越性能主要來自石墨烯片的高導電率和Co3O4立法納米片高電催化活性的協同效應。
Riaz[40]等人制備了三種形貌的Co3O4納米材料并用作鋰空氣電池正極材料,分別是納米片、納米針以及納米花,電池測試結果如圖3-2所示。在 20mA/g的電流密度下,電池比容量大小為納米片(1127mAh/g)<納米花(1930mAh/g)<納米針(2280mAh/g)。此外,盡管三種正極材料具有相近的高達2.75 V的放電電壓和低至3.85 V的充電電壓,但是Co3O4納米針正極具有最佳的循環性能。
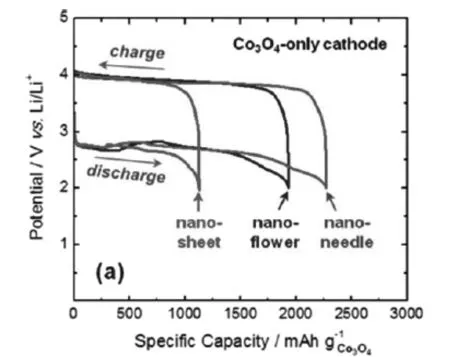
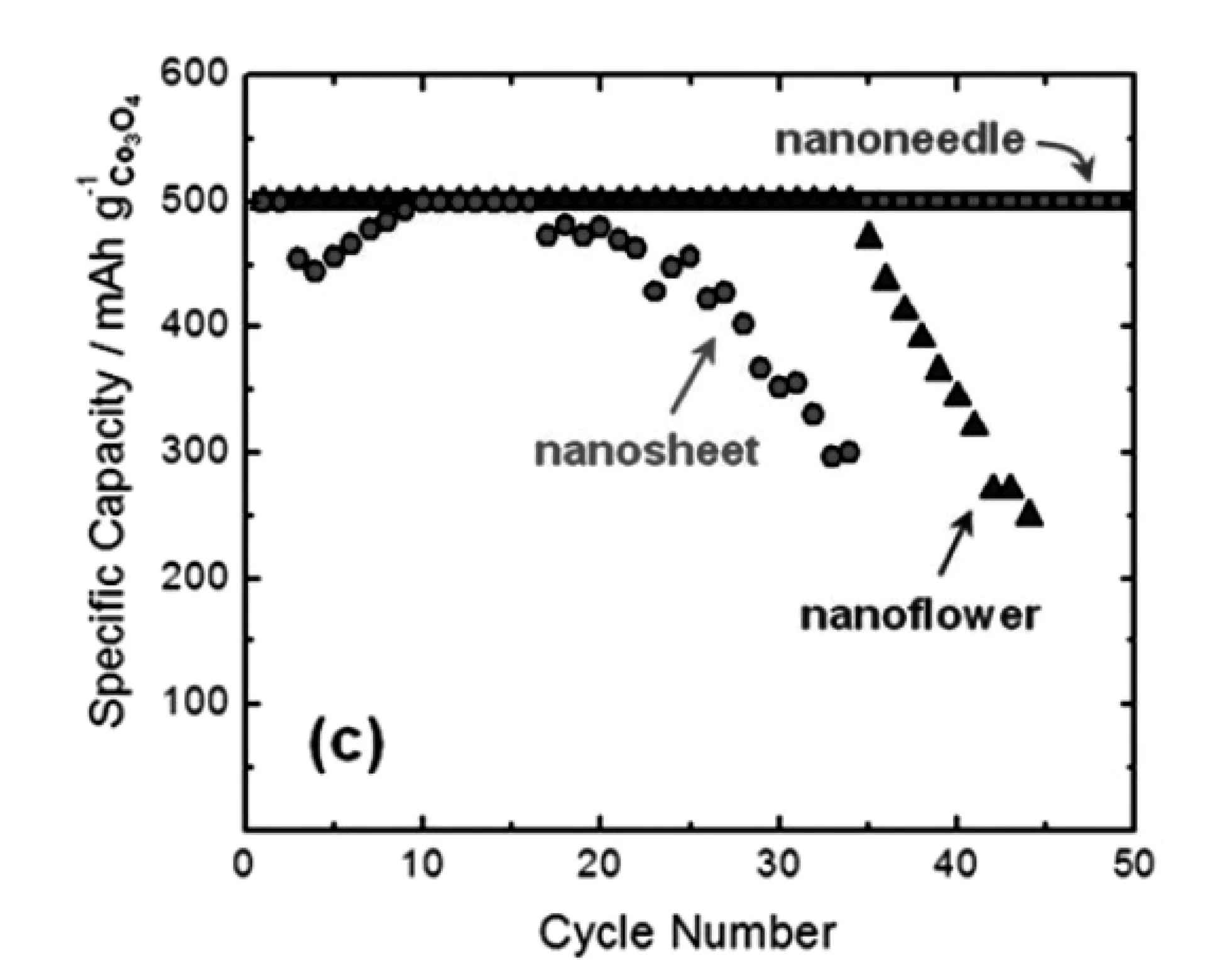
圖3-2 20 mA/g的電流密度下 (a)不同形貌Co3O4正極充放電曲線,(b)不同形貌Co3O4正極循環性能比較[40]Fig.3-2 At current density of 20 mA/g (a)charge and discharge curve of cathode Co3O4 for different patterns (b)cycle performance compassion for different patternsof cathode Co3O4[40]
用其他原子取代Co3O4的部分Co原子是一種進一步提升材料性能的有效手段。Anandan[41]等使用Mn原子部分取代Co原子,合成了Mn0.5CO2.5O4、Mn1CO2O4以及Mn1.5Co1.5O4三種材料并用作鋰空氣電池正極催化劑,結果表明三種材料均表現出比原始Co3O4更低的充電電壓,表現出更優的OER催化活性。Li[42]等人則使用硬模板法合成了Ni取代的介孔NiCoO4材料,并研究了正極材料中介孔NiCoO4含量對電池性能的影響。當NiCoO4含量從20%依次增加到45%和70%,充電電壓依次從4.0V下降到3.75V,而相應的放電電壓則從2.75V增加到2.80V。
除了以上錳、鈷的單金屬氧化物外,其他過渡金屬氧化物用作鋰空氣電池正極催化劑也有廣泛研究。如Thapa[43]等人研究了多種氧化物做正極催化劑的電化學性能,包括Co3O4、NiO、Fe2O3、CuO、V2O5、MoO3和Y2O3。在循環5圈后,所有材料均保持高于首圈的放電容量,其中CuO和V2O5相對具有更高的可逆比容量。而Barile[44]等人有關CuO作正極催化劑的研究則表明,CuO的存在給電池的綜合性能帶來不利影響,因為它會催化電解液和碳材料的分解。Xiao[45]等人則單獨研究了V2O5做正極催化劑的電化學性能,結果顯示V2O5是一種高效的鋰空氣電池催化劑。
鈣鈦礦以及類鈣鈦礦型過渡金屬氧化物在固體氧化物燃料電池以及超級電容器中已有廣泛研究和應用,這種材料通常都具有比較好的ORR和OER雙功能催化活性,近年來在鋰空氣電池正極催化劑領域也吸引了很多研究者的注意,是一類很有潛質的催化劑材料。Fu[46]等人通過溶膠凝膠法和固相法分別合成了s-La0.8Sr0.2MnO3和g-La0.8Sr0.2MnO3兩種納米鈣鈦礦材料。電化學測試結果顯示,在0.1 mA/cm2電流密度下g-La0.8Sr0.2MnO3正極具有1900mAh/gcarbon的初始放電比容量,高于s-La0.8Sr0.2MnO3的1200mAh/gcarbon。并且g-La0.8Sr0.2MnO3正極顯示出比s-La0.8Sr0.2MnO3高出0.2 V的放電電壓。分析顯示,是材料的表面形貌造成了兩種催化劑性能的差異。Han[47]等人研究了多孔CaMnO3材料用作正極催化劑材料,同純碳相比,在50mA/gcarbon的電流密度以及500mAh/gcarbon的放電深度下CaMnO3表現出低至0.98V的充放電電壓差,比純碳低了620mV。在100mA/gcarbon電流密度以及500mAh/gcarbon的放電深度條件下,CaMnO3電極在循環80圈后放電電壓仍在2.35V以上,相比之下,純碳材料只能穩定循環25圈。
除了以上所提到的氧化物外,還有一些材料也表現出不錯的性能。如Kalubarme[48]等人合成了一種氧化鈰基催化劑Ce1-xZrxO2(x=0~0.5),其中Ce0.8Zr0.2O2正極具有最高達1620mAh/gcarbon的放電比容量。進一步將50%的Ce0.8Zr0.2O2和50%的MnO2混合使用,則電池的比容量還可以再提升12%。 Trahey[49]則合成了含鋰的金屬氧化物Li5FeO4和Li2MnO3-LiFeO2并用作鋰空氣電池正極催化劑。研究結果發現,Li5FeO4和Li2MnO3-LiFeO2可以通過酸活化的方式來移除Li2O2,最終,活化后的材料可以獲得比較高的放電比容量,顯示出較好的ORR催化活性。
3.2.2 貴金屬及其氧化物
無論是在工業生產還是電催化試驗中,貴金屬及其氧化物都是理想的催化材料,在鋰空氣電池正極催化劑材料的研究中,貴金屬也同樣是研究熱點。目前研究地比較多的貴金屬主要有Pt、Au、Pd、Ru和Ir等。
Lu[50,51]課題組系統研究過Pt和Au對鋰空氣電池ORR和OER的催化行為。結果如圖3-3所示,納米Pt具有優良的OER催化活性,而納米Au則具有較高的ORR催化活性。因此,同純碳電極相比,制備的負載在Vulcan XC-72碳上的Pt-Au納米復合材料電極放電電壓高出150mV~360mV,充電電壓則低900mV,表現出優良的ORR和OER催化活性。
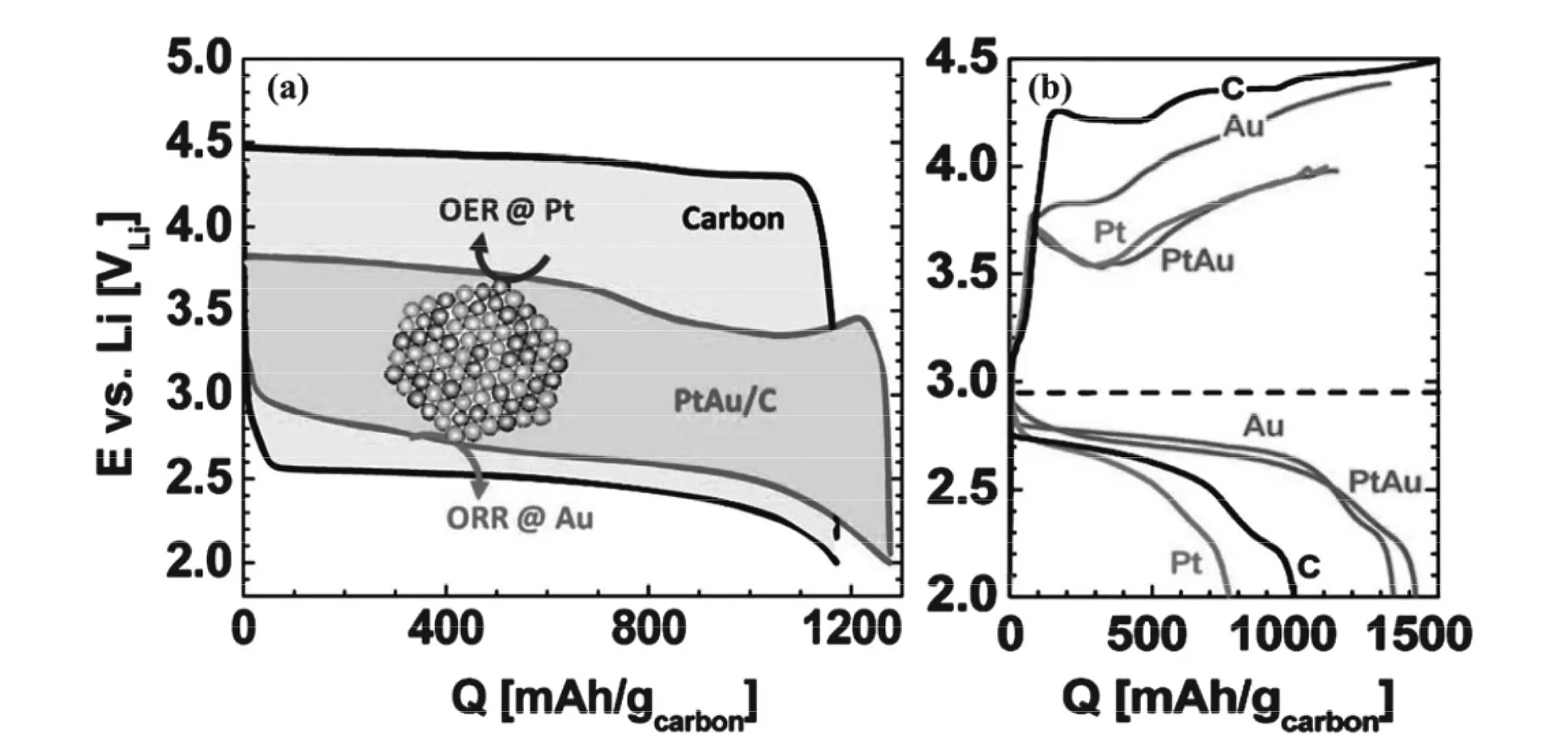
圖3-3 (a)不同材料首圈充放電曲線(電流密度:carbon 85 mA/g,Au/C、Pt/C、和 Pt Au/C 100 mA/g),(b)不同材料第三圈充放電曲線(電流密度:0.04 mA/cmelectrode2)[50,51]Fig.3-3 (a)First charge and discharge curve of different material(current density:carbon 85 mA/g;Au/C、Pt/C and Pt Au/C 100 mA/g),(b) charge and discharge curve for thirdcycle of different material(current density:0.04 mA/cmelectrode2) [50,51]
Su[52]等人通過化學還原法合成了一系列負載在Vulcan XC-72碳上的PtxCoy合金納米顆粒(包括Pt4Co/C、Pt2Co/C、PtCo/C、和PtCO2/C)。在100mA/g的電流密度下,PtCO2/C基電極具有最高的放電比容量(達3040mAh/g)。類似的,Kim[53]等人則合成了KB碳上負載平均直徑為3nm的Pt3Co合金納米顆粒復合材料(Pt3Co/KB),用作正極催化劑表現出優越的OER催化活性。在100mA/gcarbon 的電流密度下,相比于Pt/KB電極、α-MnO2/KB電極和純碳KB電極分別為635mv、1150mv以及1085mV的過電勢,Pt3Co/KB電極只有135mV的過電勢。研究人員認為,Pt3Co/KB材料更優的性能主要與材料表面Pt催化活性位點處對LiO2更小的吸附力有關。此外,合金催化劑可以抑制非晶態Li2O2的形成,從而有利于放電產物在充電過程中的分解。
Sun[54]等人合成了一種金屬Ru負載的催化劑,在200mA/gcarbon的電流密度下,表現出優異的綜合性能,包括高達9800mAh/gcarbon的放電比容量、低至0.37 V的充放電電壓差以及穩定充放電150圈的循環性能。Ke[55]等人則比較了Pt/C、Ir/C以及Pt-Ir/C 的催化性能,同純碳電極相比,雖然三種催化劑電極的放電比容量稍有下降,但其充電過電勢均有所下降,其中Pt-Ir/C電極具有最高的放電電壓和最低的充電電壓。
Jung[56]等人通過在還原氧化石墨烯上負載催化劑制備了Ru-rGO和RuO2·0.64H2O-rGO材料。在500mA/g electrode電流密度和5000mAh/g electrode放電深度條件下進行充放電實驗,同rGO正極4.3V的充電電壓相比,Ru-rGO和RuO2·0.64H2O-rGO正極的充電電壓分別為3.9V和 3.7 V,顯示出更好的OER催化性能。
3.3.3 其他催化劑
傳統催化劑材料一般是作為正極材料的一部分,依靠特殊的化學特性催化鋰空氣電池的ORR和OER過程。因此,在放電過程中,逐漸沉積在正極材料表面的放電產物就會覆蓋催化劑活性位點,使其對后續放電過程的催化作用受到影響,使電池的充放電過電勢升高。因此,近年來一些可以溶解在電解液中的氧化還原介體(Mred)用作鋰空氣電池催化劑得到廣泛關注。氧化還原介體主要充當電子-空穴傳輸介質,在充電過程中,介體Mred可以在電極表面直接被氧化形成其氧化態Mox,該氧化態介體隨后氧化分解電極表面的放電產物Li2O2,自身則又回到原始的Mred態。
Chen[57]等人研究了四硫富瓦烯(TTF)、二茂鐵(FC)和N,N,N,N-四甲基對苯二胺(TMPD)作為鋰空氣電池氧化還原介體的性能,發現FC和TMPD在電池充電過程中不穩定,而TTF則可以提升電池的充放電速率。同無添加TTF的電池相比,添加TTF的電池表現出更低的充電電壓和更好的循環穩定性。Kim[58]等人系統研究了LiI濃度對電池性能影響。結果顯示,同單獨引入Co3O4催化劑或者LiI介體的電池相比,同時引入Co3O4催化劑和LiI介體的電池具有最好的性能。此外,提高LiI的濃度還可以進一步降低電池的充電電壓和改善電池的循環性能。目前,對氧化還原介體(Mred)催化劑的研究仍然較少,但當前的一些研究結果顯示其對鋰空氣電池性能較為明顯的提升作用,將成為鋰空氣電池催化劑研究領域的一個重要方向。
4 總結與展望
鋰空氣電池極高的理論比容量顯示出其在可再生新能源應用以及長續航里程電動汽車領域的廣闊應用前景。發展至今,鋰空氣電池仍然存在許多問題亟待解決,距離其大規模商業化應用仍然有很長的路程要走,在這個過程中,高性能正極催化劑材料的研究和開發是關鍵。理想催化劑應具有低成本、高活性、高穩定性等特點,對正極催化劑的研究可以從現有材料入手,通過改進材料的制備方法和優化制備條件獲得具有不同形貌、結構及成分的材料,最終獲得電化學性能優越的正極催化劑材料。
[1] Girishkumar G, Mccloskey B, Luntz A C, et al. Lithium-Air Battery: Promise and Challenges[J]. Journal of Physical Chemistry Letters, 2010, 1(14): 2193-2203.
[2] Bruce P G, Freunberger S A, Hardwick L J, et al. Li-O2and Li-S batteries with high energy storage[J]. Nature Materials, 2012, 11(1): 19-29.
[3] 李慧,吳川,吳鋒,等. 超高比能量鋰-空氣電池最新研究進展[J]. 稀有金屬材料與工程,2014,43(6):1525-1530.
[4] Ogasawara T, Debart A, Holzapfel M, et a1. Rechargeable Li2O2Electrode for Lithium Batteries[J]. Journal of the American Chemical Society, 2006, 128(4): 1390-1393.
[5] Rahman M A, Wang X J, Wen C. A Review of High Energy Density Lithium-Air Battery Technology[J]. Journal of Applied Electrochemistry, 2014, 44: 5-22.
[6] Jung H G, Hassoun J, Park J B, et al. An improved high-performance lithium-air battery[J]. Nature Chemistry, 2012, 4(7): 579-585.
[7] Xu J J, Wang Z L, Xu D, et al. Tailoring deposition and morphology of discharge products towards high-rate and long-life lithium-oxygen batteries[J]. Nature Communications, 2013, 4(9): 2438-2438.
[8] Luo Z K, Liang C S, Wang F, et al. Optimizing Main Materials for a Lithium-Air Battery of High Cycle Life[J]. Advanced Functional Materials, 2014, 24(14): 2101-2105.
[9] Johnson L, Li C, Liu Z, et al. The role of LiO2solubility in O2reduction in aprotic solvents and its consequences for Li-O2batteries[J]. Nature Chemistry, 2014, 6(12): 1091-1099.
[10] Freunberger S A, Chen Y, Drewett N E, et al. The lithium-oxygen battery with ether-based electrolytes[J]. Angewandte Chemie International Edition, 2011, 50(37): 8609-8613.
[11] Mccloskey B D, Scheffler R, Speidel A, et al. On the Mechanism of Nonaqueous Li-O2Electrochemistry on C and Its Kinetic Overpotentials: Some Implications for Li-Air Batteries[J]. Journal of Physical Chemistry C, 2012, 116(45): 23897-23905.
[12] Laoire C O, Mukerjee S, Abraham K M, et al. Elucidating the Mechanism of Oxygen Reduction for Lithium-Air Battery Applications[J]. Journal of Physical Chemistry C, 2009, 113(46): 20127-20134.
[13] Freunberger S A,Chen Y,Peng Z,et al. Reactions in the Rechargeable Lithium-O2Battery with Alkyl Carbonate Electrolytes[J]. Journal of the American Chemical Society, 2011, 133(20): 8040-8047.
[14] Herranz J, Garsuch A, Gasteiger H A. Using Rotating Ring Disc Electrode Voltammetry to Quantify the Superoxide Radical Stability of Aprotic Li-Air Battery Electrolytes[J]. J.phys.chem.c, 2012, 116(36): 19084-19094.
[15] Xu W, Wang J, Ding F, et al. Lithium metal anodes for rechargeable batteries[J]. Energy & Environmental Science, 2013, 7(2): 513-537.
[16] Ding F, Xu W, Graff G L, et al. Dendrite-Free Lithium Deposition via Self-Healing Electrostatic Shield Mechanism[J]. Journal of the American Chemical Society, 2013, 135(11): 4450-4456.
[17] Ottakam Thotiyl M M, Freunberger S A, Peng Z, et al. The carbon electrode in nonaqueous Li-O2cells[J]. Journal of the American Chemical Society, 2013, 135(1): 494-500.
[18] Frackowiak E, Béguin F. Carbon materials for the electrochemical storage of energy in capacitors[J]. Carbon, 2001, 39(6): 937-950.
[19] Ming J, Park J B, Kim H S, et al. High surface area, mesoporous carbon for low-polarization, catalyst-free lithium oxygen battery[J]. Solid State Ionics, 2015, 278: 133-137.
[20] Huang S, Fan W, Guo X, et al. Positive Role of Surface Defects on Carbon Nanotube Cathodes in Overpotential and Capacity Retention of Rechargeable Lithium-Oxygen Batteries[J]. Acs Applied Materials & Interfaces, 2014, 6(23): 21567-21575.
[21] Guo Z, Zhou D, Liu H, et al. Synthesis of ruthenium oxide coated ordered mesoporous carbon nanofiber arrays as a catalyst for lithium oxygen battery[J]. Journal of Power Sources, 2015, 276: 181-188.
[22] Sun B, Huang X, Chen S, et al. Porous graphene nanoarchitectures: an efficient catalyst for low charge-overpotential, long life, and high capacity lithium-oxygen batteries[J]. Nano Letters, 2014, 14(6): 3145-3152.
[23] Xiao J, Mei D, Li X, et al. Hierarchically Porous Graphene as a Lithium-Air Battery Electrode[J]. Nano Letters, 2011, 11(11): 5071-5078.
[24] Hayashi M, Minowa H, Takahashi M, et a1. Surface Properties and Electrochemical Performance of Carbon Materials for Air Electrodes of Lithium-Air Batteries[J]. Electrochemistry, 2010, 78(5): 325-328.
[25] Tran C, Yang X Q, Qu D. Investigation of The Gas-Diffusion-Electrode Used as Lithium/Air Cathode in Non-aqueous Electrolyte and The Importance of Carbon Material Porosity[J]. Journal of Power Sources, 2010, 195(7): 2057-2063.
[26] Park J B, Lee J, Yoon C S, et al. Ordered Mesoporous Carbon Electrodes for Li-O2Batteries[J]. ACS Applied Materials & Interfaces, 2013, 5: 13426-13431.
[27] Sun B, Chen S Q, Liu H, et a1. Mesoporous Carbon Nanocube Architecture for High-Performance Lithium-Oxygen Batteries[J]. Advanced Functional Materials, 2015, 25(28): 4436-4444.
[28] Mitchell R R, Gallant B M, Thompson C V, et a1. All-Carbon-Nanofiber Electrodes for High-Energy Rechargeable Li-O2Batteries[J]. Energy & Environmental Science, 2011, 4: 2952-2958.
[29] Lim H D, Park K Y, Song H, et a1. Enhanced Power and Rechargeability of A Li-O2Battery Based on a Hierarchical-Fibril CNT Electrode[J]. Advanced Materials, 2013, 25: 1348-1352.
[30] Williford R E, Zhang J G. Air Electrode Design for Sustained High Power Operation of Li/Air Batteries[J]. Journal of Power Sources, 2009, 194: 1164 -1170.
[31] Yang X H, He P, Xia Y Y. Preparation of Mesocellular Carbon Foam and Its Application for Lithium/Oxygen Battery[J]. Electrochemistry Communications, 2009, 11: 1127-1130.
[32] Guo Z, Zhou D, Dong X, et a1. Ordered Hierarchical Mesoporous /Macroporous Carbon: A High-Performance Catalyst for Rechargeable Li-O2Batteries[J]. Advanced Materials, 2013, 25: 5668-5672.
[33] Kichambare P, Kumar J, Rodrigues S, et a1. Electrochemical Performance of Highly Mesoporous Nitrogen Doped Carbon Cathode in Lithium-Oxygen Batteries[J]. Journal of Power Sources, 201l, 196(6): 3310-3316.
[34] Nie H J, Zhang H M, Zhang Y M, et a1. Nitrogen Enriched Mesoporous Carbon As a High Capacity Cathode in Lithium-Oxygen Batteries[J]. Nanoscale, 2013, 5: 8484-8487.
[35] Wang J, Li Y, Li X, et a1. Nitrogen-Doped Carbon Nanotubes As Cathode for Lithium-Air Batteries[J]. Electrochemistry Communications, 2011, 13(7): 668-672.
[36] Oloniyo O, Kumar S, Scott K. Performance of MnO2Crystallographic Phases in Rechargeable Lithium-Air Oxygen Cathode[J]. Journal of Electronic Materials, 2012, 41(5): 921-927.
[37] Song K, Jung J, Heo Y U, et al. α-MnO2nanowire catalysts with ultra-high capacity and extremely low overpotential in lithium-air batteries through tailored surface arrangement[J]. Physical Chemistry Chemical Physics Pccp, 2013, 15(46): 20075-20079.
[38] Lee J H, Black R, Popov G, et al. The role of vacancies and defects in Na0.44MnO2nanowire catalysts for lithium-oxygen batteries[J]. Energy & Environmental Science, 2012, 5(11): 9558-9565.
[39] Shao Y, Park S, Xiao J, et al. Electrocatalysts for Nonaqueous Lithium-Air Batteries: Status, Challenges, and Perspective[J]. Acs Catalysis, 2012, 2(5): 844-857.
[40] Riaz A, Jung K N, Chang W, et al. Carbon-free cobalt oxide cathodes with tunable nanoarchitectures for rechargeable lithium-oxygen batteries[J]. Chemical Communications, 2013, 49(53): 5984-5986.
[41] Anandan V, Kudla R, Drews A, et al. Mixed Metal Oxide Catalysts for Rechargeable Lithium-Air Batteries[J]. Ecs Transactions, 2012, 41: 167-174.
[42] Li Y, Zou L, Li J, et al. Synthesis of ordered mesoporous NiCO2O4via hard template and its application as bifunctional electrocatalyst for Li-O2batteries[J]. Electrochimica Acta, 2014, 129(10): 14-20.
[43] Thapa A K. Pd/MnO2Air Electrode Catalyst for Rechargeable Lithium/Air Battery[J]. Electrochemical & Solid State Letters, 2010, 13(11): A165-A167.
[44] Barile C J, Gewirth A A. Investigating the Li-O2Battery in an Ether-Based Electrolyte Using Differential Electrochemical Mass Spectrometry[J]. Journal of the Electrochemical Society, 2013, 160(4): A549-A552.
[45] Lee J S, Sun T K, Cao R, et al. Metal-Air Batteries: Metal-Air Batteries with High Energy Density: Li-Air versus Zn-Air (Adv. Energy Mater. 1/2011)[J]. Advanced Energy Materials, 2011, 1(1): 2-2.
[46] Fu Z, Lin X, Huang T, et al. Nano-sized La0.8Sr0.2MnO3, as oxygen reduction catalyst in nonaqueous Li/O2, batteries[J]. Journal of Solid State Electrochemistry, 2012, 16(4): 1447-1452.
[47] Han X, Hu Y, Yang J, et al. Porous perovskite CaMnO3as an electrocatalyst for rechargeable Li-O2batteries[J]. Chemical Communications, 2013, 50(12): 1497-1499.
[48] Kalubarme R S, Cho M S, Kim J K, et al. Ceria based catalyst for cathode in non-aqueous electrolyte based Li/O2batteries[J]. Nanotechnology, 2012, 23(43): 435703-435703.
[49] Trahey L, Johnson C S, Vaughey J T, et al. Activated Lithium-Metal-Oxides as Catalytic Electrodes for Li-O2Cells[J]. Electrochemical Society, 2011, 14(5): A64-A66.
[50] Lu Y C, Gasteiger H A, Parent M C, et al. The Influence of Catalysts on Discharge and Charge Voltages of Rechargeable Li-Oxygen Batteries[J]. Electrochemical and Solid-State Letters, 2010, 13(6): A69-A72.
[51] Lu Y C, Xu Z, Gasteiger H A, et al. Platinum-gold nanoparticles: a highly active bifunctional electrocatalyst for rechargeable lithium-air batteries[J]. Journal of the American Chemical Society, 2010, 132(35): 12170-12171.
[52] Kanasugi H. A study of PtxCoy, alloy nanoparticles as cathode catalysts for lithium-air batteries with improved catalytic activity[J]. Journal of Power Sources, 2013, 244(4): 488-493.
[53] Kim B G, Kim H J, Back S, et al. Improved reversibility in lithium-oxygen battery: understanding elementary reactions and surface charge engineering of metal alloy catalyst[J]. Scientific Reports, 2014, 4(7489): 4225.
[54] Sun B, Munroe P, Wang G. Ruthenium nanocrystals as cathode catalysts for lithium-oxygen batteries with a superior performance[J]. Scientific Reports, 2013, 3(7): 2247.
[55] Ke F S, Solomon B C, Ma S G, et al. Metal-carbon nanocomposites as the oxygen electrode for rechargeable lithium-air batteries[J]. Electrochimica Acta, 2012, 85(4): 444-449.
[56] Jung H G, Jeong Y S, Park J B, et al. Ruthenium-based electrocatalysts supported on reduced graphene oxide for lithium-air batteries[J]. Acs Nano, 2013, 7(4): 3532-3539.
[57] Chen Y, Freunberger S A, Peng Z, et al. Charging a Li-O2battery using a redox mediator[J]. Nature Chemistry, 2013, 5(6): 489-494.
[58] Kim D S, Yong J P. Effect of multi-catalysts on rechargeable Li-air batteries[J]. Journal of Alloys & Compounds, 2014, 591(591): 164-169.

