A型肉毒素局部注射結合強化運動治療對腦卒中后下肢痙攣患者步行能力的影響
李亞斌 馮海霞 白佳佳 蘇明莉 韓麗媛 包愛強 梁學鏢 喬小紅
甘肅省康復中心醫院 蘭州 730000
A型肉毒素局部注射結合強化運動治療對腦卒中后下肢痙攣患者步行能力的影響
李亞斌 馮海霞△白佳佳 蘇明莉 韓麗媛 包愛強 梁學鏢 喬小紅
甘肅省康復中心醫院 蘭州 730000
目的 初步觀察A型肉毒素局部注射結合強化運動治療對腦卒中后下肢痙攣患者步行能力的影響。方法 將40例腦卒中后下肢痙攣患者根據隨機數字表法分為治療組和對照組,每組20例,對照組給予下肢痙攣肌群A型肉毒素局部注射加常規康復治療,治療組在此基礎上強化運動治療。分別于治療前、治療后4周、治療后8周對2組患者進行MAS(改良Ashworth量表)、IEMG(肌表面肌電積分值)、PROM(被動關節活動度)、10 m MWS(10 m最快步行速度)、FMA(Fugl-Meyer運動功能)、PCI(生理消耗指數)評分。結果 治療4周及8周后,2組MAS、IEMG、PROM、10 m MWS、FMA、PCI評分較組內治療前均顯著改善,差異有統計學意義(P<0.05);治療4周后,治療組PROM(4.39±1.25)°、10 m MWS(18.12±3.47)m/s、FMA(25.16±2.55)分、PCI(0.51±0.21)等指標顯著優于對照組,差異有統計學意義(P<0.05),而MAS(1.54±0.48)分、IEMG(37.95±4.48)分等指標差異無統計學意義(P>0.05);治療8周后,治療組PROM(4.42±1.01)°、10 m MWS(14.11±2.83)m/s等指標顯著優于對照組,差異有統計學意義(P<0.05),而MAS(1.63±0.57)分、IEMG(46.94±8.17)分、FMA(26.44±2.12)分、PCI(0.47±0.15)等指標差異無統計學意義(P>0.05)。結論 A型肉毒素局部注射結合強化運動治療可改善腦卒中后下肢痙攣患者的步行能力,可作為一種康復治療手段應用于臨床。
下肢痙攣;A型肉毒毒素;強化運動治療;步行能力
相關研究發現,腦卒中后62%以上的患者出現上肢屈肌肌群痙攣及下肢脛后肌、小腿三頭肌等肌群痙攣[1],嚴重影響患者日常生活及步行能力的提高,盡早、有效地改善步行功能是腦卒中后患者康復的主要目標之一。下肢痙攣不僅影響患者肢體運動功能的恢復及步行能力的提高,還可造成攣縮、畸形、疼痛等并發癥,限制軀體活動,加重肌肉無力、改變肌肉生理、減少關節活動范圍,繼而引起限制功能的代償性運動模式,如何很好地緩解腦卒中后下肢出現的痙攣,是改善患者步行能力和提高患者日常生活活動能力的關鍵[2]。A型肉毒毒素(botulinum toxin type A)局部多點注射可有效降低靶肌群的肌痙攣,改善患者的運動功能[3],作為一種安全、有效、高選擇性的神經肌肉接頭阻滯劑,在有效緩解肌肉痙攣、增加關節活動度、提高步速、改善步態、提高日常生活能力等方面均取得很好療效[4]。強化運動治療通過對患側肢體在正確的運動模式下進行反復的強化訓練,可促進腦卒中患者大腦中環路重組并提高突觸訓練效率,反復的運動輸入使高閾值突觸被高頻率的刺激降低,從而處于被激活狀態[5],不僅加強了中樞對外周神經支配的相關肌群的聯系,恢復并增強相關肌群的肌力以拮抗痙攣肌群,且減弱了痙攣肌群的興奮性,使痙攣肌群肌張力下降。本研究在腦卒中后下肢痙攣患者A型肉毒素局部多點注射加常規康復治療的基礎上,配合強化運動治療下肢痙攣患者20例,旨在觀察A型肉毒素局部多點注射結合強化運動治療對腦卒中后下肢肌痙攣患者步行能力的影響。
1 資料與方法
1.1 入選標準 (1)診斷符合2004年中華醫學會神經病學分會制定的《中國腦血管病防治指南》中腦梗死和腦出血的標準,并經頭顱CT或MRI證實;(2)初次發病,病情穩定,意識清醒,能配合完成訓練及評估;(3)有明顯的痙攣性足下垂或足內翻,經常規物理療法和藥物治療難以控制;(4)經Fugl-Meyer下肢運動功能評定量表(Fugl-Meyer assessment of lower extremity motor,FMA-L)評定,總分≥l0分,可獨立或在監視下行走>10 m;(5)踝關節被動背伸時,改良Ashworth 評級(modified Ashworth scale,MAS)為Ⅱ~Ⅲ級;(6)3個月<病程<1 a,且年齡<60歲。
1.2 排除標準 (1)雙側大腦發生病變,雙側肢體功能均有障礙,病灶位于小腦或腦干部位;(2)存在偏側空間忽略,視力障礙、復視嚴重影響步行功能;(3)靶肌群已有組織粘連、跟腱攣縮或曾應用過A型肉毒素;(4)存在非腦卒中因素所致的下肢功能障礙,如骨性關節炎、外傷或周圍神經損傷;(5)合并嚴重心、肺、肝、腎等重要器官疾病;(6)存在嚴重認知功能障礙或精神功能異常,無法配合訓練。
1.3 一般資料 選取2015-03-2016-03在甘肅省康復中心醫院神經康復科住院就診的患者40例,所有患者行A型肉毒素治療前均簽署書面知情同意書。按照隨機數字表法分為對照組和治療組,每組20例,2組一般資料比較差異無統計學意義(P>0.05)。見表1。

表1 2組一般資料比較 (n)
1.2 治療方法 2組均行下肢痙攣肌群A型肉毒素多點局部注射,注射2 d后采取以神經肌肉促進技術為主的常規康復方案治療,包括反射性抑制、站起和坐下訓練、站立位平衡功能訓練、軀干肌、髖膝關節控制訓練、踝背屈誘發訓練、患側下肢支撐練習、步行能力及日常生活活動能力訓練,1次/d,40 min/次,每周治療6 d,連續治療8周。治療組在常規治療的基礎上進行強化運動治療,每日分次共約4 h的強化運動訓練,其中2 h由治療師完成,另2 h由家屬監督完成。
1.2.1 外周神經電刺激儀定位A型肉毒素注射:40例患者均在(YZB/蘇0053-2009外周神經電刺激儀)引導下,實施A型肉毒素局部注射。A型肉毒素系蘭州生物技術開發有限公司研制的凍干結晶毒素,按需常規配置,濃度為100 U / mL,一般每塊肌肉2~3 個位點,每個位點不超過0.5 mL。根據臨床檢查選擇靶肌肉的A型肉毒素注射:通過反向牽張踝關節,判定所需注射肌肉;在外周神經電刺激儀進行局部靶肌肉定位后,進行局部注射治療;對于單純足下垂的患者,選取腓腸肌及比目魚肌上1/3處進行直流電刺激定位;伴痙攣型足內翻者,同時選取脛后肌;伴明顯的足趾痙攣者,加選趾長屈肌及拇趾長屈肌。每塊肌肉的注射劑量及總劑量由靶肌的大小及痙攣程度決定,藥物劑量個體化,具體注射劑量及位點[6]。見表2。
1.2.2 強化運動治療[7]:坐站位持久力訓練;佩戴足踝矯形器后進行站立訓練,下肢功能改善后,及時進行步行訓練;分離動作訓練(被動、助力或主動運動)髖關節屈、伸,內、外旋,外展、內收,膝關節屈、伸和踝關節背屈,每天各做50~100次;增加步行距離,提高步行速度。訓練強度以訓練時心率不超過最大心率的60%~80%,次日不出現明顯疲勞為原則,強化訓練中要讓患者家屬積極參與,監督任務完成情況或給予必要的幫助。

表2 注射劑量及位點
1.3 療效判定 在治療前和治療4周、8周后由1名治療師在單盲狀態下評估2組療效。
1.3.1 改良Ashworth量表:按照肌張力的高低分為0級、Ⅰ級、Ⅰ+級、Ⅱ級、Ⅲ級、Ⅳ級,按照肌張力分級分別計分值為0~5分。
1.3.2 肌表面肌電積分值(Intergrated EMG,IEMG)[8]:采用 Kpoint肌電圖表面電極采集患者小腿跖屈肌群、足內翻肌群的肌電信號,評估肌張力變化,并進行信號轉換分析,最終以數字形式顯示。
1.3.3 被動關節活動度(passive range of motion,PROM)[9]:測量踝關節被動活動度(踝背屈),患者仰臥休息位,膝關節伸直,采用手動量角器測量踝關節背屈和外翻角度,踝關節中立位設為0°,背屈位設為正值,跖屈位設為負值。
1.3.4 10 m最快步行速度(10-meter maximum walking speed,10 m MWS)測試[10]:囑患者在平地上盡可能快地直線步行16 m,記錄患者到達3 m標及離開13 m標所需的時間(確保患者安全,時間精確到0.1 s)。共測試3次,每次測試間隔2 min,取患者3次中最快的1次。
1.3.5 Fugl-Meyer運動功能(Fugl-Meyer assessment,FMA):FMA評定下肢(34分)的運動功能,分值越高,運動功能越好。
1.3.6 生理消耗指數(physiological cost index,PCI)測試[11]:先讓患者保持安靜狀態3 min后測定安靜狀態下的心率(次/min),再讓患者以自由或盡可能最快的步行狀態在平地上持續步行3 min,記錄患者每分鐘步行距離(m/min)和步行3 min后的心率(次/min)。共測試3次,每次測試間歇5 min,取平均值。PCI計算公式:PCI=(步行3 min后的心率-安靜狀態下的心率)/步行速度。
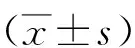
2 結果
治療前,2組MAS、IEMG、PROM、10 m MWS、FMA、PCI評分比較差異均無統計學意義(P>0.05)。治療4周后,2組MAS、IEMG、PROM、10 m MWS、FMA、PCI評分較組內治療前均有顯著改善,差異有統計學意義(P<0.05);治療組治療后PROM、10 m MWS、FMA、PCI等指標顯著優于對照組,差異具有統計學意義(P<0.05),而MAS、IEMG等指標差異無統計學意義(P>0.05)。治療8周后,2組MAS、IEMG、PROM、10 m MWS、FMA、PCI評分均較治療前顯著改善,差異有統計學意義(P<0.05);治療組治療后PROM、10 m MWS等指標優于對照組,差異有統計學意義(P<0.05),而MAS、IEMG、FMA、PCI等指標差異無統計學意義(P>0.05)。見表3。
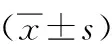
表3 2組治療前后相關評定指標比較
注:與組內治療前比較,aP<0.05;與對照組治療后比較,bP<0.05
3 討論
本研究結果表明,外周神經電刺激定位下A型肉毒素局部多點注射加康復訓練在改善腦卒中下肢痙攣患者的步行能力方面具有良好的臨床效果。已有研究結果證明,對腦卒中后下肢痙攣患者注射A型肉毒毒素后,輔以康復治療,治療后2、4、8及12周肌肉痙攣的改善程度(MAS、IEMG)、關節被動屈曲改善情況(PROM)、10米步速(10 m MWS)及患肢運動功能(FMA)明顯改善,痙攣狀態緩解,功能活動及自理能力等方面明顯改善[12],其患肢功能的改善充分說明,對患肢進行康復訓練的作用是不可忽視的。本文治療組在A型肉毒素局部多點注射加常規康復訓練的基礎上采取強化運動治療4周后,可顯著擴大踝關節的被動活動度、提高步速、改善患側下肢運動功能、減少能量消耗,其療效顯著優于對照組,但在肌力及肌張力方面無明顯優勢。Takao 等[13]研究發現,重復多次的正確運動模式下的強化訓練,可顯著改善腦卒中偏癱患者患側下肢踝背屈角度、動態平衡能力及步行速度,從而改善步行功能,與本研究結果相符。本文治療8周后,治療組在提高踝關節被動活動范圍及改善步速方面較對照組有顯著療效,而在下肢運動功能、能量消耗、肌力及肌張力改善方面與對照組無明顯差距,與國外相關研究結果接近,其機制可能與患者經過長期反復的積極康復訓練,拮抗肌群肌力逐漸增強,足背伸肌群和跖屈肌群間肌力均衡有關。
腦卒中后偏癱患者下肢伸肌痙攣模式常會加重患側小腿三頭肌及脛后肌的痙攣,導致足背伸肌群和跖屈肌群間肌力不均衡,在行走時出現足下垂內翻的異常運動模式,嚴重影響患者的步行能力及日常生活能力。A型肉毒毒素能夠有效降低肌痙攣,有效持續時間為3~6個月,在這有限的時間內配合康復訓練,能夠重新建立伸、屈肌的協調及控制能力,恢復運動功能和運動模式,從而改善患肢功能。中樞神經系統損傷后功能康復的重要依據是腦的可塑性理論和大腦功能重組理論[15],但大腦皮質功能自然發生的重組是有限的,神經環路的再生重組及加強突觸間聯系須通過反復實踐才能完成[16],要提高患者功能恢復的程度,運動訓練是極為重要的因素之一。卒中后患者在功能訓練中,一旦建立正常的運動模式,就必須反復訓練,強化維持這種模式,通過重復使用和強化訓練可引起對側皮質代表區擴大和同側皮質的募集,導致功能依賴性皮質重組[17]。通過多次重復的運動治療,增加肌肉的本體感覺輸入,盡早建立出新的神經反饋通路,激活高閾值突觸,并處于常被使用的狀態,從而增強受損肌肉的收縮能力,減少肌肉過度伸展,降低肌肉疲勞及痙攣發生,加速下肢運動障礙的恢復[18]。痙攣肌群肉毒素注射后給予強化運動治療可加速肉毒素的內化,增強療效。針對腦卒中后下肢痙攣患者步行中出現的功能障礙,在給予下肢痙攣肌群A型肉毒素局部多點注射加常規康復治療的基礎上,采用強化運動治療策略,在提高踝關節被動活動范圍及改善步速方面具有長期療效。
本課題針對腦卒中后下肢痙攣所致的異常步態,給予痙攣肌群A型肉毒素局部多點注射聯合強化運動治療,其技術簡便易行,較易于臨床推廣,適用于康復醫療條件較差的西部地區。因本研究屬于小樣本研究,且表面肌電圖不能有效記錄小腿后群深部肌肉的信號,在步態評估方面,還有待于進一步更大樣本量及更深入的研究。
[1] Krewer C,Hartl S,Müller F,et al.Effects of repetitive peripheral magnetic stimulation on upper-limb spasticity and impairment in patients with spastic hemiparesis:a randomized,double-blind,sham-controlled study[J].Arch Phys Med Rehabil,2014,95(6):1 039-1 047.
[2] Li F,Wu Y,Li X.Test-retest reliability and inter-rater reliability of the Modified Tardieu Scale and the Modified Ashworth Scale in hemiplegic patients with stroke[J].Eur J Phys Rehabil Med,2014,50(1):9-15.
[3] Jost WH,Hefter H,Reissig A,et al.Efficacy and safety of botulinum toxin type A(Dysport)for the treatment of post-stroke arm spasticity:results of the German-Austrian open-label post-marketing surveillance prospective study[J].J Neurol Sci,2014,337(1/2):86-90.
[4] Bollens B,Gustin T,Stoquart G,et al.A randomized controlled trial of selective neurotomy versus botulinum toxin for spastic equinovarus foot after stroke[J].Neurorehabil Neural Repair,2013,27(8):695-703.
[5] 畢研貞,鄭志雄,李康增,等.強化訓練對腦梗死患者運動功能恢復的影響[J].中國康復理論與實踐,2009, 15(7):664-665.
[6] 中國康復醫學會.肉毒毒素治療成人肢體痙攣狀態中國指南(2015)[J].中國康復醫學雜志,2015,30(1):81-110.
[7] Kwakkel G,Veerbeek JM,van Wegen EE,et al.Constraint-induced movement therapy after stroke[J].Lancet Neurol,2015,14(2):224-234.
[8] 楊堅,張穎.表面肌電圖在神經肌肉病損功能評估中的應用[J].中國臨床康復,2004,8(22):4 580-4 581.
[9] 陳慶梅,孫海偉,李莉,等.電刺激定位肉毒素注射治療肌痙攣的臨床研究[J].中國康復,2014,29(6):442-446.
[10] 王鸝,馬朝陽,游菲,等.運動想象療法對腦卒中偏癱患者步行能力的影響[J].中華物理醫學與康復雜志,2014,36(5):353-356.
[11] Bowen TR,Lennon N,Castagno P,et al.Variability of energy-consumption measures in children with cerebral palsy[J].J Pediatr Orthop,1998,18(6):738-742.
[12] Yazdchi M,Ghasemi Z,Moshayedi H,et al.Comparing the efficacy of botulinum toxin with tizanidine in upper limb post stroke spasticity[J].Iran J Neurol,2013, 12(2):47-50.
[13] Takao T,Tanaka N,Iizuka N,et al.Improvement of gait ability with a short-term intensive gait rehabilitation program using body weight support treadmill training in community dwelling chronic poststroke survivors[J].J Phys Ther Sci,2015,27(1):159-163.
[14] Marklund I,Kl?ssbo M.Effects of lower limb intensive mass practice in poststroke patients:single-subject experimental design with long-term follow-up[J].Clin Rehabil,2006,20(7):568-576.
[15] Powell ES,Carrico C,Westgate PM,et al.Time configuration of combined neuromodulation and motor training after stroke:A proof-of-concept study[J].NeuroRehabilitation,2016,39(3):439-449.
[16] Ahmed AB,Cirstea CM.Positive Effect of Impairment-Oriented Training on N-Acetylaspartate Levels of Ipsilesional Motor Cortex in Subcortical Stroke:A Case Study[J].Int J Phys Med Rehabil,2016,4(1):325-331.
[17] Hubbard IJ,Carey LM,Budd TW,et al.A Randomized Controlled Trial of the Effect of Early Upper-Limb Training on Stroke Recovery and Brain Activation[J].Neurorehabil Neural Repair,2015,29(8):703-713.
[18] Opheim A,Danielsson A,Alt Murphy M,et al.Upper-limb spasticity during the first year after stroke:stroke arm longitudinal study at the University of Gothenburg[J].Am J Phys Med Rehabil,2014,93(10):884-896.
(收稿2016-11-06)
The effects of local injection with botulinum toxin type A uniting with intensive physical therapy on walking ability in patients with post-stroke spasticity of lower limbs
LiYabin,FengHaixia,BaiJiajia,SuMingli,HanLiyuan,BaoAiqiang,LiangXuebiao,QiaoXiaohong
RehabilitationCenterHospitalofGansuProvince,Lanzhou730000,China
Objective To preliminaprily observe the effects of local injection with botulinum toxin type A uniting with intensive physical therapy on walking ability in patients with post-stroke spasticity of lower limbs.Methods Forty patients with post-stroke spasticity of lower limbs were randomly divided into treatment group and control group,20 patients in each group.The control group received local injection with botulinum toxin type A in the spastic muscles of lower limbs and other conventional rehabilitation therapy.The treatment group received intensive physical therapy on the basis of control group.Before and four,eight weeks after treatment,the two groups were comparatively scored in MAS(Modified Ashworth Scale),IEMG(muscle surface electromyography integral value),PROM(passive range of motion),10 m MWS(10m fastest walking speed),FMA(Fugl-Meyer motor function) and PCI(physiological consumption index).Results Four and eight weeks after treatment,MAS,IEMG,PROM,10 m MWS,FMA and PCI scores were significantly improved in the two groups(P<0.05).Four weeks after treatment,PROM(4.39±1.25)°,10 m MWS(18.12±3.47)m/s,FMA(25.16±2.55),PCI(0.51±0.21) and other indicators in the treatment group were significantly better than those in the control group,and all the differences were statistically significant(P<0.05),while the MAS(1.54±0.48) and IEMG(37.95±4.48) showed no significant differences(P>0.05).After eight-week treatment,PROM(4.42±1.01)°,10 m MWS(14.11±2.83)m/s and other indicators in the treatment group were significantly superior to those in the control group(P<0.05),but MAS(1.63±0.57),IEMG(46.94±8.17),FMA(26.44±2.12),PCI(0.47±0.15) and other indicators showed no significant differences(P>0.05).Conclusion Local injection with botulinum toxin type A uniting with intensive physical therapy which can effectively improve walking ability in patients with post-stroke spasticity of lower limbs,should be considered as an available rehabilitation therapy.
Spasticity of lower limbs;Botulinum toxin type A;Intensive physical therapy;Walking ability
甘肅省自然科學基金項目(145RJZA107)
R743.3
A
1673-5110(2017)06-0005-05
△通訊作者:馮海霞,E-mail:feng_hai_xia@163.com

