免疫抑制劑對巨噬細胞Dectin-1和TLR2表達的影響
毛亞男 王 雯 王 東 張 波
(安徽醫科大學,合肥230032)
免疫抑制劑對巨噬細胞Dectin-1和TLR2表達的影響
毛亞男 王 雯①王 東①張 波
(安徽醫科大學,合肥230032)
目的:研究地塞米松、環磷酰胺、環孢素A和霉酚酸酯對小鼠RAW264.7巨噬細胞Dectin-1和TLR2受體表達的影響。方法:體外培養RAW264.7巨噬細胞,分別給予不同濃度的地塞米松、環磷酰胺、環孢素A和霉酚酸酯刺激細胞24 h,CCK-8檢測RAW264.7細胞毒性作用,RT-PCR檢測細胞Dectin-1和TLR2 mRNA表達情況,流式細胞術檢測Dectin-1和TLR2蛋白水平變化。結果:不同劑量的地塞米松、環磷酰胺、環孢素A和霉酚酸酯作用細胞24 h后均對細胞表現出一定的毒性作用(P<0.05),且隨著藥物濃度增加毒性作用越大。地塞米松降低Dectin-1 mRNA和蛋白水平的表達,上調TLR2受體轉錄和翻譯(P<0.05);環磷酰胺對巨噬細胞Dectin-1和TLR2的轉錄翻譯無明顯影響(P>0.05);霉酚酸酯和環孢素A能夠同時下調Dectin-1、TLR2 mRNA和蛋白水平表達(P<0.05)。結論:不同免疫抑制劑對模式識別受體表達的調節作用具有差異性,通過選擇性調節各自靶點PRRs的表達抑制機體對各種真菌病原體的免疫識別過程,同時也能夠抑制巨噬細胞的生長增殖,共同介導免疫抑制功能。
免疫抑制劑;Dectin-1;TLR2;巨噬細胞
天然免疫細胞、模式識別受體(Pattern recognition receptors,PRRs)及細胞因子等共同構成了復雜有機的先天性免疫網絡系統。病原微生物入侵機體后,其表面病原相關分子模式(Pathogen associated molecular patterns,PAMP)首先激活巨噬細胞等天然免疫前哨細胞表面的PRRs,進而活化細胞內部相應的信號轉導通路、分泌細胞因子、趨化中性粒細胞等吞噬細胞到達感染部位,誘導局部炎癥反應,吞噬、殺滅并清除入侵的致病微生物[1]。近期研究發現,C型凝集素受體家族成員Dectin-1和TLR2在抗真菌感染免疫反應中發揮重要作用,成為真菌感染免疫領域研究的熱點[2]。
免疫抑制劑是器官移植及自身免疫性疾病的常規用藥,其中地塞米松、環磷酰胺、環孢素A和霉酚酸酯是目前臨床常用的四種免疫抑制劑,通過不同的作用機制抑制機體的免疫功能。眾所周知,長期應用免疫抑制劑造成的侵襲性真菌感染一直是免疫抑制患者面臨的重要問題,嚴重威脅著免疫抑制患者的生存。有關免疫抑制劑對模式識別受體Dectin-1和TLR2調節作用的研究報道很罕見。本實驗以小鼠RAW264.7巨噬細胞為研究對象,探討上述四種免疫抑制劑對Dectin-1和TLR2表達的影響,從模式識別水平了解不同免疫抑制劑引起真菌感染作用機制之間的區別。
1 材料與方法
1.1 材料 小鼠RAW264.7巨噬細胞購自南京凱基生物公司細胞庫;環磷酰胺購自Sigma公司;霉酚酸酯、環孢素A購自大連美侖生物技術有限公司;地塞米松磷酸鈉注射液購自天津金耀藥業有限公司;超純RNA提取試劑盒,HiFi-MMLV cDNA第一鏈合成試劑盒,PCR Mixture(CWbio.Co.Ltd);抗小鼠 PE-Dectin-1 抗體,抗小鼠PE-TLR2抗體(Miltenyi biotec);CCK-8檢測試劑盒購自日本同仁公司。
1.2 方法
1.2.1 細胞培養及CCK-8細胞增殖毒性實驗 快速復蘇細胞,用含10%新生牛血清的RPMI1640培養基在37℃、5%CO2孵箱中培養,0.25%EDTA胰蛋白酶消化傳代,選取對數生長期狀態良好的細胞以1×105個/ml密度接種于96孔板中,每孔加100 μl 細胞懸液,邊緣孔以PBS緩沖液填充,培養24 h至細胞貼壁后進行藥物干預。實驗分組如下:空白對照組:等量完全培養基;地塞米松:(20、50、100、200、500 μg/ml);環磷酰胺:(0.05、0.1、0.2、0.5、1.0 mg/ml);環孢素A:(2.5、5、10、20、50 μg/ml);霉酚酸酯:(0.1、0.25、0.5、1.0、2.0 μg/ml)。干預24 h后棄凈原培養基,每孔加入110 μl CCK-8工作液(10 μl CCK-8溶液/100 μl完全培養基比例配制)繼續培養2 h。測定450nm吸光度,計算細胞存活率,分析不同免疫抑制劑對小鼠RAW264.7細胞毒性的影響。
1.2.2 藥物干預及實驗分組 實驗分5組:①空白對照組:加入等量完全培養基;②地塞米松組:分別加入不同濃度地塞米松(20、50、200 μg/ml);③環磷酰胺組:分別加入不同濃度環磷酰胺(0.05、0.2、0.5 μg/ml);④環孢素A組:分別加入不同濃度環孢素A(2.5、5、10 μg/ml);⑤霉酚酸酯組:分別加入不同濃度霉酚酸酯(0.1、0.25、0.5 μg/ml)。干預24 h后,結束藥物刺激。提取細胞總RNA采用RT-PCR檢測細胞Dectin-1和TLR2 mRNA表達水平的變化;收集細胞利用流式細胞技術檢測不同免疫抑制劑對RAW264.7巨噬細胞表面Dectin-1、TLR2蛋白表達的影響。
1.2.3 RT-PCR檢測Dectin-1、TLR2 mRNA表達 按照超純RNA提取試劑盒說明書提取細胞總RNA,紫外分光光度計檢測RNA純度和濃度。按照世紀康為HiFi-MMLV cDNA第一鏈合成試劑盒要求進行反轉錄,PCR擴增程序為:95℃預變性5 min→(95℃變性15 s→ 60℃退火/延伸1 min)×40個循環。引物由上海生工設計合成,序列如下:①Dectin-1 :(F)5′-AGACTTCAGCACTCAAGACATCCA-3′,(R)5′-CAGGATTCCTAAACCCACTGCAA-3′;②TL-R2:F5′-CCCACTTCAGGCTCTTTGAC-3′,(R)5′-GCCACTCCAGGTAGGTCTTG-3′;β-actin:(F)5′-TGAA-GATCAAGATCATTGCTCCTCC-3′,(R)5′-CTAGA-AGCATTTGCGGGGACGATG-3′。待反應結束后,采用2-ΔΔCT進行相對定量分析。
1.2.4 流式細胞術檢測Dectin-1、TLR2蛋白的表達 干預24 h后,用0.25%EDTA-胰蛋白酶消化細胞并轉移至流式管中,PBS漂洗后重懸細胞,分別加5 μl抗小鼠PE-Dectin-1抗體和抗小鼠PE-TLR2抗體,室溫避光20 min進行熒光標記染色,PBS漂洗離心,棄掉殘余抗體,上機檢測各組細胞的平均熒光強度。
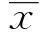
2 結果
2.1 不同種類和劑量免疫抑制劑對RAW264.7巨噬細胞活性的影響 CCK-8細胞增殖-毒性試驗結果(如圖1)顯示:地塞米松、環磷酰胺、環孢素A和霉酚酸酯作用細胞24 h后均對細胞表現出一定的毒性作用,且隨著藥物濃度的增加,毒性作用越大。所有加藥組的細胞生存率與空白對照組比較,P<0.05,差異均有統計學意義(見表1)。
2.2 不同種類和劑量免疫抑制劑對細胞Dectin-1、TLR2 mRNA表達的影響 如圖2所示,實驗發現不同劑量的地塞米松、環孢素A和霉酚酸酯單獨干預24 h后,RAW264.7巨噬細胞中Dectin-1 mRNA表達水平較空白對照組相比都降低(P<0.05),而三種濃度的環磷酰胺對細胞中Dectin-1 mRNA的表達無明顯影響(P>0.05);圖3結果顯示:地塞米松單獨干預RAW264.7巨噬細胞24 h后,低、中、高三種濃度的地塞米松均能提高細胞TLR2 mRNA的表達水平(P<0.05),尤以50 μg/ml濃度作用最為明顯。低、中、高三種濃度的環孢素A和霉酚酸酯均能下調巨噬細胞TLR2 mRNA的表達(P<0.05),不同劑量(0.05、0.2、0.5 mg/ml)的環磷酰胺刺激細胞24 h后,TLR2 mRNA水平與空白對照組比較,P>0.05,差異無統計學意義。

圖1 四種免疫抑制劑對RAW264.7巨噬細胞增殖的影響Fig.1 Effects of four immunosuppressants on proliferation of RAW264.7 cellsNote: DEX.Dexamethasone;CTX.Cyclophosphamide; CsA.Cyclosporin A; MMF.Mycophenolate mofetil.
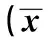


GroupsCellsurvivalrate(%)Controlgroup100DEX10μg/ml93.16±4.021)DEX50μg/ml90.52±3.071)DEX100μg/ml77.16±6.321)DEX200μg/ml65.41±8.251)DEX500μg/ml37.73±6.461)CTX0.05mg/ml101.03±7.131)CTX0.2mg/ml90.80±7.211)CTX0.5mg/ml70.77±1.521)CTX1.0mg/ml64.90±9.661)CTX2.0μg/ml35.90±2.831)CsA2.5μg/ml90.40±7.711)CsA5μg/ml74.01±4.541)CsA10μg/ml66.57±7.781)CsA20μg/ml59.12±9.131)CsA50μg/ml33.03±6.061)MMF0.1μg/ml97.40±3.66MMF0.25μg/ml69.33±2.231)MMF0.5μg/ml59.60±5.081)MMF1.0μg/ml33.42±8.801)MMF2.0μg/ml5.69±0.511)
Note:Compared with the control group,*.P<0.05.

圖2 四種免疫抑制劑對RAW264.7細胞Dectin-1 mRNA的影響Fig.2 Effect of immunosuppressants on expression of Dectin-1 ±s,n=6)Note: Compared with the control group,*.P<0.05.

圖3 四種免疫抑制劑對RAW264.7細胞TLR2 mRNA的影響Fig.3 Effect of immunosuppressants on expression of TLR2 ±s,n=6)Note: Compared with the control group,*.P<0.05.

圖4 四種免疫抑制劑對RAW264.7細胞Dectin-1(A-D)、TLR2(E-H)蛋白平均熒光強度的影響Fig.4 Effects of four immunosuppressants on MFI of Dectin-1(A-D),TLR2(E-H) protein on RAW264.7 macrophagesNote: Gray lines.The control group;Black lines.The experiment group.
2.3 不同種類和劑量免疫抑制劑對RAW264.7巨噬細胞表面Dectin-1、TLR2蛋白表達的影響 流式細胞術檢測結果如下圖(圖4A~4H)所示:RAW264.7巨噬細胞自身表達極低水平的Dectin-1蛋白,TLR2表達水平明顯高于Dectin-1蛋白水平。200 μg/ml的地塞米松干預RAW264.7細胞24 h后,細胞表面Dectin-1蛋白表達水平較空白對照組明顯降低(P<0.05),TLR2蛋白水平升高(P<0.05),差異具有統計學意義;環磷酰胺處理后細胞表面Dectin-1和TLR2蛋白熒光強度與空白組無明顯變化(P>0.05);而10 μg/ml的環孢素A以及0.5 μg/ml的霉酚酸酯單獨刺激細胞24 h后,細胞表面Dectin-1和TLR2蛋白的熒光強度與對照組比較顯著降低,差異均具有統計學意義(P<0.05)。
3 討論
免疫抑制劑在臨床上應用廣泛,主要用于治療自身免疫性疾病以及移植術后的急性排斥反應,促進移植物的存活。然而長期大量應用免疫抑制劑則會造成患者免疫力低下,真菌感染的發病率和病死率明顯增加,嚴重威脅免疫抑制患者的生存。免疫抑制劑種類繁多,根據作用方式可將其分為皮質類固醇家族抗炎藥、鈣調神經蛋白抑制劑、細胞毒性或抗增殖性藥物以及特異性抗體。地塞米松、環磷酰胺、環孢素A和霉酚酸酯是目前臨床上最為常用的具有代表性的四種免疫抑制劑,通過不同的作用機制抑制免疫細胞的功能,而這些免疫抑制作用是否涉及調節天然免疫系統對病原微生物PAMPs的模式識別過程以及不同免疫抑制劑對模式識別受體影響之間的差別目前尚不明確。
PRRs對真菌病原體PAMPs的識別過程是抵御真菌感染的始動環節,進一步啟動機體的先天性免疫反應和適應性免疫反應[3],TR2和C型凝集素受體Dectin-1是天然免疫系統中的重要PRRs,能夠識別一系列真菌病原體,協同誘導產生高效的抗真菌免疫反應,在宿主的防御機制中發揮著核心性的作用[2]。Dectin-1和/或TLR2受體發生基因突變、缺失或受到抑制都將會導致機體抵御真菌感染的能力減弱。早前有學者發現Dectin-1缺陷的造血干細胞移植受體[4]以及Dectin-1早期終止密碼子Y238X突變患者[5],更容易罹患侵襲性真菌感染。Dectin-1參與真菌感染的重要性在小鼠模型中也得到了證明:Dectin-1缺陷導致機體無法啟動有效的炎癥反應來控制真菌的播散[6]。氣管內接種煙曲霉孢子的TLR2基因敲除小鼠較正常組而言呼吸窘迫癥狀更加嚴重,真菌負荷也明顯高于對照組[7]。而新型隱球菌感染TLR2-/-和Myd88-/-小鼠模型,感染動物體內炎性因子TNF-α、IL-12p40和/或IFN-γ水平明顯減少[8]。這些結果充分說明了Dectin-1和TLR2在機體抵抗真菌感染性疾病方面的重要性。
地塞米松是具有強大免疫抑制功能的長效類糖皮質激素,能夠增加信號蛋白IB的基因轉錄,阻斷鈣離子載體對單核和其他淋巴細胞起作用,調節多種炎性因子的表達并抑制吞噬細胞向炎癥局部移動,從而發揮免疫抑制作用[9]。早在2003年,Willment等[10]發現地塞米松是Dectin-1 mRNA表達的負向調節劑,且僅在24 h時下調Dectin-1 mRNA表達水平。而有關地塞米松對模式識別受體TLR2影響的結果則不盡相同,多數文獻報道認為地塞米松顯著上調TLR2的表達水平[11],也有文獻稱地塞米松對TLR2的表達無明顯影響[12]或呈現出抑制性的調節作用[13]。我們的實驗結果發現地塞米松單獨干預24 h對正常狀態下的RAW264.7巨噬細胞Dectin-1 mRNA和蛋白水平的表達均表現出明顯的抑制作用,而地塞米松對TLR2受體的轉錄和翻譯卻起上調作用。此外,我們的實驗也證實大劑量地塞米松對巨噬細胞具有明顯的毒性作用。由此我們推測地塞米松通過抑制巨噬細胞生長,抑制Dectin-1的表達,干擾機體的免疫識別,從而發揮免疫抑制效應。
環磷酰胺是一種烷化劑類的廣譜抗腫瘤藥,也是目前免疫抑制作用最強、應用最廣泛的細胞毒性免疫抑制藥。與糖皮質激素不同,環磷酰胺主要殺滅B淋巴細胞,抑制T淋巴細胞的功能,干擾細胞的增殖功能,介導快速的、非選擇性的抗原敏感性小淋巴細胞的殺傷,進而發揮強大的免疫抑制作用。早前Yang等[14]發現接受環磷酰胺干預的曲霉菌感染小鼠模型與僅單純接種曲霉菌的小鼠感染模型相比,Dectin-1表達水平受到抑制,真菌負荷相對增加。栗方等[15]也得出了相似的結論,并同時證明環磷酰胺下調TLR2和TLR4的轉錄水平。本研究結果顯示體外應用環磷酰胺干預細胞,對正常狀態巨噬細胞中的Dectin-1和TLR2 mRNA的表達均無明顯影響,但是隨著環磷酰胺濃度的增加,對細胞生長增殖的抑制功能越明顯。我們考慮導致這一結果的原因可能與各自的試驗條件不同如給藥劑量、藥物干預時間以及體內外微環境的不同有關。
環孢素A也能夠通過影響天然免疫的模式識別過程發揮免疫抑制作用,但是相關文獻報道太少且結果存在爭議:我國學者發現皮下注射環孢素A的大鼠TLR2和TLR4 mRNA和蛋白水平和空白組比較明顯升高[16];而Greenblatt等[17]認為Dectin-1是環孢素A作用機制的上游元件,環孢素A對細胞因子IL-10表達的下調作用主要是通過抑制Dectin-1信號通路實現,從而介導對中性粒細胞的抗真菌免疫功能的調控,而與TLR2/Myd88通路無關。環孢素A屬于鈣調磷酸酶抑制劑,是一種特異性T淋巴細胞功能調節藥,能夠選擇性下調T淋巴細胞相關因子如IL-2、TNF-α的釋放,削弱宿主的體液/細胞免疫。本研究結果證明環孢素A能夠抑制巨噬細胞生長,對細胞的毒性作用具有劑量依賴性。此外,環孢素單獨作用細胞能夠下調Dectin-1、TLR2 mRNA和蛋白的表達水平,抑制Dectin-1和TLR2的轉錄和翻譯。其中大劑量的環孢素對Dectin-1 mRNA表達水平的抑制作用尤為明顯,說明環孢素A能同時抑制Dectin-1和TLR2信號通路,從而發揮免疫抑制功能。
霉酚酸酯是器官移植領域常用的免疫抑制劑,主要通過次黃嘌呤核苷酸脫氫酶的活性,抑制T/B淋巴細胞增殖并減少B淋巴細胞分泌相關抗體發揮強效的、選擇性的免疫抑制功能。霉酚酸酯是否能夠影響宿主的模式識別受體表達水平介導免疫抑制功能,目前尚不清楚。我們的研究結果發現,霉酚酸酯同環孢素作用相似,也能夠下調正常狀態細胞Dectin-1、TLR2的轉錄和翻譯,抑制Dectin-1、TLR2 mRNA和蛋白水平的表達,抑制細胞的生長,表現出一定的免疫抑制作用,且這一抑制效應具有明顯的濃度依賴性。
綜上所述,四種免疫抑制劑均對小鼠RAW264.7巨噬細胞的生長增殖具有抑制作用。而不同免疫抑制劑對天然免疫系統模式識別過程的影響則具有一定的差異性:地塞米松能夠下調正常狀態下Dectin-1的轉錄和翻譯發揮免疫抑制效應;體外環磷酰胺干預并不影響巨噬細胞Dectin-1和TLR2的轉錄翻譯;霉酚酸酯和環孢素A能夠同時下調Dectin-1、TLR2 mRNA和蛋白水平的表達。因此我們認為在模式識別水平,不同免疫抑制劑發揮免疫抑制效應的作用機制也不盡相同,通過選擇性調節各自靶點PRRs的表達抑制機體對各種真菌病原體的免疫識別功能。
[1] Lemoine S,Jaron B,Tabka S,etal.Dectin-1 activation unlocks IL12A expression and reveals the TH1 potency of neonatal dendritic cells [J].J Allergy Clin Immunol,2015,136(5):1355-1368.
[2] 駱雪萍.真菌細胞壁病原相關分子模式TLR/Dectin-1通路及相關細胞因子的免疫作用[J].細胞與分子免疫學雜志,2014,30(8):892-895.
[3] Qiang X,Zhao G,Jing L,etal.Role of Dectin-1 in the innate immune response of rat corneal epithelial cells to Aspergillus fumigatus[J].BMC Ophthalmol,2015,15(1):1-7.
[4] Lemaitre B,Nicolas E,Michaut L,etal.The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response in Drosophila adults [J].Cell,1996,86(6):973-983.
[5] Kumar H,Kawai T,Akira S.Toll-like receptors and innate immunity[J].Biochem Biophys Res Commun,2009,388(4):621-625.
[6] Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[7] Kimura Y,Chihara K,Honjoh C,etal.Dectin-1-mediated signaling leads to characteristic gene expressions and cytokine secretion via syk in rat mast cells[J].J Biol Chem,2014,289(45):31565-31575.
[8] Warshakoon HJ,Hood JD,Kimbrell MR,etal.Potential adjuvantic properties of innate immune stimuli[J].Hum Vaccin,2009,5(6):381-394.
[9] 王 明,何 懿,劉占國,等.不同免疫抑制劑對全血細胞單核細胞趨化蛋白1分泌的影響[J].中國組織工程研究與臨床康復,2010,14(18):3314-3317.
[10] Willment JA,Lin HH,Reid DM,etal.Dectin-1 expression and function are enhanced on alternatively activated and GM-CSF-treated macrophages and are negatively regulated by IL-10,dexamethasone,and lipopolysaccharide[J].J Immunol,2003,171(9):4569-4573.
[11] 劉日明,吳健民,高 巖,等.地塞米松對小鼠哮喘模型脾巨噬細胞TLR2和TLR4 mRNA表達的影響[J].中華微生物學和免疫學雜志,2005,25(9):742-746.
[12] 蔡文瑩,魯長明,李希清,等.地塞米松對F.monophora感染巨噬細胞模式識別受體及炎癥因子表達的影響[J].皮膚性病診療學雜志,2014,21(3):173-176.
[13] Bai L,Lu XH,Sun FY,etal.Blockade of toll-like receptor 2 expression and membrane translocation in rat corneal epithelial cells by glucocorticoid (TobraDex) after penetrating keratoplasty[J].Cornea,2011,30(11):1253-1259.
[14] Yang J,Lu Q,Liu W,etal.Cyclophosphamide reduces Dectin-1 expression in the lungs of naive and Aspergillus fumigatus-infected mice[J].Med Mycol,2010,48(2):303-309.
[15] 栗 方,曹 彬,曲久鑫,等.Dectin-1和TLR2/TLR3/TLR4受體在免疫缺陷小鼠侵襲性肺曲霉菌病的表達[J].中華臨床醫師雜志(電子版),2015,9(9):116-120.
[16] 洪英禮,金英順,崔鎮花,等.TLR活化參與環孢素A誘發的慢性腎小管間質損傷[J].中國病理生理雜志,2011,27(3):555-559.
[17] Greenblatt MB,Antonios A,Bella H,etal.Calcineurin regulates innate antifungal immunity in neutrophils[J].J Exp Med,2010,207(5):923-931.
[收稿2016-05-09 修回2016-06-07]
(編輯 許四平)
Effects of immunosuppressants on Dectin-1 and TLR2 expression in macrophages
MAOYa-Nan,WANGWen,WANGDong,ZHANGBo.
AnhuiMedicalUniversity,Hefei230032,China
Objective:To study the effects of dexamethasone,cyclophosphamide,cyclosporin A and mycophenolate mofetil on the expression of Dectin-1 and TLR2 receptor in RAW264.7 cell line.Methods: In vitro culturing RAW264.7 macrophages,the cells were given different doses of dexamethasone and cyclophosphamide,cyclosporin A and mycophenolate mofetilfor 24 h.The influence of different immunosuppresants on cell proliferation was detected by CCK-8 assay.Dectin-1,TLR2 mRNA and protein levels of change were detected with RT-PCR technique and flow cytometry.Results: CCK-8 cell proliferation toxicity experiment results showed that with the increase of the dose of dexamethasone,cyclophosphamide,Cyclosporin A and mycophenolate mofetil,the different degree of inhibition of RAW264.7 cell proliferation in mice can be saw after the intervention of 24 h (P<0.05).After 24 h of dexamethasone stimulation,Dectin-1 mRNA and protein level decreased,TLR2 mRNA and protein levels elevated (P<0.05).However cyclophosphamide had no obvious influence on Dectin-1 and TLR2 (P>0.05).Mycophenolate mofetil and cyclosporin A could both inhibit the expression of Dectin-1 and TLR2 (P<0.05).Conclusion: There are significant differences among the regulatory functions of various immunosupressants on the expression of pattern recognition receptors.Different immunosuppressive agents exert their inhibitory effects on immune recognition process of fungal pathogens not only by selectively regulating their target PRRs expression,but also by inhibiting the growth and proliferation of macrophages.
Immunosuppressant agent;Dectin-1;TLR2;Macrophage
10.3969/j.issn.1000-484X.2017.03.010
毛亞男(1988年-),女,碩士,主要從事感染與免疫方面的研究,E-mail:1035999640@qq.com。
及指導教師:張 波(1966年-),男,博士,教授,博士生導師,主要從事感染免疫與呼吸機方面的研究,E-mail:zhangbohuxi@sina.com。
R563.1 R392.5
A
1000-484X(2017)03-0365-05
①空軍總醫院呼吸內科,北京100142。

