抗IL-9抗體治療肝癌惡性腹水的療效及其機制研究①
張沛玲 雷榮娥 覃沁怡 石 城 姜海行 覃山羽
(廣西醫科大學第一附屬醫院消化內科,南寧530021)
抗IL-9抗體治療肝癌惡性腹水的療效及其機制研究①
張沛玲 雷榮娥 覃沁怡 石 城 姜海行 覃山羽
(廣西醫科大學第一附屬醫院消化內科,南寧530021)
目的:探索抗IL-9抗體治療小鼠肝癌惡性腹水(MA)的療效及作用機制。方法:應用小鼠H22細胞系建立小鼠MA模型,造模24 h后將45只小鼠隨機分成實驗組、陰性對照組和空白對照組,每組15只。實驗組給予腹腔注射抗IL-9抗體,陰性對照組給予注射同型IgG抗體,空白對照組給予注射生理鹽水,隔天1次,共注射5次。每次注射前均稱量各組小鼠體重,并觀察小鼠日常活動狀態。末次用藥結束24 h后每組隨機處死5只小鼠,測量MA體積,收集MA上清,采用ELISA法檢測MA中VEGF、MMP-2、IL-9、IFN-γ表達水平。其余小鼠觀察其生存時間。結果:干預后實驗組、陰性對照組和空白對照組小鼠的MA體積分別為(6.70±1.52)ml、(10.28±1.75)ml、(10.36±2.30)ml,與空白對照組和陰性對照組相比,實驗組小鼠MA體積明顯減少,差異有統計學意義(P<0.05)。實驗組小鼠平均生存時間為(17.2±2.1)d,顯著長于陰性對照組(14.5±1.2)d和空白對照組(14.8±1.4)d(P<0.05);與空白對照組和陰性對照組相比,實驗組小鼠MA中VEGF水平顯著降低,差異有統計學意義(P<0.05),與陰性對照組相比,實驗組小鼠MA中IL-9水平顯著降低,差異有統計學意義(P<0.05);但三組間MMP-2、IFN-γ水平比較差異無統計學意義(P>0.05)。結論:腹腔注射抗IL-9抗體可以有效地抑制H22細胞荷瘤小鼠MA的產生,延長其生存時間,該作用可能是通過抑制MA中VEGF、IL-9的表達而實現。
惡性腹水;抗IL-9抗體;H22細胞;肝癌
多種惡性腫瘤,如肝癌、卵巢癌、胃癌等疾病發展至晚期時,由于腫瘤細胞侵襲和轉移到腹腔可導致惡性腹水(Malignant ascites,MA),大量MA嚴重影響患者的生活質量并縮短患者的生存時間[1]。除了原發病的治療外,現階段對于MA的治療并沒有十分有效的方法。血管生成和血管滲透性增加被認為是MA形成的主要機制。目前臨床上治療MA的藥物(如恩度、卡妥索單抗等)主要是通過抑制腫瘤細胞表達血管內皮生長因子(VEGF)、基質金屬蛋白酶-2(MMP-2)等因子來抑制腫瘤血管生成,進而減少MA的產生[2,3]。然而,這些藥物的臨床療效有限,仍需尋找其他有效的藥物進行治療。
研究表明,MA中含有大量的免疫細胞和免疫因子,這些免疫細胞和免疫因子在MA的發生、發展和轉歸中發揮重要的作用[4]。然而,目前有關MA中免疫因子作用的報道十分有限,仍需進一步研究。白細胞介素9(IL-9)是機體重要的免疫因子,可由多種免疫細胞(Th2、Th9、Th17和Treg細胞等)分泌[5]。本研究前期實驗已發現肝癌患者的MA中IL-9水平較肝硬化患者腹水中的水平高[6],且肝癌患者MA中高表達IL-9與患者生存期縮短相關,因此我們推測IL-9可能具有促進MA發生發展的作用,但目前尚未有抑制IL-9水平對MA轉歸影響的研究報道。因此,本研究通過建立小鼠肝癌MA模型,并給予抗IL-9抗體干預,以進一步闡明IL-9在MA的作用,并探索抗IL-9對治療MA的療效和機制。
1 材料與方法
1.1 材料 清潔級雌性BALB/c小鼠45只,4~5周齡,體質量18~22 g,由廣西醫科大學實驗動物中心提供,動物許可證號:SYXK桂2014-0002。肝癌H22 MA瘤模型小鼠購自廣西中醫藥研究所。實驗小鼠飼養于室溫(24±2)℃,相對濕度40%~60%,12 h光照、12 h黑暗的實驗室中,自由攝取食物和水。動物適應性飼養3 d,實驗過程中喂食小鼠標準顆粒飼料(購自廣西醫科大學實驗動物中心)。多克隆山羊抗鼠IL-9抗體和同型對照IgG抗體均購于美國R&D公司;小鼠VEGF、MMP-2、IL-9、IFN-γ的酶聯免疫吸附(Enzyme linked immunosorbent assay,ELISA)檢測試劑盒購自中國武漢華美生物工程有限公司。
1.2 方法
1.2.1 MA瘤小鼠模型的制作 取傳代第7天鼠肝癌H22MA瘤小鼠1只,頸椎脫臼法處死,用75%乙醇消毒小鼠腹部,于超凈臺下無菌操作吸取小鼠腹腔乳白色瘤液3 ml,移入離心管離心(1 000 r/min離心5 min),收集H22細胞。用PBS緩沖液輕輕吹打后離心(1 000 r/min,5 min),棄上清,用PBS緩沖液將細胞懸液濃度調整為1×107ml-1。0.4%臺盼藍染色鏡檢細胞存活率≥95%后行腹腔接種。用75%乙醇消毒小鼠腹部,每只小鼠腹腔注射瘤細胞懸液0.2 ml(相當于瘤細胞數2×106個/只)。整個過程嚴格無菌操作,接種于1 h內完成。
1.2.2 實驗小鼠分組與用藥 小鼠腹腔注射H22細胞24 h后,將45只小鼠隨機分成實驗組、陰性對照組和空白對照組,每組15只。實驗組給予腹腔注射抗IL-9抗體(20.0 μg/只),陰性對照組給予注射同型IgG抗體(20.0 μg/只),空白對照組給予腹腔注射等體積的生理鹽水。各組小鼠隔日給藥1次,共給藥5次,每只小鼠每次注射藥體積均為0.2 ml。
1.2.3 觀測指標
(1) 一般觀測指標:用藥期間觀察各組小鼠毛色,活動狀況及精神狀態等一般生活狀況,每次給藥前稱量體重。(2) 小鼠MA體積檢測:末次給藥24 h后,采用頸椎脫臼法每組隨機處死5只小鼠,利用無菌注射器抽取MA并測量MA體積;按下列公式計算小鼠MA抑制率:MA抑制率=(1-實驗組平均MA體積/對照組平均MA體積)×100%[7]。(3) MA中的VEGF、MMP-2、IL-9、IFN-γ濃度檢測: 將MA收集于離心管中,1 000 r/min離心5 min,取上清。采用ELISA 法檢測MA上清中VEGF、MMP-2、IL-9、IFN-γ濃度。(4) 小鼠生存期觀察:記錄各組剩下的10只小鼠的死亡時間,從小鼠接種H22細胞開始至小鼠死亡結束。按下列公式計算小鼠生命延長率:生命延長率=(實驗組平均生存時間-對照組平均生存時間)/對照組平均生存時間×100%[8]。

2 結果
2.1 造模結果及生長狀態 各組小鼠造模后第6~7天開始腹部逐漸膨隆,提示MA模型造模成功。各組小鼠均出現毛發干燥、脫毛、活動力下降等現象,以空白對照組和陰性對照組明顯。與實驗組相比,空白對照組和陰性對照組小鼠腹部膨隆較迅速。但各組小鼠體重改變無明顯差異。
2.2 各組小鼠MA量 末次用藥結束24 h后每組隨機處死5只小鼠,抽取MA,測量MA體積,實驗組、陰性對照組和空白對照組小鼠的MA體積分別為(6.70±1.52)ml、(10.28±1.75)ml、(10.36±2.30)ml,與空白對照組和陰性對照組相比,實驗組小鼠平均MA體積明顯減少,差異有統計學意義(P<0.05);空白對照組與陰性對照組相比, MA體積無明顯變化 (P>0.05)。與空白對照組相比,實驗組的MA抑制率為35.33%。

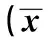

GroupsIL-9VEGFIFN-γMMP-2Experimentalgroup184.77±7.402) 67.74±7.771)2)2173.53±482.891397.07±19.03Negativecontrolgroup420.68±233.4894.16±20.832224.03±470.181414.90±22.00Blankcontrlgroup375.51±143.6790.99±6.40 2380.07±464.941406.02±12.85
Note:Compared with blank control group,1)P<0.05;Compared with negativec control group,2)P<0.05.

圖1 各組小鼠生存時間比較Fig.1 Comparison of survival time among mice with different interventionNote: Mice with IL-9 antibody injection had a longer survival time than mice with IgG or saline injection.
2.3 小鼠MA中VEGF、MMP-2、IL-9、IFN-γ濃度 與空白對照組和陰性對照組比較,實驗組小鼠MA中VEGF水平顯著降低,差異有統計學意義(P<0.05);與陰性對照組相比,實驗組小鼠MA中IL-9水平顯著降低,差異有統計學意義(P<0.05);與空白對照組和陰性對照組比較,實驗組小鼠MA中MMP-2、IFN-γ濃度減少,但差異無統計學意義(P>0.05)。見表1。
2.4 各組小鼠生存期比較 空白對照組小鼠至造模后第18天全部死亡,陰性對照組小鼠至造模后第16天全部死亡,而實驗組小鼠至造模后第20天全部死亡。實驗組、陰性對照組、空白對照組小鼠的平均生存時間分別為(17.2±2.10)d、(14.4±1.18)d、(14.8±1.40)d,Log-rank檢驗顯示,實驗組小鼠生存時間顯著長于陰性對照組和空白對照組,差異有統計學意義(P<0.05)。陰性對照組和空白對照組相比,生存時間無明顯變化,差別無統計學意義(P>0.05)。與空白對照組相比,實驗組小鼠生存時間延長率為16.2%,提示抗IL-9抗體干預后,小鼠生存時間延長,有較好的效果。見圖1。
3 討論
IL-9是機體重要的免疫因子,可由多種免疫細胞(Th2、Th9、Th17、Treg細胞等)分泌[5]。IL-9與IL-9受體(IL-9R)結合,通過激活JAK/STAT信號通路,啟動一系列相關基因轉錄表達來發揮一系列生物學作用。IL-9具有多種免疫作用,如能促進機體清除寄生蟲,增強Treg細胞的免疫抑制功能等[5]。然而,目前有關IL-9在腫瘤方面的研究較少,IL-9與腫瘤的關系還不明確。有研究發現,使用IL-9干預黑色素瘤細胞HTB-72后,可抑制腫瘤細胞的生長[9],而在肺癌的研究中發現IL-9能促進腫瘤細胞的增殖[10]。在IL-9-/-小鼠建立的乳腺癌和大腸癌模型中的研究發現,T細胞對腫瘤的敏感性增高,即小鼠早期就出現腫瘤排斥現象;而使用抗IL-9干預后,野生型小鼠的腫瘤生長出現減慢的現象[11]。我們前期研究也發現MA中IL-9水平較高[6],提示IL-9與MA的發生發展有關,而抗IL-9有可能成為治療MA的一種可行的方法。
MA的發生機制十分復雜,血管生成和血管滲透性增加被認為是MA生成的兩個重要因素,而VEGF、MMP-2、MMP-9、堿性成纖維生長因子(bFGF)等血管活性因子在其中起著重要作用。目前臨床上使用的藥物也是通過調節腫瘤細胞表面的血管活性因子來抑制腫瘤血管生成,進而減少MA的生成。在使用抗IL-9單抗治療哮喘疾病的研究中發現,抗IL-9抗體可抑制IL-9的表達,降低肥大細胞的數量和活性,同時減少肺VEGF和成纖維生長因子(FGF)-2的表達[12]。我們應用抗IL-9抗體注射治療肝纖維小鼠模型,發現使用抗IL-9能顯著改善小鼠肝纖維化狀態,并能促進其較快的恢復[13]。在體外研究中,我們還發現IL-9干預肝癌細胞可以提高VEGF、MMP的表達,因此本實驗中探討注射抗IL-9對小鼠MA模型療效的影響及可能機制,結果表明,與未使用抗IL-9注射治療相比,抗IL-9注射后小鼠的MA生成減少,且MA中的VEGF表達水平下降,提示抗IL-9可以有效地治療MA,其機制可能是通過降低MA中VEGF表達來實現的。
有研究發現使用抗IL-9抗體中和IL-9后,可以改善實驗性自身免疫性腦脊髓炎的癥狀,這是通過減少Th17細胞數量,降低血清中IL-17、IL-6、IFN-γ和TNF-α表達水平來實現的[14]。既往報道和我們的前期研究均表明,MA中Th9、Th17、Th1等免疫細胞通過分泌效應因子,如IL-9、IL-17、IFN-γ 等來參與MA的生成和發展過程,其中Th9細胞數量增多,提示患者預后較差。本實驗在研究抗IL-9抗體對MA中的IL-9、IFN-γ影響時,發現抗IL-9抗體能夠降低MA中IL-9的表達水平,IFN-γ表達有所下降,但組間比較IFN-γ的表達水平差異無統計學意義。這提示抗IL-9抗體有可能通過降低MA中IL-9水平來抑制腫瘤的活性,從而延長小鼠的生存時間。本研究中實驗組小鼠的生存時間較空白組和陰性對照組延長,但從生存時間的數值上看不是十分明顯;結合實驗組MA中IL-9雖然顯著低于對照組,但檢測值仍有(184.77±7.40)pg/ml,考慮生存時間延長不十分明顯的其中一個原因是實驗中抗IL-9抗體的用量不足,未能完全中和MA中IL-9;其次,MA是腫瘤終末期的表現,在H22腹水瘤模型小鼠造模中接種的腫瘤細胞數目較多,腫瘤細胞增殖快,模型小鼠的腫瘤負荷量大,使得小鼠在短時間內死亡,導致最終實驗組生存期雖有所延長,但不十分明顯。
綜上所述,本研究顯示抗IL-9抗體干預肝癌MA模型小鼠后可以有效地減少小鼠MA的產生,改善小鼠的癥狀,延長其生存時間,其作用機制可能是通過抑制MA中VEGF和IL-9的表達來實現的。
[1] Cavazzoni E,Bugiantella W,Graziosi L,etal.Malignant ascites:pathophysiology and treatment [J].Int J Clin Oncol,2013,18(1):1-9.
[2] Wang Y,Xu RC,Zhang XL,etal.Interleukin-8 secretion by ovarian cancer cells increases anchorage-independent growth,proliferation,angiogenic potential,adhesion and invasion [J].Cytokine,2012,59(1):145-155.
[3] 吳春艷,王 偉,陳 鑫,等.重組人血管內皮抑素治療小鼠惡性腹腔積液療效及作用機制研究[J].中國臨床藥理學與治療學,2014,19(5):507-511.
[4] Cao X.Regulatory T cells and immune tolerance to tumors [J].Immunol Res,2010,46(1-3):79-93.
[5] Stassen M,Schmitt E,Bopp T.From interleukin-9 to T helper 9 cells [J].Ann N Y Acad Sci,2012,1247:56-68.
[6] Yang XY,Jiang HX,Huang XL,etal.Role of Th9 cells and Th17 cells in the pathogenesis of malignant ascites [J].Asian Pac J Trop Biomed,2015,5(10):772-777.
[7] 時艷艷,岳 麓,齊衛衛,等.消癌平治療小鼠惡性腹水的實驗研究[J].中華腫瘤防治雜志,2011,18(9):655-658.
[8] 劉 宣,柴 妮,韓植芬,等.健脾解毒方對濕熱證結腸癌小鼠腫瘤血管新生的抑制作用[J].上海中醫藥大學學報,2015,29(6):50-54.
[9] Fang Y,Chen X,Bai Q,etal.IL-9 inhibits HTB-72 melanoma cell growth through upregulation of p21 and TRAIL [J].J Surg Oncol,2015,111(8):969-974.
[10] Ye ZJ,Zhou Q,Yin W,etal.Differentiation and immune regulation of IL-9-producing CD4+T cells in malignant pleural effusion [J]. Am J Respir Crit Care Med,2012,186(11):1168-1179.
[11] Hoelzinger DB,Dominguez AL,Cohen PA,etal.Inhibition of adaptive immunity by IL9 can be disrupted to achieve rapid T-cell sensitization and rejection of progressive tumor challenges [J].Cancer Res,2014,74(23):6845-6855.
[12] Oh CK,Raible D,Geba GP,etal.Biology of the interleukin-9 pathway and its therapeutic potential for the treatment of asthma[J].Inflamm Allergy Drug Targets,2011,10(3):180-186.
[13] Qin SY,Lu DH,Guo XY,etal.A deleterious role for Th9/IL-9 in hepatic fibrogenesis [J].Sci Rep,2016,6:18694.
[14] Li H,Nourbakhsh B,Ciric B,etal.Neutralization of IL-9 ameliorates experimental autoimmune encephalomyelitis by decreasing the effector T cell population [J].J Immunol,2010,185(7):4095-4100.
[收稿2016-10-17 修回2016-11-16]
(編輯 倪 鵬)
Effects and mechanism of anti IL-9 antibody on malignant ascites of hepatic carcinoma
ZHANGPei-Ling,LEIRong-E,QINQin-Yi,SHICheng,JIANGHai-Xing,QINShan-Yu.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China
Objective:To explore the effects and mechanism of anti IL-9 antibody on malignant ascites (MA) of hepatic carcinoma in mice.Methods: A mouse model of MA was established by mouse H22 cell line.45 mice were divided randomly into experimental group,negative control group and blank control group at 24 hours after modeling,with 15 mice in each group.The experimental group was injected intraperitoneally with anti IL-9 antibody;the negative control group was injected with isotype IgG antibody;the blank control group was injected with normal saline.The weight and behavior of the mice were measured before each injection.Five mice of each group was sacrificed at 24 hours after the last injection to measure the volume of MA.The level of VEGF,MMP-2,IL-9 and IFN-γ in MA were determined with ELISA assay;the survival time of rest mice were recorded and compared.Results: The mean volume of MA of experimental group,negative control group and blank control group were (6.70±1.52)ml,(10.28±1.75)ml,(10.36±2.30) ml,respectively,the MA volume of experimental group were lower as compared to negative control group and blank control group(P<0.05).The mean survival time of experimental group was (17.2±2.1)d,which was significantly prolonged compared with the negative control group (14.5±1.2)d and the blank control group (14.8±1.4)d (P<0.05).The levels of VEGF of MA in experimental group was significantly lower compared to the negative control group and blank control group (P<0.05).The levels of IL-9 of MA in experimental group was significantly lower compared to the negative control group(P<0.05).The levels of MMP-2 and IFN-γ in experimental group had no significant difference compared with the negative control group and blank control group (P>0.05).Conclusion: Intraperitoneal injection anti IL-9 antibody on H22 ascites-bearing mice can effectively inhibit the generation of the MA.The mechanism may be related to the inhibition of the expression of the VEGF and IL-9.
Malignant ascites;Anti IL-9 antibody;H22 cell;Hepatic carcinoma
10.3969/j.issn.1000-484X.2017.03.015
①本文受國家自然科學基金(No.31560257;31360221)資助。
張沛玲(1991年-),女,在讀碩士,主要從事消化系統疾病發病機制研究。
及指導教師:覃山羽(1973年-),女,博士,教授,主任醫師,主要從事消化系統腫瘤疾病發病機制的研究,E-mail:qsy0511@163.com。
R735.7
A
1000-484X(2017)03-0388-04

