水產品中孔雀石綠和隱形孔雀石綠殘留量的提取方法優化
范芳芳,李 曉,吳 坤,李 婧,石旭東
(陜西省產品質量監督檢驗研究院,陜西西安 710048)
水產品中孔雀石綠和隱形孔雀石綠殘留量的提取方法優化
范芳芳,*李 曉,吳 坤,李 婧,石旭東
(陜西省產品質量監督檢驗研究院,陜西西安 710048)
在GB/T 19857—2005基礎上,建立一種水產品中殘留的孔雀石綠和隱形孔雀石綠的提取及富集的優化方法,并用高效液相色譜-紫外檢測器的方法對目標物進行檢測。考察了氧化鋁、鹽酸羥胺溶液和對-甲苯磺酸鈉溶液、氯化鈉、乙酸胺溶液及富集凈化的方法等因素對水產品中孔雀石綠和隱形孔雀石綠的回收率影響。結果表明,5 g左右樣品在用乙腈提取時,需加入2 mL質量分數為20%的鹽酸羥胺溶液,1 mL濃度為1.0 mol/L的對-甲苯磺酸鈉溶液,2 mL濃度為0.1 mol/L的乙酸胺溶液(用冰乙酸調節pH值至4.5),8 g酸性氧化鋁,2 g氯化鈉;采用此法目標物的回收率最高,其中孔雀石綠可達95.6%,隱形孔雀石綠可達101.2%。該法具有操作簡單、回收率高、快速大批量處理等優點。
水產品;孔雀石綠;隱形孔雀石綠;高效液相色譜-紫外檢測器法;回收率
0 引言
孔雀石綠(Malachite green,MG)又名孔雀綠、堿基綠,是一種具有金屬光澤的結晶體,通常以氯化物或者草酸鹽的形式存在,極易溶于水,水溶液呈藍綠色[1]。在水產養殖業中,MG主要作為殺菌劑、驅蟲劑、防腐劑來預防和治療各類水產動物的水霉病、鍶霉病及小瓜蟲病等[2]。
近年來,研究發現MG具有毒性化學官能團三苯甲烷,對哺乳動物和人類具有致畸、致癌、致突變等作用,同時含有MG的廢水排放會污染環境[3]。MG在魚類等生物體內可迅速轉化為隱形孔雀石綠(Leucomalachite green,LMG),該代謝產物毒性更大[4]。鑒于MG的危害性,美國、日本、英國等許多國家已禁止將其用于水產養殖業,我國也于2002年5月將MG列入《食品動物禁用的獸藥及其化合物清單》中,禁止用于所有食品動物[5-6]。
因此,加強對水產品中孔雀石綠及其代謝物的監測,對于打擊違法犯罪、保障食品安全顯得格外重要。
目前,對MG和LMG的檢測主要采用液相色譜法[7]、分光光度法[8]、液相色譜質譜法[9]、液相色譜-質譜串聯法[10]、毛細管電泳法[11]及酶聯免疫法等[12]。樣品的前處理是分析化學的瓶頸問題,也是檢測誤差的主要來源之一。乙腈對細胞組織具有良好的滲透性,能夠去除蛋白釋放的MG和LMG,因此試驗的前處理采用乙腈作為基本的提取液[13]。關于這方面的研究也有很多,如Zhang Y等人[14]采用乙腈-醋酸胺混合液體系,而Ascari J等人[15]采用檸檬酸-乙腈混合體系來對MG和LMG進行提取純化。試驗在乙腈-乙酸胺溶液作為提取液的基礎上,首次將無機鹽氯化鈉加入,然后乙腈和水形成的雙水相[16]與旋蒸結合的富集純化方法用于LG和LMG的富集純化,其結果采用高效液相-紫外檢測器(HPLC-UV)的方法進行檢測。該法具有步驟簡化、操作簡單、回收率高、穩定性好等優點。
1 材料與方法
1.1 材料與試劑
孔雀石綠(草酸鹽)標準品和隱形孔雀石綠標準品均購自德國Dr.Ehrenstorfer Gmb H公司,其純度分別為95%和98%,生產批號分別為20201和30103。
乙腈購自德國默克公司,色譜純;試驗用水為超純水;所用試劑除指定外,均為分析純。
1.2 儀器與設備
2998 TDQ型高效液相色譜儀,美國Waters公司產品,配有二聯泵、柱溫箱、UV2487檢測器、Waters色譜工作站;RE-52型旋轉蒸發儀,上海之信儀器有限公司產品;TG16-NS型離心機,湘儀離心機公司產品;KQ-250DE型超聲儀,昆山市超聲儀器有限公司產品;JA1003N型天枰,上海佑科公司產品。
1.3 主要溶液的配備
孔雀石綠標準儲備液:100 μg/mL,準確稱取0.01 g孔雀石綠(草酸鹽)標準品于100 mL容量瓶中,用乙腈定容。
隱形孔雀石綠標準儲備液:100 μg/mL,準確稱取0.01 g隱形孔雀石綠標準品于100 mL容量瓶中,用乙腈定容。
稱取5.0 g左右不含MG和LMG的水產品粉碎樣于50 mL容量瓶中,量取一定量乙腈進行混勻,經超聲、離心后取上清液得到基質溶液。
各取0.5 mL MG和LMG的標準儲備液于10 mL容量瓶中,用基質溶液定容至刻度線,配置成5 μg/mL的混合標準工作液。
配制0.1 mol/L的乙酸胺溶液,并用冰乙酸調節pH值至4.5。
配制濃度為1.0 mol/L的對-甲苯磺酸鈉溶液和質量分數為20%的鹽酸羥胺。
1.4 色譜條件
色譜柱:Waters C18-ODS柱(5 μm,4.6 mm× 250mm),柱后接25%的二氧化鉛氧化柱;柱溫:25℃;流速:1.0 mL/min;流動相:乙腈與0.1 mol/L的乙酸銨緩沖溶液(pH值4.5)體積之比為80∶20。
1.5 計算公式
目標物的回收率用E來表示,計算公式為:
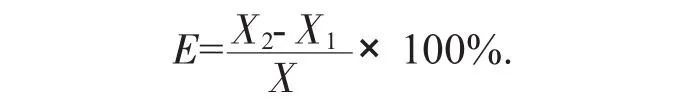
式中:X2——加標樣品中目標物的濃度,μm/mL;
X1——樣品中目標物濃度,μm/mL;
X——加入的標準品濃度,μm/mL。
此計算公式適用于樣品和加標樣品質量相同的情況下。
1.6 試驗方法
稱取5.00 g水產樣品于50 mL離心管中,加入15 mL乙腈,混勻,超聲時間5 min。首先考察乙酸胺溶液對試驗結果的影響;進一步研究氧化鋁的屬性對目標回收率的影響,并確定其最佳含量,以及與填充氧化鋁柱子的萃取效果進行了比對;在此基礎上,繼續考察不同量的鹽酸羥胺和對-甲苯磺酸鈉溶液對結果的影響;在確定了提取方法后,試驗對不同富集純化方法進行比對;確定完上述參數后,繼續研究氯化鈉添加量對試驗結果的影響,從而得到最佳試驗方法。
1.7 標準曲線的建立
試驗比較了Agilent的C18柱(5 μm,4.6 mm× 250 mm)與Waters-ODS的C18柱(5 μm,4.6 mm× 250 mm)分離情況。結果發現,后者對目標物的分離效果好、基線平穩、雜峰干擾少。于波長588 mm與618 mm處,孔雀石綠和隱形孔雀石綠在5.053 min和17.149 min時響應值最大。
5 μg/mL混合標準色譜見圖1。
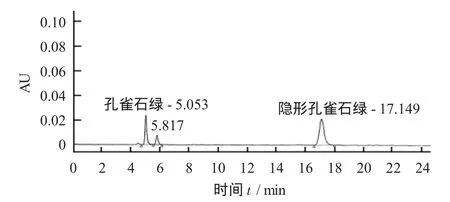
圖1 5 μg/mL混合標準色譜
1.8 工藝優化試驗說明
試驗在GB/T 19857—2005[17]和目前報道的相關文獻[18-19]的方法基礎上,對鹽酸羥胺和對-甲苯磺酸鈉溶液的添加量、氧化鋁的屬性和添加量、乙酸胺溶液、氯化鈉的添加量和富集凈化方法等因素進行研究,首次將雙水相技術[16]——無機鹽氯化鈉加入后乙腈和水形成的雙水相與旋蒸結合的方法用于LG和LMG的富集純化,其結果采用高效液相色譜-紫外檢測器(HPLC-UV)的方法進行檢測。
2 結果與分析
2.1 氧化鋁對目標物回收率的影響
2.1.1 氧化鋁的屬性對目標物的影響
氧化鋁對目標物回收率的影響見表1。

表1 氧化鋁對目標物回收率的影響/%
由表1可知,酸性氧化鋁能夠使目標物的回收率大大提高,這是由于堿性氧化鋁與目標物發生次級反應,而酸性氧化鋁通過離子交換,可達到對MG和LMG的提純凈化作用[20-21]。
2.1.2 酸性氧化鋁添加量對目標物回收率的影響
試驗在2.1.1所述試驗方法的基礎上,繼續考查分別添加2,4,6,8,10 g酸性氧化鋁,對目標物回收率的影響。
酸性氧化鋁添加量對回收率的影響見圖2。
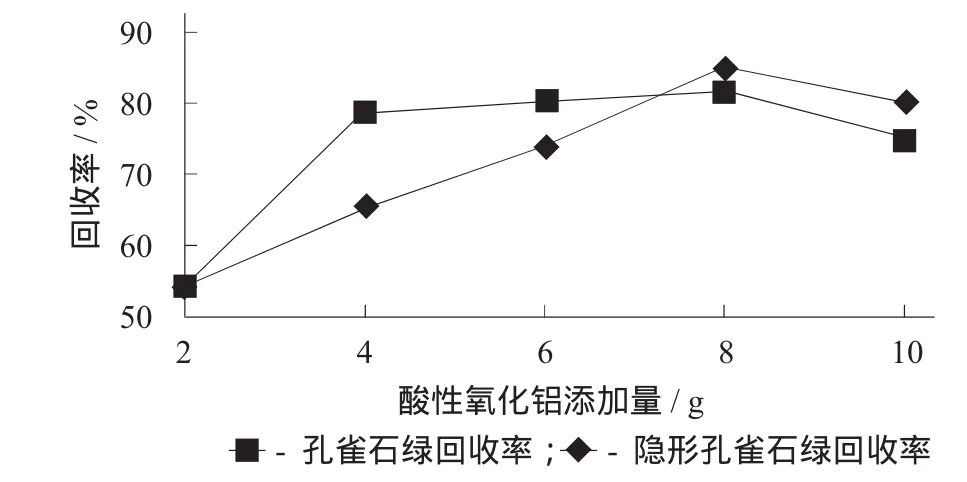
圖2 酸性氧化鋁添加量對回收率的影響
由圖2可知,隨著酸性氧化鋁添加量的升高,目標物的回收率越來越高,當酸性氧化鋁添加量為8 g時,目標物的回收率升至最高,分別為81.77%和85.09%;隨著酸性氧化鋁添加量繼續增大,目標物的回收率降低。這是由于過量的酸性氧化鋁中攜帶的過量陰離子會抑制MG和LMG向乙腈層的轉移。
2.1.3 與過酸性氧化鋁萃取的結果對比
試驗將酸性氧化鋁直接加入溶液中與濾液過酸性氧化鋁萃取小柱2種方法的結果進行了比對,結果發現酸性氧化鋁過萃取小柱MG和LMG的回收率分別為73.24%和78.99%,低于81.77%和85.09%。這是由于自制的氧化鋁小柱緊密性不夠,導致洗脫效果不好。
2.2 鹽酸羥胺和對-甲苯磺酸鈉對目標物回收率的影響
由于MG和LMG容易見光見熱分解[22],因此要加入還原劑鹽酸羥胺溶液,防止目標物從提取液中分解出來;而且MG和LMG以離子形式存在于溶劑中,離子對試劑對-甲苯磺酸鈉的加入是為了與目標物形成離子對,增加MG和LMG的穩定性,從而提高目標物的回收率[23]。同樣,在2.1所確定的試驗參數基礎上,考查鹽酸羥胺和對-甲苯磺酸鈉溶液對目標物回收率的影響。主要進行如下 3個試驗。
(1)不加鹽酸羥胺和對-甲苯磺酸鈉;
(2)加入1.5 mL 20%的鹽酸羥胺溶液和2.5 mL 1.0 mol/L的對-甲苯磺酸鈉溶液;
(3) 加入2 mL 20%的鹽酸羥胺溶液和1 mL 1.0 mol/L的對-甲苯磺酸鈉溶液。
鹽酸羥胺和對-甲苯磺酸鈉溶液添加量對回收率的影響見表2。

表2 鹽酸羥胺和對-甲苯磺酸鈉溶液添加量對回收率的影響/%
由表2可知,添加2 mL 20%的鹽酸羥胺溶液和1 mL 1.0 mol/L的對-甲苯磺酸鈉溶液是最佳試驗條件。
2.3 富集凈化方法對目標回收率的影響
通常,前處理中將目標物富集純化的方法有旋蒸[24]、萃取上清液[18]和冷凍[25]等方法。試驗步驟如下:
在2.2所確定的試驗參數基礎上,分別用以下3種方法對目標物進行富集和純化。
(1)將反復提取得到的上清液,在45℃條件下旋轉蒸發至近干,加入2 mL乙腈溶解殘渣,超聲3 min,靜置,取上清液,并用乙腈定容至刻度,過0.45 μm濾膜,濾液供液相色譜測定。
(2)取2.5 mL的上清液,加入1.2 mL吸水試劑水硫酸鈉,離心后取上清液,過0.45 μm濾膜,濾液供液相色譜測定。
(3)將反復提取得到的上清液在冰箱(-18℃)貯藏12 h,取未凍結的上清液,并用乙腈定容至一定刻度后過0.45 μm濾膜,濾液供液相色譜測定。
不同富集凈化方法對目標物回收率的影響見表3。
由表3可知,方法1和方法2對目標物均有較好的回收效果,甚至方法2的回收率更高,這是由于方法2較方法1減少了旋蒸,從而減少了目標物的損失。同時還可以看出,方法2中LMG的回收率超過100%,這是由于一部分MG轉化為LMG[23],其原因有待進一步考證。考慮到方法2將原有樣品中目標物的濃度稀釋倍數太高,在實際測試中達不到痕量測試的要求,故優先選擇方法1。
2.4 氯化鈉對目標物回收率的影響
2.4.1 氯化鈉屬性對目標物回收率的影響
試驗考查氯化鈉添加量為0.1 g時對試驗結果的影響。結果表明,MG回收率分別為88.63%和90.43%,LMG為85.77%和91.65%。這是由于氯化鈉的加入使乙腈和水形成了雙水相,水與乙腈臨界層存在一種張力[27],促使分子或者離子的MG和LMG更多地移向乙腈層。
2.4.2 氯化鈉添加量對目標物回收率的影響
在2.3所述試驗方法1的基礎上,考查在提取過程氯化鈉分別為0.8,1.0,1.2,1.4,1.6,1.8,2.0,2.2,2.4 g時MG和LMG回收率的影響。
氯化鈉添加量對目標物回收率的影響見圖3。
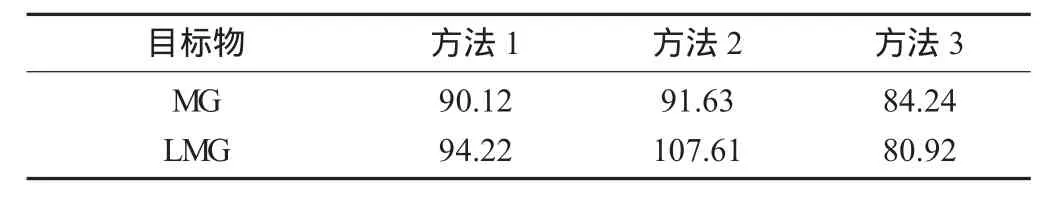
表3 不同富集凈化方法對目標物回收率的影響/%
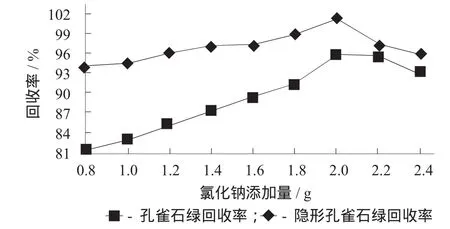
圖3 氯化鈉添加量對目標物回收率的影響
由圖3可知,隨著氯化鈉添加量的增加,目標物的回收率越高,當氯化鈉添加量為2 g時,目標物的回收率達到最高,MG和LMG分別為95.60%和101.2%;隨著氯化鈉添加量繼續升高,目標物的回收率趨于平緩,甚至下降。這是由于乙腈經旋蒸出去后,雞心瓶中剩下含有目標物的氯化鈉溶液。向蒸發至近干的雞心瓶中加入乙腈,在氯化鈉離子的水化作用下,乙腈與水形成雙水相,并使MG和LMG在乙腈層富集,從而大大提高了目標物的回收率;但過量添加氯化鈉又會產生鹽析作用,使目標物與乙腈間產生粒子斥力,導致回收率有所降低[28-29]。
2.5 乙酸胺溶液(用冰乙酸調節pH值至4.5)對試驗結果的影響
試驗還考查了不加乙酸胺溶液和加入2 mL的0.1 mol/L乙酸胺溶液(用冰乙酸調節pH值至4.5)對試驗結果的影響,結果表明不加入乙酸胺溶液時,樣品的曲線中MG的峰和旁邊的雜質峰分不開,從而影響了試驗對MG含量的測定,進一步影響了試驗對各個影響因素的影響判定。
3 試驗方法的最終確定
通過試驗,水產品中MG、LMG殘留量提取富集的方法最終優化如下:
在GB/T 19857—2005基礎上,5 g左右樣品在用乙腈-乙酸胺溶液提取時,需加入2 mL質量分數為20%的鹽酸羥胺溶液,1 mL濃度為1.0 mol/L的對-甲苯磺酸鈉溶液,2 mL的0.1 mol/L乙酸胺溶液(用冰乙酸調節pH值至4.5),8 g酸性氧化鋁,2 g氯化鈉。反復提取,合并上清液,旋蒸,用乙腈溶解殘渣。超聲時間5 min,靜置,取上清液,并用乙腈定容至刻度,其含量用高效液相色譜-紫外檢測器法進行檢測。此方法得到的回收率最高,其中MG可達95.6%,LMG可達101.2%,且穩定性好。
4 討論
(1)試驗首次將氧化鋁、還原劑、離子對試劑、無機鹽和富集純化方法等因素綜合起來考察,并討論研究了這些因素分別對目標物回收率的影響效果。
(2)試驗建立了將雙水相萃取技術與高效液相色譜-紫外檢測器的方法結合用來提取、富集純化水產品中孔雀石綠和隱形孔雀石綠殘留的方法,該方法具有操作簡單、凈化效果好、回收率高、穩定性好、降低成本、適用于痕量分析和大批量處理等優點,適合在食品檢測中推廣使用。
[1]田秀慧,于召強,陳瑋,等.超高相液相色譜串聯質譜法測定水產苗種中孔雀石綠及其代謝物隱色孔雀石綠[J].食品科學,2013,34(12):171-177.
[2]馮雷,孫文通,李波,等.水產品中殘留孔雀石綠和五色孔雀石綠液質聯用分析方法研究 [J].食品科學,2009,30(4):193-196.
[3]張佳艷,伍金娥,常超.孔雀石綠的毒理學研究 [J].糧食科技與經濟,2011,36(3):43-47.
[4]Rushing L G,Hansen J.Confirmation of malachite green,gentian violet and their leuco analogs in catfish and trout tissue by high-performance liquid chromatography utilizing electrochemistry with ultraviolet-visible diode array detection and fluoreseence detection[J].J Chromatography B,1997,700:223-231.
[5]孫滿義,楊賢慶,岑劍偉,等.水產品中孔雀石綠的研究進展 [J].食品工業科技,2009,30(2):312-315.
[6]向仲朝,岳蘊瑤,張婷,等.水產品中孔雀石綠和結晶紫及其代謝物高效液相測定法 [J].中國衛生雜志檢驗,2014,24(6):788-790.
[7]Mitrowska K,Posyniak A,Zmudzki J.Determination of malachite green and leucomalachite green in carp muscle byliquid chromatomatography with visible and fluorescence detection[J].J Chromatogr A.,2005,1 089(1/2):187-192.
[8]陶艷玲,岑為禧,鄧愛妮,等.整體式固相萃取微攪拌棒-分光光度法測定孔雀石綠 [J].寧波大學學報(理工版),2011,24(2):66-77.
[9]徐向榮,郝青,彭加喜.水產中殘留孔雀石綠研究進展 [J].熱帶海洋學報,2013,32(4):97-106.
[10]Ahn S H,Kim B J,Lee Y J,et al.Accurate determination of malachite green and leucomalachite green in fish using isotope dilution liquid chromatography/mass spectrometry(ID-LC/MS) [J].Bulletin-Korean Chemical Society,2010,31(31):3 228-3 232.
[11]黃寶美,姚程煒,陳紅.魚類中孔雀石綠殘留量的高效毛細管電泳檢測 [J].應用化學,2007,24(3):327-330.
[12]邢瑋瑋,王榕妹,王俊卿,等.酶聯免疫吸附分析法測定水產品及水中孔雀石綠和無色孔雀石綠 [J].化學研究與應用,2010,22(1):42-46.
[13]肖業承,賀陽,尹嬋,等.水產品中孔雀石綠的檢測方法研究進展 [J].廣州化工,2014,277(41):137-139.
[14]Zhang Y,Huang Y,Zhai F,et al.Analyses of enrofloxacin furazolidone and malachite green in fish products with surface enhanced raman spectroscopy[J].Food Chem,2012,135(2):845-850.
[15]Ascari J,dracz S,Santos F A,et al.Validation of an LC-MS/MS method for malachite green(MG),leucomalachite green(LMG),crystal violet(CV) and leucocrystal violet(LCV) residues in fish and shrimp[J].Food Add Cont:PartA,2012,29(4):602-608.
[16]王志華,馬會民,馬泉莉,等.雙水相萃取體系的研究 [J].應用化學,2001,18(3):173-175.
[17]中國國家標準化委員會.GB/T 19857—2005水產品中孔雀石綠和結晶紫殘留量的測定 [S].北京:中國質檢出版社,2005.
[18]蘇建峰,連文浩,陳文凱.超高效液相色譜-串聯質譜快速檢測水產品中孔雀石綠及無色孔雀石綠 [J].理化檢驗(化學分冊),2007,43(11):76-80.
[19]趙亮.用LC/MS/MS快速檢測食品中的孔雀石綠、結晶紫、隱形孔雀石綠、隱性結晶紫 [J].食品安全導刊,2010(8):32-33.
[20]洪波,袁希平,萬譯文,等.水中孔雀石綠、結晶紫殘留量的同時測定 [J].食品與機械,2012,28(4):84-86.
[21]高天,季泠,王欣,等.酸性氧化鋁固相催化四氫嘧啶類化合物的串聯合成反應 [J].中國藥學(英文版),2016(6):419-427.
[22]魏強,龍洲雄,王立宛,等.HPLC測定水產品中孔雀石綠、結晶紫及其代謝物細節的研究 [J].江西化工,2010(1):82-85.
[23]孫滿義,楊賢慶,李來好,等.養殖水體中孔雀石綠高效液相熒光檢測法的研究 [J].食品科學,2008,29(8):513-516.
[24]劉成文,賀陽.高效液相色譜法測定水產品中孔雀石綠殘留量的條件優化 [J].中國漁業質量與標準,2014,4(3):34-38.
[25]張維冰,王智聰,萬昊,等.基于冷凍熔煉的液-液萃取樣品富集技術研究 [J].中國科學(化學),2013(2):209-216.
[26]鄧建朝,李來好,楊賢慶,等.固相萃取-高效液相色譜-熒光檢測法測定水體中的孔雀石綠 [J].食品科學,2012,33(14):150-153.
[27]Maia P P,Silva E C,Rath S,et al.Residue content of oxytetracycline applied on tomatoes grown in open field and green house[J].Food Control,2009,20(1):11-16.
[28]關衛省,范芳芳,李宇亮,等.離子液體雙水相氣浮溶劑浮選分離-富集水樣中的鹽酸多西環素研究 [J].安全與環境學報,2015,15(2):184-188.
[29]范芳芳,盧昶雨.離子液體分離體系的研究與發展 [J].應用化工,2013,42(7):1 300-1 303.◇
Optimization Method of Extracting Malachite Green and Leucomalachite Green Residues in Fishery Products
FAN Fangfang,*LI Xiao,WU Kun,LI Jing,SHI Xudong
(Shaanxi Institute of Product Quality Supervision and Inspection,Xi'an,Shaanxi 710048,China)
On the basis ofGB/T 19857—2005,the aim of this research is to optimize the methods of extracting and concentrating LG and LMG from fishery products detecti by HPLC-UV.Some factors having effect on recovery rate have been studied,such as alumina,solution ofhydroxylamine hydrochloride,solution of p-toluene sulfonic acid,enrichment and purification methods,sodium chloride and buffer solution of ammonium acetate.The results of this investigation show that the specimen with about5 g have been extraced by acetonitrile on the condition when the dosage of solution of hydroxylamine hydrochloride is 2 mL,as well as solution of p-toluene sulfonic acid(1.0 mL/L)is 1 mL,buffer solution of ammonium acetate(20%)is 2 mL,acidic alumina should be 8 g and sodium chloride should be 2 g.The specimens have been successively separated and purified,while clear liquid in the upper level has been evaporated by rotating.It can be expected that the recovery would reach its peak value which MG is 95.6%as well as LMG is 101.2%.In addition,this is a high-recovery method which has simple pretreatment,and is applicable for quickly and accurate determination of large number of samples.
fishery products;malachite green;leucomalachite green;HPLC-UV;recovery
X52
A
10.16693/j.cnki.1671-9646(X).2017.01.056
1671-9646(2017)01b-0061-05
2016-12-13
范芳芳(1987— ),女,碩士,檢驗員,研究方向為食品質量安全。
*通訊作者:李 曉(1963— ),男,大專,工程師,研究方向為農副產品質量安全。

