硼對根瘤菌在紫花苜蓿體內運移和定殖及對幼苗生長的影響
苗陽陽,周彤,師尚禮,康文娟,張運婷(甘肅農業大學草業學院,草業生態系統教育部重點實驗室,甘肅省草業工程實驗室,中-美草地畜牧業可持續研究中心,甘肅 蘭州730070)
?
硼對根瘤菌在紫花苜蓿體內運移和定殖及對幼苗生長的影響
苗陽陽,周彤,師尚禮*,康文娟,張運婷
(甘肅農業大學草業學院,草業生態系統教育部重點實驗室,甘肅省草業工程實驗室,中-美草地畜牧業可持續研究中心,甘肅 蘭州730070)
通過向青色熒光蛋白(CFP)標記的兩種根瘤菌菌液EnsifermelilotiLZgn5f (gn5f) 和Ensifermeliloti12531f (12531f)內添加不同濃度硼并接種于苜蓿幼苗根部,研究硼對熒光標記根瘤菌在甘農5號紫花苜蓿幼苗體內運移和定殖的動態變化及接種對苜蓿幼苗生長的影響。結果表明,添加1 mg/L硼較利于12531f生長, 100 mg/L硼較利于gn5f生長。添加適宜濃度硼對苜蓿幼苗體內熒光標記根瘤菌運移和定殖具有促進作用,兩種熒光標記根瘤菌在根部定殖數量較多,其中添加100 mg/L硼15 d時根部12531f數量最高,達2184.99 cfu/g,添加0.5 mg/L硼60 d時gn5f數量最高,達58307.11 cfu/g;同時可向地上運移,主要運移并定殖于下部莖葉內,1 mg/L硼利于12531f在下部莖葉內定殖,100 mg/L硼利于gn5f在下部莖內定殖。對照各部位未檢測到兩種熒光標記根瘤菌。添加硼處理的單株結瘤數、單株根瘤重、單株葉片數、株高、根長、地上鮮重、地上干重、根鮮重和根干重均高出對照和單獨接菌處理,1 mg/L硼+12531f處理高出對照和單獨接菌處理,范圍在21.31%~909.28%之間;100 mg/L硼+gn5f處理高出對照和單獨接菌處理,范圍在15.07%~1424.24%之間;雖然單獨接種12531f抑制了葉綠素的形成,但添加1 mg/L硼后其含量則升高,分別顯著高出對照和單獨接菌處理18.31%和36.86%(P<0.05),而接種gn5f則促進了葉綠素的合成,添加100 mg/L硼后含量分別顯著高出對照和單獨接種處理24.41%和12.92%(P<0.05)。因此,1 mg/L硼與12531f混合接種,100 mg/L硼與gn5f混合接種對根瘤菌在苜蓿幼苗體內運移和定殖及對幼苗的生長具有促進作用,為苜蓿種植提供了依據。
熒光標記根瘤菌;硼;紫花苜蓿;運移和定殖;促生效應
紫花苜蓿(Medicagosativa)是一種多年生優質豆科牧草,以其耐干旱、耐貧瘠、品質好、經濟價值高等特性被譽為“牧草之王”[1]。適量施用化肥可提高苜蓿產量,改善品質,但長期施用會使環境污染,土壤條件惡化,并對生態系統造成嚴重危害[2]。根瘤菌可與豆科植物共生形成根瘤,并在植物根部結瘤固氮,將大氣中的無機氮轉化為植物可以吸收利用的有機氮,還可以內生菌的形式存在于植物組織中形成特殊的微生境[3]。已有的研究表明,苜蓿接種根瘤菌可促進結瘤,提高固氮能力,是提高產量和品質的重要措施[4-5]。苜蓿播種時進行根瘤菌接種已在美國、加拿大和澳大利亞等國家普遍使用[6-8],主要的接種方法為施用根瘤菌菌劑拌種或包衣種子,但接種效果并不穩定[9],作物種類與根瘤菌種類及外在特殊的自然環境、接種方法與土著根瘤菌的競爭及多種生物與非生物的脅迫均可影響接種根瘤菌的結瘤能力,使部分根瘤菌難以高效地與豆科植物結瘤固氮,難以達到應有的增產效果[10-11]。因此如何提高根瘤菌的接種效果對苜蓿生產具有重要意義。
大量微生物可以定殖于植物根際,有些還可以內生菌的形式定殖于植物體內并進行大量繁殖[12-13]。根瘤菌能否成功侵染植物根部成為根瘤菌劑接種效果的一個主要因素。而與外源菌相比,內生菌在競爭結瘤方面有明顯優勢,因此在豆科植物高成本的接種背景下對內生菌的研究就具有較強的理論與實踐意義。近年來,已有大量關于健康植物組織內生菌的分離、鑒定及定殖過程的研究[14-15],且發現具有抗病蟲害、促進植物生長、提高固氮能力的作用[14-18]。已發現內生根瘤菌可定殖于苜蓿、煙草(Nicotianatabacum)、水稻(Oryzasativa)等植物體內[19-21],但內生根瘤菌在種子及植株體內的分布不是恒定的,會受土壤養分、溫度、水分及田間管理、種子保存時間、供試植物材料、菌株遺傳特性等因素影響[11,21-24]。有關內生根瘤菌在植物體內的運移途徑、動態變化、定殖部位及對種子和植物組織內微生物群落影響的研究較少。陳丹明等[25]首次發現苜蓿種子內攜帶有根瘤菌。李劍峰等[21-22]和張淑卿[23]發現苜蓿內生根瘤菌主要存在于根系的毛根,同時大量存在于與種子形成的有關部位。在苜蓿芽苗、幼苗及田間營養生長階段,苜蓿各組織內均有內生根瘤菌的存在,但因侵染宿主根部后向地上部位遷移時會遇到阻礙或屏障導致定殖數量減少。通過添加LaCl3、生長素(IAA)、胞外多糖等外源物質可以減弱根瘤菌在苜蓿體內運移與定殖時遇到的防御反應,從而提高了根瘤菌在苜蓿各組織內的定殖數量[22]。
研究發現,適量硼可增加苜蓿單株結瘤數、提高種子產量并改善營養品質[26-29]。由此可見硼在提高根瘤菌固氮效率、增加作物產量、提高蛋白質含量方面已表現出一定效果。硼可促進IAA合成,利于其在植物組織內的擴散和運輸[30]。而IAA能增大細胞壁膜透性,促進養分的釋放與根系根瘤菌的侵染,同時降低植物防衛系統的胞壁降解酶的活性,使入侵微生物易于定殖在植物組織內[22,31-32]。
近年來有關硼對根瘤菌影響的研究主要集中在結瘤效率和促進作物生長方面,而關于硼對根瘤菌在苜蓿體內運移和定殖影響的研究尚未報道。因此,本試驗通過添加不同濃度硼來研究其對熒光標記根瘤菌在苜蓿體內運移和定殖及對苜蓿幼苗生長的影響,為提高接種效果,促進大量內生根瘤菌定殖于植物體內并向繁殖器官轉移,形成攜帶目的根瘤菌的種子提供理論依據和技術支持。
1 材料與方法
1.1 試驗材料
供試根瘤菌:由草業生態系統教育部重點實驗室提供的熒光標記根瘤菌Ensifermeliloti12531f (12531f)和EnsifermelilotiLZgn5f (gn5f)。其原始菌株分別為Ensifermeliloti12531f(購自中國科學院微生物保藏中心——分離自非本苜蓿植株體內的外源根瘤菌),EnsifermelilotiLZgn5 (gn5)(分離自甘農5號紫花苜蓿種子的內源根瘤菌,經中國科學院微生物鑒定保藏中心測序鑒定),其最終來源是上代苜蓿植株的內生根瘤菌,通過垂直傳代進入種子。所有菌種于TY(Yeast Tryptone Agar)固體穿刺管中[33]4 ℃保存后以三親本雜交法導入青色熒光蛋白質粒標記構建標記菌株待用[34]。
供試苜蓿種子:甘肅農業大學教育部草業生態系統重點實驗室提供甘農5號紫花苜蓿(MedicagosativaGannong No.5)種子,凈度為97%,發芽率為84%。
供試硼:購自于蘭州博域生物科技有限責任公司的硼酸,含量不少于99.5%。
培養基:采用TY培養基進行菌種的保存、活化、培養及苜蓿各組織內熒光標記根瘤菌數量的檢測。配方為胰蛋白胨:5 g;酵母粉:3 g;CaCl2·6H2O:1.3 g;蒸餾水1000 mL;pH:7.0;121 ℃高溫滅菌26 min;固體培養基加瓊脂15 g/L。
營養液:Hoagland有氮營養液[35]和Hoagland無氮營養液[36],以1 mol/L的NaOH溶液或1 mol/L HCl溶液調節營養液pH=7.0±0.1。
1.2 試驗方法
1.2.1 硼濃度篩選及培養基的制備 設置硼酸濃度為0、0.01、0.5、1、10和100 mg/L。硼酸置于無菌三角瓶中,無菌操作臺內紫外殺菌1 h后無菌水溶解并過無菌濾膜(直徑0.22 μm)3次,爾后按需要的濃度加入配制好的40 mL TY液體培養基中。
1.2.2 熒光標記根瘤菌菌液制備 將TY固體穿刺管保存的兩種熒光標記根瘤菌活化后接入50 mL TY液體培養基,28 ℃、180 r/min培養至OD600 nm=0.5~0.8,將該菌液按10%濃度加入不同硼濃度的液體培養基內。待上述培養基培養至OD600 nm=0.5~0.8后將其轉移至50 mL無菌離心管中,8000 r/min離心10 min,棄上清,留沉淀,加入等體積的無菌水,在渦旋振蕩器上充分打散,制成菌懸液待用。
1.2.3 苜蓿幼苗的培養及接種 試驗于2014年4月在甘肅農業大學溫室內進行。選取健康飽滿的甘農5號紫花苜蓿種子,置于已滅菌的50 mL三角瓶內,碘伏(購自蘭州博域生物科技有限責任公司,有效碘含量0.45%~0.55%)浸泡3 min,無菌水清洗4次,每次1 min。以上操作均在無菌操作臺內進行。
細沙洗凈150 ℃高溫持續烘干5 h后121 ℃滅菌26 min,連續滅菌5次,待冷卻后裝入75%乙醇消毒且杯底扎有網眼的塑料杯(直徑6.0 cm、高7.5 cm, 400 g/杯),將其放入水培盒中(長31 cm,寬19 cm,高10.5 cm)。每杯播種40粒已消毒的種子,表面覆蓋干沙2 cm左右。未接種熒光標記根瘤菌液前,每處理水培盒內加700 mL Hoagland有氮營養液,使其由杯底自下而上浸濕[37]。
待苜蓿幼苗長出真葉后,每杯定苗25株,將已制好的1.2.2菌懸液澆于盆栽表面,25 mL/杯。每處理重復6次,以無菌蒸餾水接種處理為對照。幼苗生長過程中用無菌蒸餾水補充水分,接種后每15 d澆灌500 mL/盒 Hoagland無氮營養液,至60 d幼苗收獲。按表1設置試驗處理。
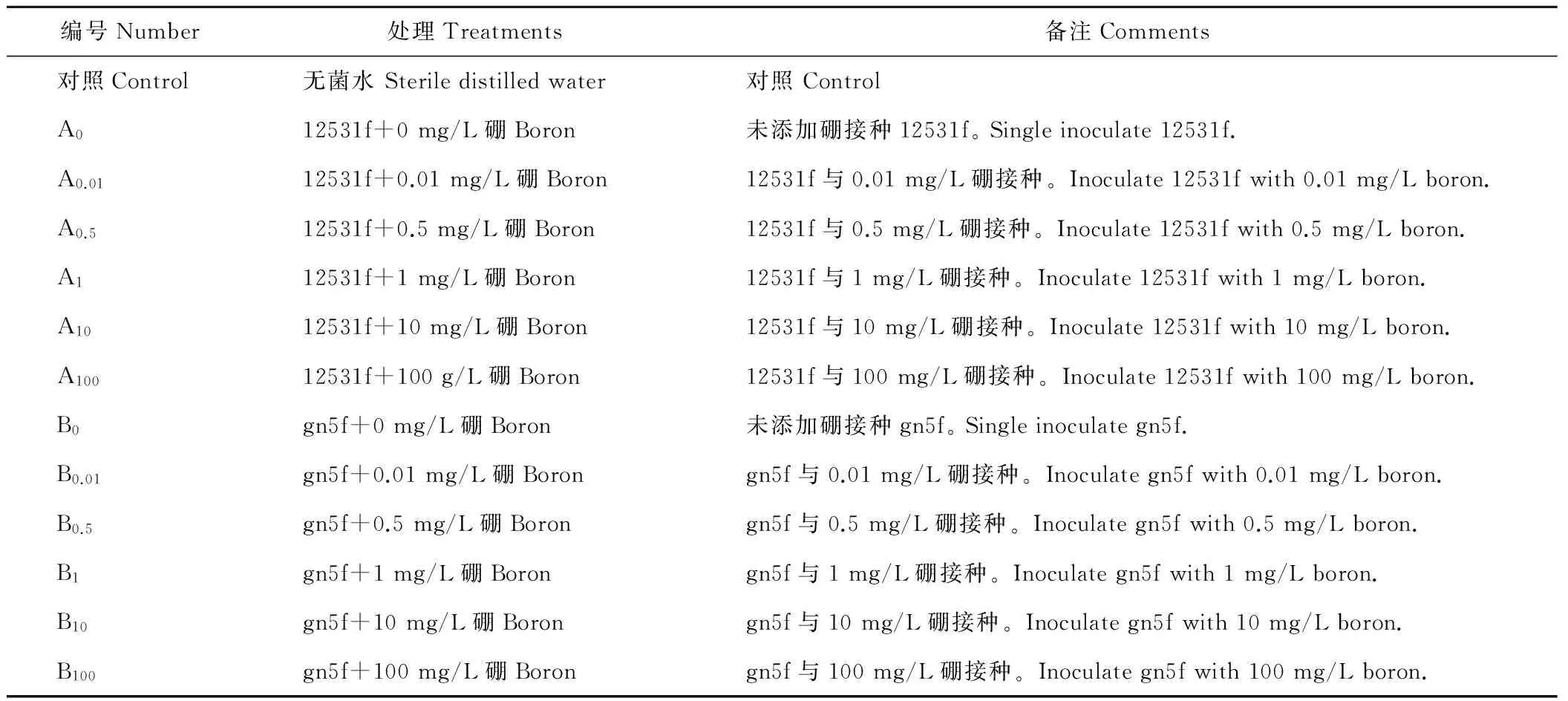
表1 試驗處理Table 1 Treatments for experiment
1.3 測定指標與方法
1.3.1 熒光標記根瘤菌生長的測定 于接種后1、3、5和7 d的相同時間測定含不同濃度硼的培養基菌液OD600 nm吸光度值。
1.3.2 熒光標記根瘤菌在苜蓿體內運移和定殖的測定 接種后每隔15 d取樣,每處理每重復內隨機選取幼苗,分為上部莖、上部葉、下部莖、下部葉和根;分別稱取1 g置于50 mL無菌三角瓶內,碘伏浸泡3 min,無菌水沖洗4次,每次1 min。各組織消毒后,將最后一次消毒的植物組織各面在固體培養基平板上放置30 min后取出,將平板28 ℃條件下培養24~48 h,未長出菌落,表明已徹底消毒[20]。將完全消毒后的組織分別置于無菌研缽中加入2 mL無菌水研磨(重量低于0.5 g則加入1 mL無菌水)(根部研磨液依次稀釋為10、102、103倍,其他組織不稀釋),離心(4000 r/min,3 min)后依次吸取0.2 mL均勻涂布于TY固體培養基中,28 ℃培養24~48 h,計數每皿內菌落數量。黑暗條件下用手提紫外燈觀察每皿內發光的熒光標記根瘤菌菌落個數后換算出每克樣品(鮮重)內熒光標記根瘤菌數量[22]。
1.3.3 單株結瘤數和單株根瘤重的測定 幼苗生長60 d后每處理隨機取5株測定單株結瘤數和單株根瘤重。
1.3.4 形態指標的測定 幼苗生長60 d后每處理每重復隨機選取5株計算單株復葉數、刻度尺測量株高及根長。同時每處理隨機選取10株,稱取地上和根部鮮重(濾紙吸干表面水分)和干重(烘箱中105 ℃殺青20 min,爾后80 ℃烘干至恒重)[38]。
1.3.5 葉綠素含量的測定 幼苗生長60 d后每處理隨機選取葉片,用脫脂棉擦拭干凈,去除主脈和兩頭部分,剪碎,混勻,稱0.2 g左右,用99%丙酮和95%乙醇1∶1混合液定容50 mL,重復3次。將定容好的容量瓶置于黑暗處,每天搖動1次,直至葉片完全變白,記錄吸光度值(OD645 nm、OD663 nm)[39]。
1.4 數據處理
利用Excel 2007整理數據并作圖,采用SPSS(SPSS V16.0,SPSS Inc., Chicago, IL,USA)軟件進行處理和方差分析,采用Duncan新復極差法進行各個處理的多重比較。
2 結果與分析
2.1 硼對熒光標記根瘤菌生長的影響
適宜硼濃度對兩種熒光標記根瘤菌的生長具有促進作用(圖1)。1至5 d時,硼對12531f的生長無明顯促進作用;7 d時,當硼濃度低于1 mg/L時其生長速度高于未添加硼處理,且添加1 mg/L硼時其生長速度最高,顯著高于未添加硼處理(P<0.05),硼濃度高于1 mg/L后,生長速度降低,與對照差異不顯著(P>0.05)(圖1A)。
1 d時,隨著硼濃度的增加,gn5f的生長速度逐漸增大,當濃度達100 mg/L時,gn5f生長速度最快,顯著高于其他處理(P<0.05);3 d時,硼濃度低于1 mg/L時,gn5f生長速度顯著低于對照(P<0.05),其余處理與對照差異不顯著(P>0.05);5和7 d時,除添加0.01 mg/L硼處理生長速度低于未添加硼處理外,其余各處理同樣與對照差異不顯著(P>0.05)(圖1B)。
表明硼對兩種不同來源的熒光標記根瘤菌生長促進作用不同,其中1 mg/L硼對12531f生長稍有促進作用,而100 mg/L硼對gn5f生長初期效果較好,隨著時間的延長則無明顯作用。
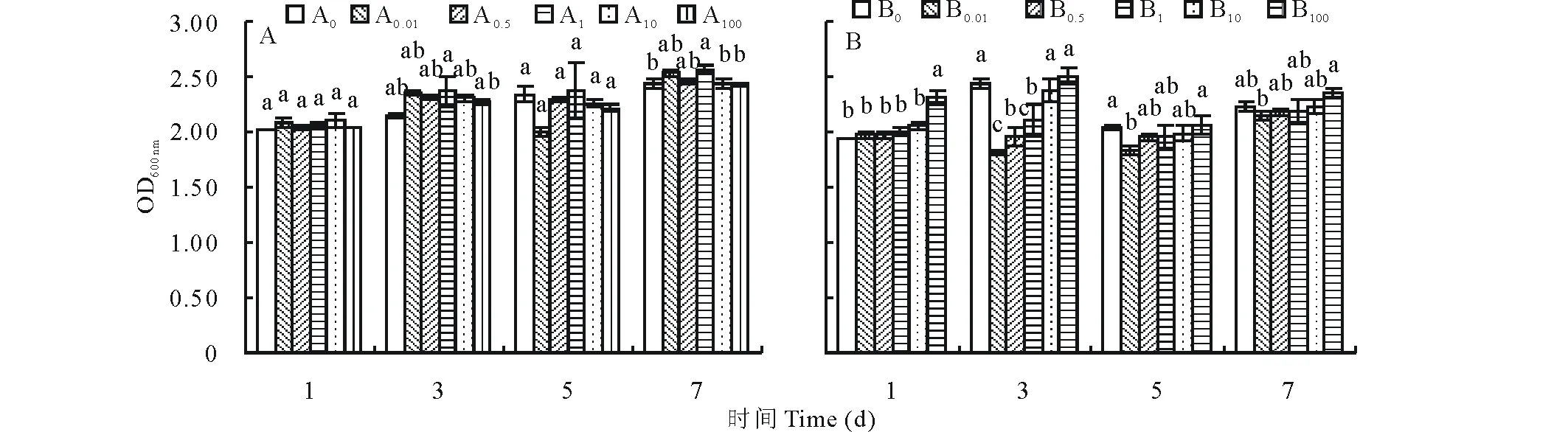
圖1 硼對12531和gn5f生長的影響變化Fig.1 Effect of boron on the growth of 12531f and gn5f A:硼對12531f 的影響Effect of boron on the growth of 12531f;B:硼對gn5f的影響Effect of boron on the growth of gn5f.不同小寫字母表示差異顯著(P<0.05),下同。 The different small letters mean the significant differences at P<0.05, the same below.
2.2 硼對熒光標記根瘤菌在苜蓿根內定殖的影響
如表2所示,添加1、10和100 mg/L硼接種12531f后,根部可檢測到熒光標記根瘤菌。添加100 mg/L硼15 d時根部12531f數量最多,達2185.00 cfu/g,但與1 mg/L硼接種45 d處理無顯著差異(P>0.05);30 d時數量減少,45 d后數量又逐漸升高。1 mg/L硼處理菌落數量顯著高于同時期其他處理(P<0.05),菌落數量在1494.27~2001.40 cfu/g范圍內波動。未添加硼處理和對照均未檢測出12531f。
不同硼濃度對gn5f在苜蓿根部運移及定殖影響不同,15 d時,添加0.01、0.5和1 mg/L硼后根內可檢測出gn5f,但三者之間差異不顯著(P>0.05);30 d時其在根內定殖數量減少,45 d后開始升高,60 d時根內定殖數量最高;添加0.5 mg/L硼后根內gn5f數量最高,達58307.11 cfu/g,但與1 mg/L硼處理差異不顯著(P>0.05)。未添加硼處理和對照均未檢出gn5f。
由此表明,兩種熒光標記根瘤菌均可以長時間在根部定殖,但硼對二者定殖的影響不同。100 mg/L硼利于12531f定殖于根部,0.5 mg/L硼利于gn5f定殖于根部。
2.3 硼對熒光標記根瘤菌在苜蓿地上各組織內運移和定殖的影響
如表3所示,添加硼后促進了12531f向下部葉和下部莖內運移并定殖,添加1 mg/L硼顯著提高了12531f在下部葉內的定殖數量,接種15 d時數量最高,達23.38 cfu/g,顯著高于其他處理(P<0.05);45 d時同樣發現1 mg/L硼促進了12531f在下部葉內的定殖,數量達11.04 cfu/g。下部莖較利于12531f定殖, 45 d時添加1 mg/L硼數量高達62.74 cfu/g,與單獨接菌處理差異顯著(P<0.05)。上部莖內,單獨接種15 d時可檢測到12531f,數量為17.81 cfu/g,其余處理未檢測到。上部葉內未檢測到12531f。60 d后檢測不到12531f。對照未檢測出12531f。
硼較適宜gn5f定殖于下部莖,接種15和30 d時,100 mg/L硼顯著提高了gn5f的定殖數量,數量分別高達57.55和51.49 cfu/g,顯著高于其他處理(P<0.05),45 d后數量逐漸減少,60 d后檢測不到gn5f。硼對gn5f在苜蓿下部葉和上部莖葉內的運移和定殖影響較小,只有在添加0.5 mg/L硼處理15 d時下部葉內檢測到少量gn5f,數量僅為2.65 cfu/g,其余處理未檢測到。未添加硼處理的單獨接菌處理和對照未檢測到gn5f。
12531f在下部莖內定殖45 d時數量最高,而gn5f在15 d時定殖數量達最高,以后數量逐漸降低,由此表明兩種熒光標記根瘤菌在苜蓿地上表現出不同的運移及定殖規律,受菌種來源及遺傳特性決定。
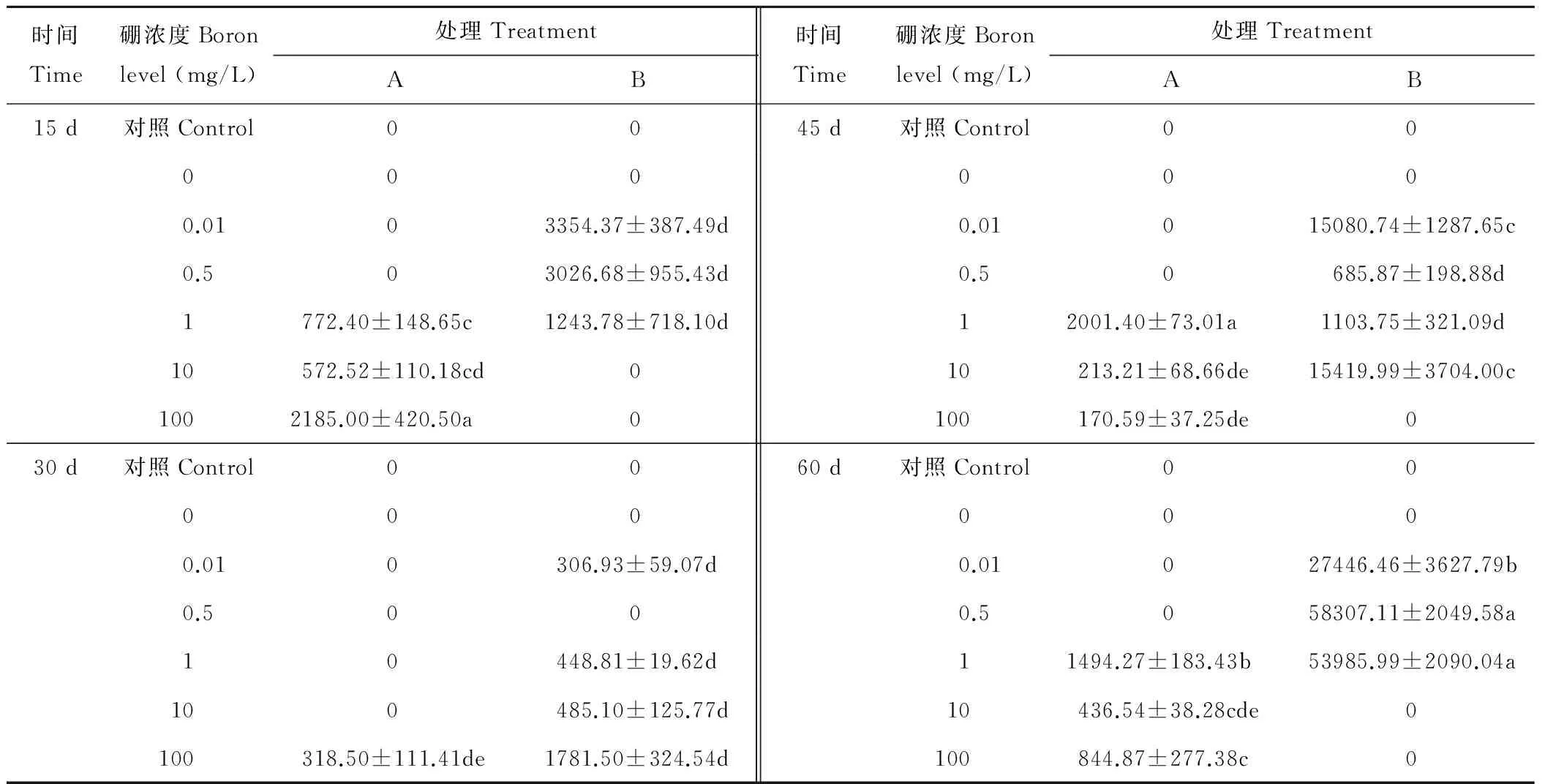
表2 硼對12531f和gn5f在苜蓿根內運移與定殖的影響Table 2 Effect of boron on the migration and colonization of 12531f and gn5f in alfalfa roots cfu/g
注:表中數據為平均值±標準誤,同列不同小寫字母表示差異顯著(P<0.05),下同。
Note: Values (mean±SE) represent the results of Duncan’s multiple range test, the different letters in the same column indicate significant differences (P<0.05), the same below.
2.4 硼和熒光標記根瘤菌接種對甘農5號紫花苜蓿單株結瘤數及根瘤重的影響
適宜濃度的硼和兩種熒光標記根瘤菌接種苜蓿幼苗有增加單株結瘤數和單株根瘤重的趨勢,但作用不明顯(表4)。1 mg/L硼和12531f接種后苜蓿單株結瘤數分別高出對照和單獨接菌處理21.32%和30.95%,但差異不顯著(P>0.05);單株根瘤重分別高出對照和單獨接菌處理34.67%和176.71%,但差異不顯著(P>0.05)。其余硼濃度與12531f混合接種后對單株結瘤數和單株根瘤重無明顯促進作用。
低濃度硼與gn5f混合接種后未提高單株結瘤數,硼濃度低于1 mg/L時,單株結瘤數低于對照和單獨接菌處理,添加10和100 mg/L硼后單株結瘤數增加,100 mg/L硼處理下數量最高,分別高出對照和單獨接菌處理23.53%和15.07%,但差異不顯著(P>0.05)。單株根瘤重僅在添加100 mg/L硼時高于對照,分別高出對照和單獨接菌處理21.67%和117.26%,同樣與對照差異不顯著(P>0.05)。
表明只有在適宜硼添加濃度下接種才可促進苜蓿根瘤的形成,且不同來源的根瘤菌要選擇不同的硼濃度。
2.5 硼和熒光標記根瘤菌接種對甘農5號紫花苜蓿幼苗生長的影響
兩種熒光標記根瘤菌接種后苜蓿幼苗單株葉片數、株高和根長均增加,添加硼后三者均高于未添加硼的單獨接菌處理和對照(表5)。硼與12531f混合接種后,隨硼濃度的增加,三者均逐漸增大,添加1 mg/L硼后達最高,單株葉片數分別顯著高出對照和單獨接菌處理89.70%和84.12%(P<0.05);株高分別顯著高出對照和單獨接菌處理133.93%和117.13%(P<0.05);根長分別高出對照和單獨接菌處理175.00%和63.64%,但與單獨接菌處理無顯著差異(P>0.05);爾后隨硼濃度的增加,單株葉片數、株高和根長逐漸減小。硼與gn5f混合接種后單株葉片數、株高和根長逐漸增加,添加100 mg/L后各指標均達到最大,其中單株葉片數分別顯著高出對照和單獨接菌處理45.45%和37.93%(P<0.05);株高分別顯著高出對照和單獨接菌處理69.64%和37.68%(P<0.05);根長分別高出對照和單獨接菌處理95.83%和17.50%,但與單獨接菌處理無顯著差異(P>0.05)。
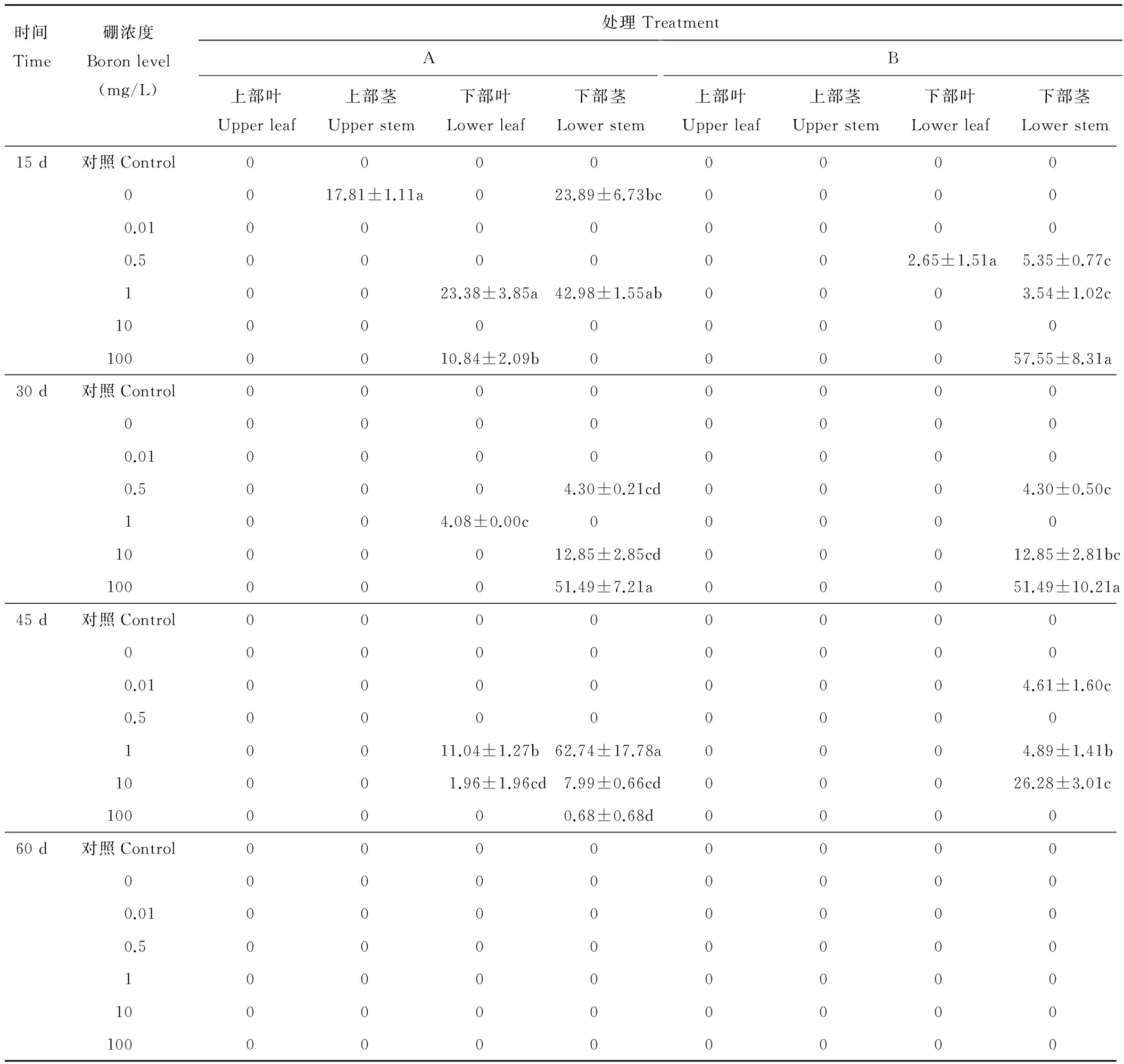
表3 硼對12531f和gn5f在苜蓿地上各組織內運移和定殖的影響Table 3 Effect of boron on the migration and colonization of 12531f and gn5f in alfalfa aerial tissues cfu/g

表4 硼和12531f、gn5f混合接種后甘農5號紫花苜蓿單株結瘤數及根瘤重Table 4 Effect of boron and 12531f, gn5f co-inoculation on the Gannong No.5 alfalfa nodule number and nodule weight
兩種熒光標記根瘤菌接種后均可增加苜蓿幼苗生物量,添加適宜濃度硼后生物量均高于對照和單獨接菌處理(表6)。硼與12531f接種后,隨著濃度的升高,生物量逐漸增加,到1 mg/L硼后地上鮮干重和根鮮干重均達最高,其中,地上鮮重分別顯著高出對照和單獨接菌處理129.73%和80.70%(P<0.05);地上干重分別顯著高出對照和單獨接菌處理172.14%和164.02%(P<0.05);根鮮重分別顯著高出對照和單獨接菌處理645.05%和395.19%(P<0.05);根干重分別顯著高出對照和單獨接菌處理909.28%和810.70%(P<0.05);爾后生物量逐漸降低,但均高于對照。與gn5f接種后,隨著硼濃度的升高,苜蓿生物量逐漸增加,至濃度達100 mg/L后,地上鮮干重和根鮮干重均達最高,其中,地上鮮重分別顯著高出對照和單獨接菌處理64.38%和36.91%(P<0.05);地上干重分別顯著高出對照和單獨接菌處理148.86%和144.25%(P<0.05);根鮮重分別顯著高出對照和單獨接菌處理757.57%和587.20%(P<0.05);根干重分別顯著高出對照和單獨接菌處理1424.24%和1268.98%(P<0.05)。

表5 硼和12531f、gn5f接種后甘農5號紫花苜蓿單株葉片數、株高和根長Table 5 Effect of boron and 12531f, gn5f co-inoculation on the Gannong No.5 alfalfa seedlings leaf number, plant height and root length
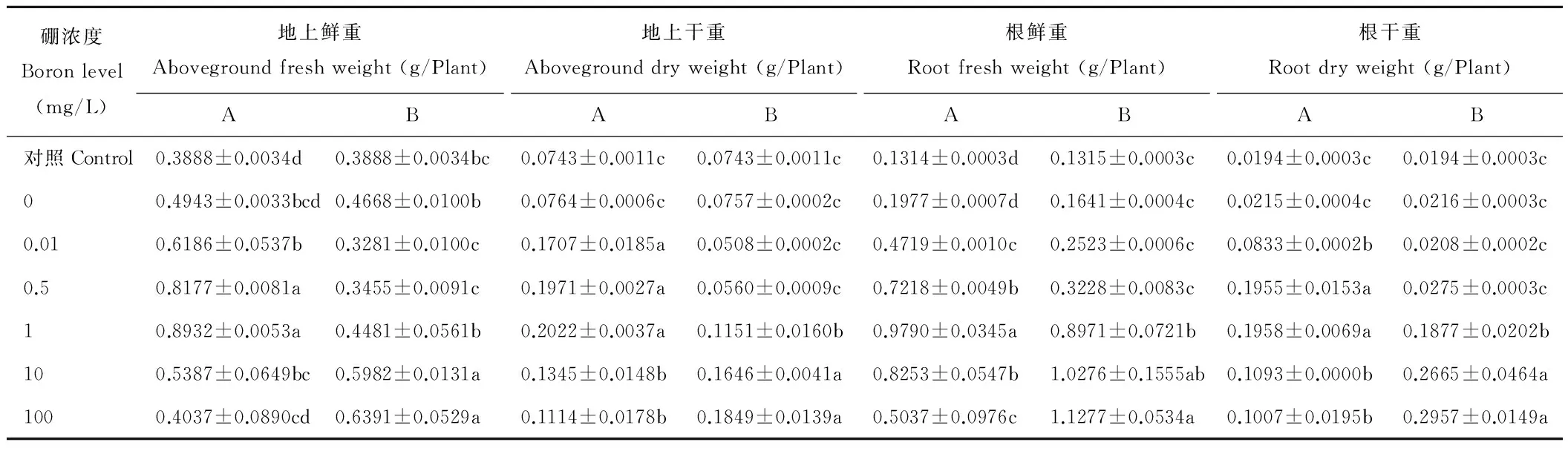
表6 硼和12531f、gn5f接種對甘農5號紫花苜蓿生物量的影響Table 6 Effect of boron and 12531f, gn5f co-inoculation on the Gannong No.5 alfalfa seedlings biomass
2.6 硼和熒光標記根瘤菌接種對甘農5號紫花苜蓿葉綠素含量的影響
不同濃度硼與兩種熒光標記根瘤菌混合接種對苜蓿葉片葉綠素含量影響不同(圖2)。單獨接種12531f時葉片葉綠素(a+b)含量低于對照,只有添加1 mg/L硼后其含量顯著高出對照,此濃度下含量分別顯著高出對照和單獨接菌處理18.31%和36.86%(P<0.05),隨后含量又降低(圖2A)。而單獨接種gn5f時葉綠素含量顯著高出對照10.17%(P<0.05),添加低濃度硼不利于葉綠素的合成,隨著硼添加濃度的增加,其含量逐漸增大,當添加100 mg/L硼后達最高,顯著高出對照和單獨接種處理24.41%和12.92%(P<0.05)(圖2B)。
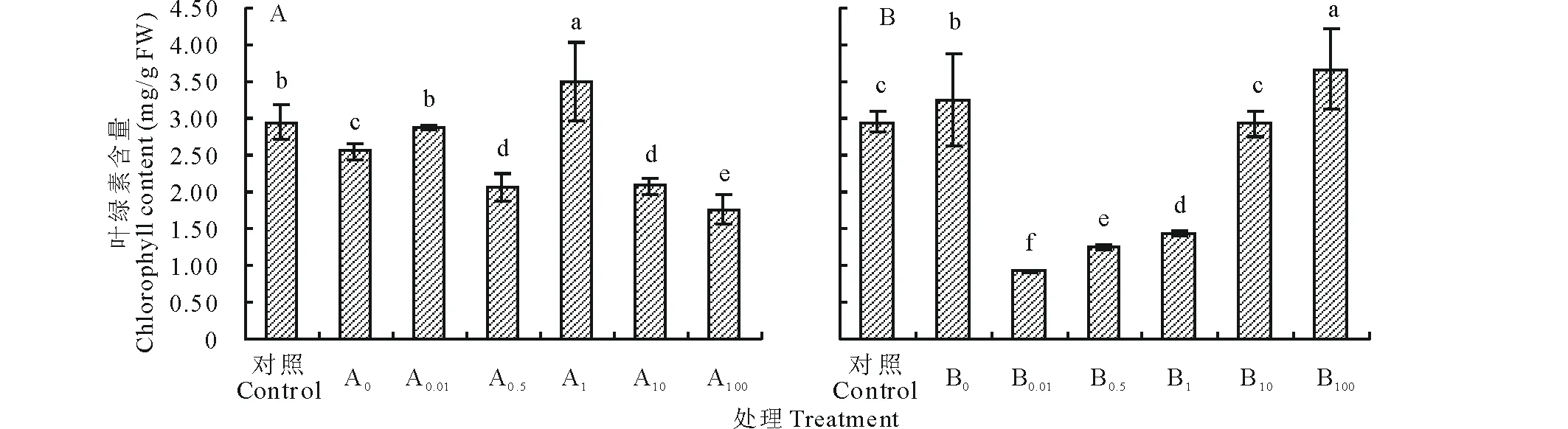
圖2 硼和熒光標記根瘤菌混合接種后甘農5號紫花苜蓿葉片葉綠素含量的變化Fig.2 Variation of Gannong No.5 alfalfa leaf chlorophyll content after boron and fluorescent tagged rhizobia co-inoculation A:硼和12531f 接種Boron and 12531f co-inoculation;B:硼和gn5f接種Boron and gn5f co-inoculation.
3 討論
3.1 硼對兩種熒光標記根瘤菌在苜蓿幼苗體內運移和定殖的影響
硼是植物生長發育和穩定根瘤細胞壁結構所必需的微量元素[40-41]。根瘤菌與植物間相互作用[42]、侵染[43]、共生體的形成[44-45]、根瘤的形成[46]都會因硼的缺乏而受到極大影響。硼對根瘤菌表面多糖的形成、共生關系的建立、高效固氮作用的發揮具有重要意義。缺硼會減弱根瘤菌的定殖能力、減少根瘤的數量并削弱固氮能力[42, 47],同時也會降低根瘤菌表面多糖的形成和其功能的發揮[48]。
硼參與根瘤菌胞外多糖(exopolysaccharide,EPS)和脂多糖(lipopolysaccharide,LPS)的形成,而EPS和LPS對根瘤菌侵染植物時所遇到的防御反應具有減弱作用。EPS可分泌到細胞表面,并抵御外來侵害[49-50],是參與共生固氮的重要物質。當根瘤菌侵染宿主時會使宿主產生防御反應,而EPS可通過表面包被減少菌體與宿主細胞的直接接觸,以規避或減弱宿主植物的防御性反應,促成根瘤菌的侵入和根瘤的形成;或在侵染過程中誘導菌體和宿主合成水解酶,引起宿主胞壁的結構變化[51]。LPS在細胞壁外壁,可維持細胞膜穩定、抵御植物抗菌素對細胞的傷害[52], LPS對根毛的吸附、侵染結構及根瘤的形成,對細胞抵御植物防御反應以及根瘤菌的宿主專一性等方面都起到重要的作用。硼同樣可促進IAA的合成,宋柏權等[30]發現當硼濃度逐漸增到2 mg/L時,甜菜葉片內IAA含量達最高,隨著硼濃度增加,其含量逐漸降低,硼素缺乏和毒害脅迫處理均會導致IAA含量的降低,因此需選擇適宜的硼濃度,而IAA能使入侵微生物易定殖于植物組織[32, 53],增加根瘤菌的侵染位置。
本試驗發現硼對兩種不同來源的熒光標記根瘤菌生長影響不同,其中1 mg/L硼對12531f生長稍有促進作用,而100 mg/L硼對gn5f生長初期效果較好,隨著時間的延長則無明顯作用,表明菌株不同,對硼的敏感性也不同。但100 mg/L硼較利于12531f在根部定殖,而0.5 mg/L硼較利于gn5f在根部定殖,且接種60 d時根內仍可以檢測大量熒光標記根瘤菌;而在苜蓿幼苗地上各組織內,1 mg/L硼可促進大量12531f運移并定殖于下部莖和下部葉內,60 d時下部莖內12531f定殖數量最多,100 mg/L硼則利用gn5f大量運移并定殖于下部莖內,45 d以后數量逐漸降低,60 d則未檢測到。該結果可能由于添加適宜的硼后促進了根瘤菌EPS及LPS的形成,減弱了宿主苜蓿對兩種熒光標記根瘤菌所產生的防御反應,或因為EPS及LPS對不同菌種活力及持久力的影響不同。
在苜蓿幼苗根系內,內源熒光標記根瘤菌gn5f的定殖數量高于外源熒光標記根瘤菌12531f,地上各部位,外源熒光標記根瘤菌12531f在1 mg/L硼作用下就可以大量定殖于下部莖和下部葉內,而內源熒光標記根瘤菌gn5f需在100 mg/L硼作用下才能達到較好效果。產生的原因一方面是與所選菌種類型有關,12531f的原始菌株12531為慢生型根瘤菌,代謝速率慢,而gn5f的原始菌株gn5為快生型根瘤菌,代謝速率快,二者遺傳性狀差異較大,因此生長過程中適宜的硼濃度不同(標記菌株與原始菌株特性未發生改變[34])。除與菌株本身遺傳特性有關外,還可能因為適宜濃度的硼與12531f混合接種后競爭了宿主防御系統的應激位點或活性中心,使寄主防御性反應減弱,從而使得運移并定殖于植物體的外源熒光標記根瘤菌數量增加。
3.2 硼和熒光標記根瘤菌接種對苜蓿幼苗的影響
苜蓿種子內含根瘤菌[54],陳丹明等[25]也發現未接種根瘤菌的4種苜蓿均出現結瘤現象,因此本試驗中對照出現結瘤現象,但數量少于接種兩種熒光標記根瘤菌的處理,說明種子內的根瘤菌競爭結瘤能力遠不如所接種的根瘤菌[55]。硼在根瘤菌固氮、提高固氮酶活性方面有重要作用。硼通過影響根對根瘤菌的碳水化合物供應,而影響豆科植物根瘤的形成[56]。添加硼后可增加結瘤個數和根瘤重,王克武等[26]也發現平谷種植苜蓿配施硼后其單株結瘤數比對照提高14.56%,本試驗中以12531f+1 mg/L硼和gn5f+100 mg/L硼處理結瘤效果較好。根瘤數量多,增加了根瘤干重和固氮能力。固氮能力的提高,進而可促進植株的生長。本試驗發現接種根瘤菌并添加硼對苜蓿生物量、葉片數、株高和根長均有顯著的促進作用。其中,1 mg/L硼和12531f接種后顯著提高了苜蓿幼苗生物量、葉片數、株高、根長和生物量;100 mg/L和gn5f接種后顯著提高了苜蓿幼苗生物量、葉片數、株高、根長和生物量。這是因為硼可改善根部氧氣含量,促進根系生長[57],利于糖分的積累,促進果實生長[58],從而為形成較高的生物量奠定基礎。何水華等[59]也發現葉面噴施速樂硼最佳濃度為0.08%,既能促進作物生殖生長,又可以明顯改善其營養生長性狀,有利于構建豐產的植株形態,提高產量。
紫花苜蓿葉片光合特性、生理代謝和光合產物代謝的變化可共同影響植株生長發育[60-61]。葉片數量的增加可以提高葉綠素含量及含氮量,利于植株進行光合作用[62]。硼利于葉綠體基質發育保護葉綠體被膜結構化,缺硼時植株葉片葉綠體基質發育退化,基粒數量減少從而影響植株光合速率[63];楊建民等[64]在研究蘋果樹品種時發現葉含量與光合速率有正相關關系。本研究同樣發現1 mg/L硼與12531f混合接種、100 mg/L硼與gn5f混合接種葉綠素含量分別顯著高于對照和其他接種處理。說明接種根瘤菌同時添加硼可以促進紫花苜蓿葉片葉綠素的合成,其含量的增加可促進光合作用的進行,進而提高產量。
可見,適宜濃度的硼對根瘤菌的生長、在植物體內運移和定殖、結瘤和生長均有一定的促進作用,但須正確選取菌株的種類、考慮根瘤菌競爭結瘤能力、共生固氮有效性。本研究初步探索了硼對兩種根瘤菌生長的影響,且只探索了硼對根瘤菌在苜蓿幼苗各組織內的運移和定殖,因此,后續研究會繼續探索硼對根瘤菌在田間營養和生殖生長階段苜蓿體內的運移和定殖。此外,還會繼續尋找利于根瘤菌生長的其他外源物質和大量選取目標根瘤菌,為促進根瘤菌的運移和定殖效果并實現目的根瘤菌導入良種苜蓿種子提供理論依據。
4 結論
1)1 mg/L硼與12531f混合接種,100 mg/L硼與gn5f混合接種利于二者在苜蓿幼苗體內運移并定殖。
2)上述兩種菌株與相應濃度硼混合接種苜蓿幼苗,對單株結瘤數、單株根瘤重、單株葉片數、株高、根長、地上鮮重、地上干重、根鮮重、根干重和葉綠素含量均有顯著促進作用。
References:
[1] Qi Z Q, Yu Y X, Hu Y G,etal. Current status and future tasks of theMedicagosativaindustry in China. Acta Prataculturae Sinica, 2008, 17(1): 107-113. 戚志強, 玉永雄, 胡躍高, 等. 當前我國苜蓿產業發展的形勢與任務. 草業學報, 2008, 17(1): 107-113.
[2] Mukhtar N, Hameed M, Ashraf M,etal. Modifications in stomatal structure and function inCenchrusciliaris(L.) andCynodondactylon(L.) pers. in response to cadmium stress. Pakistan Journal of Botany, 2013, 45(2): 351-357.
[3] Ender G, Keerszt A, Kevei Z,etal. A receptor kinase gene regulating symbiotic nodule development. Nature, 2002, 417: 962-966.
[4] Huang X, Wang Y Q, Liu J X,etal. Effect of inoculating rhizobial strains on nodulation and biomass yield of alfalfa,Medicagosativa. Acta Agriculturae Zhejiangensis, 2005, 17(6): 391-394. 黃新, 王亞琴, 劉建新, 等. 接種根瘤菌對不同紫花苜蓿品種結瘤和生物學產量的影響. 浙江農業學報, 2005, 17(6): 391-394.
[5] Ning G Z, Liu H Q, Ma X T. The progress and perspectives of widespread application of alfalfa rhizobia in China[C]//The Conference Proceedings of China Alfalfa Development. Beijing: Chinese Grassland Society, Beijing Municipal Commission of Rural Affairs, 2001: 76-82. 寧國贊, 劉惠琴, 馬曉彤. 中國苜蓿根瘤菌大面積應用研究現狀及展望[C]//中國苜蓿發展大會論文集. 北京: 中國草原學會, 北京市農村工作委員會, 2001: 76-82.
[6] Zeng Z H, Sui X H, Hu Y G,etal. Screening of highly-effectiveSinorhizobiummelilotistrains forMedicagosativacultivals and their field inoculation. Acta Prataculturae Sinica, 2004, 13(5): 95-100. 曾昭海, 隋新華, 胡躍高. 紫花苜蓿-根瘤菌高效共生體篩選及田間作用效果. 草業學報, 2004, 13(5): 95-100.
[7] Peterson T A, Russelle M P. Alfalfa and the nitrogen cycle in the corn belt. Journal of Soil and Water Conservation, 1991, 3: 229-235.
[8] Guan F Z, Qiu H R, Chen J C,etal. Rhizobium inoculants: Research progress and development status. Chinese Journal of Ecology, 2012, 31(3): 755-759. 管鳳貞, 邱宏端, 陳濟琛, 等. 根瘤菌菌劑的研究與開發現狀. 生態學雜志, 2012, 31(3): 755-759.
[9] Bashan Y. Inoculants of plant growth-promoting bacteria for use in agriculture. Biotechnology Advances, 1998, 16: 729-770.
[10] Afzal M, Khan S, Iqbal S,etal. Inoculation method affects colonization and activity ofBurkholderiaphytofirmansPsJN during phytore mediation of diesel-contaminated soil. International Biodeterioration & Biodegradation, 2013, 85: 331-336.
[11] Qi J. Screening Endogenous Rhizobia from Alfalfa Seeds and Their Promoting Alfalfa Seedlings Growth Property[D]. Lanzhou: Gansu Agricultural University, 2006. 祁娟. 苜蓿種子內生根瘤菌篩選及其促生能力研究[D]. 蘭州: 甘肅農業大學, 2006.
[12] Compant S, Duffy B, Nowak J,etal. Use of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects. Applied and Environmental Microbiology, 2005, 71: 4951-4959.
[13] Lugtenberg B, Kamilova F. Plant-growth-promoting rhizobacteria. Annual Review of Microbiology, 2009, 63: 541-556.
[14] Coombs J T, Franco C M M. Visualization of an endophyticStreptomycesspecies in wheat seed. Applied and Environmental Microbiology, 2003, 69(7): 4260-4262.
[15] Baldani J, Olivares F L, Hemerly A S,etal. Nitrogen fixing endophytes: recent advances in the association with graminaceous plants grown in the tropics[M]//Elmerich C, Kordorosi A, Newon W E. Biological Nitrogen Fixation for the 21st Century. Netherlands: Kluwer Academic Publishers, 1998: 203-206.
[16] Shi J Y, Chen W X, Liu A Y,etal. Advances in the study of endophytes and their effects on control of plant diseases. Ecologica Sinica, 2006, 26(7): 2395-2401. 石晶盈, 陳維信, 劉愛媛. 植物內生菌及其防治植物病害的研究進展. 生態學報, 2006, 26(7): 2395-2401.
[17] Wen C Y, Wu Y H, Tian X L. Recent advances and issues on the endophyte. Chinese Journal of Ecology, 2004, 23(2): 86-91. 文才藝, 吳元華, 田秀玲. 植物內生菌研究進展及其存在的問題. 生態學雜志, 2004, 23(2): 86-91.
[18] Wang Y Y, Han L B, Zeng H M. The summarize about recent research process on gramineae endophyte symbiosis. Biotechnology Bulletin, 2008, (3): 34-37. 王瑤瑤, 韓烈保, 曾會明. 禾本科植物內生菌研究進展. 生物技術通報, 2008, (3): 34-37.
[19] Ji K X, Chi F, Yang M F,etal. Movement of rhizobia inside tobacco and lifestyle alternation from endophytes to free-living rhizobia on leaves. Journal of Microbiology and Biotechnology, 2010, 20(2): 238-244.
[20] Chi F, Shen S H, Cheng H P,etal. Ascending migration of endophytic rhizobia, from roots to leaves, inside rice plants and assessment of benefits to rice growth physiology. Applied and Environmental Microbiology, 2005, 71(11): 7271-7278.
[21] Li J F, Zhang S Q, Shi S L,etal. Position and quantity of endogensis rhizobia in alfalfa plant. Chinese Journal of Eco-Agriculture, 2009, 17(6): 1200-1205. 李劍峰, 張淑卿, 師尚禮, 等. 苜蓿內生根瘤菌分布部位與數量變化動態. 中國生態農業學報, 2009, 17(6): 1200-1205.
[22] Li J F, Zhang S Q, Shi S L,etal. Infection and migration of marked rhizobia in alfalfa bud seedlings under the action of exogenous substance. Acta Agrestia Sinica, 2015, 23(6): 1259-1264. 李劍峰, 張淑卿, 師尚禮, 等. 幾種外源物質對內生根瘤菌侵染苜蓿芽苗并在植株體內運移的影響. 草地學報, 2015, 23(6): 1259-1264.
[23] Zhang S Q. Migration of Rhizobia inside Alfalfa Plants and Influencing Factors[D]. Lanzhou: Gansu Agricultural University, 2012. 張淑卿. 基于熒光標記的苜蓿根瘤菌侵入植株體內的運移特性及影響因素研究[D]. 蘭州: 甘肅農業大學, 2012.
[24] Zhang L, Wang X F, Luo Z,etal. Effect of calium and phosphorous on migration, propagation and quorum sensing of rhizobia in acid soil unde aluminum stress. Acta Pedologica Sinica, 2014, 51(5): 1120-1131. 張磊, 王曉峰, 羅珍, 等. 鈣磷對酸鋁土壤中苜蓿根瘤菌遷移定殖和群體感應的影響. 土壤學報, 2014, 51(5): 1120-1131.
[25] Chen D M, Zeng Z H, Sui X H,etal. Screening of high efficient symbiontic rhizobium on alfalfa. Pratacultural Science, 2002, 19(6): 27-31. 陳丹明, 曾昭海, 隋新華, 等. 紫花苜蓿共生根瘤菌的篩選. 草業科學, 2002, 19(6): 27-31.
[26] Wang K W, Chen Q, Li X L. Effects of Zn, B and Mo application on the growth and quality of alfalfa. Soils and Fertilizers, 2003, (3): 24-28. 王克武, 陳清, 李曉林. 施用硼、鋅、鉬肥對紫花苜蓿生長及品質的影響. 土壤肥料, 2003, (3): 24-28.
[27] Guo L Z, Zhang H T, He Y H,etal. Effect of rhizobium on crop growth and nitrogen nutrition of a pea/maize intercropping system. Acta Prataculturae Sinica, 2012, 21(1): 43-49. 郭麗琢, 張虎天, 何亞慧, 等. 根瘤菌接種對豌豆/玉米間作系統作物生長及氮素營養的影響. 草業學報, 2012, 21(1): 43-49.
[28] Wang Q, Han Q F, Jia Z K. Effect of spraying trace element fertilizers at different levels on alfalfa quality in arid and semiarid areas of Northwestern China. Acta Agrestia Sinica, 2008, 16(4): 409-411. 王琴, 韓清芳, 賈志寬. 噴施微肥對西北干旱半干旱區紫花苜蓿品質的影響. 草地學報, 2008, 16(4): 409-411.
[29] Liu G H, Han J G, Wang K. Effects of boron, zinc and macronutrients on the yield and quality of alfalfa. Acta Agrestia Sinica, 2004, 12(4): 268-272. 劉貴河, 韓建國, 王堃. 硼、鉬、鋅與大量元素配施對紫花苜蓿草產量和品質的影響. 草地學報, 2004, 12(4): 268-272.
[30] Song B Q, Pei X Y, Yan Z S,etal. Effects of boron on endogenous hormones of sugar beet. Chinese Agricultural Science Bulletin, 2015, 31(6): 115-120. 宋柏權, 裴軒瑗, 閆志山, 等. 硼素對甜菜內源激素的影響研究. 中國農學通報, 2015, 31(6): 115-120.
[31] Fuentes-Ramirez L E, Jimenez-Salgado T, Abarca-Ocampo I R,etal. Acetobacter diazotrophicus, an indoleacetic acid producing bacterium isolated from sugarcane cultivates of Mexico. Plant and Soil, 1993, 154(2): 145-150.
[32] Wu Y, Xi L Q. Dynamics of IAA produced by nitrogen fixation bacteria around oat root system. Journal of Anhui Agricultural Sciences, 2007, 35(15): 4424-4425, 4441. 吳瑛, 席琳喬. 燕麥根際固氮菌分泌IAA的動態變化研究. 安徽農業科學, 2007, 35(15): 4424-4425, 4441.
[33] Zhang Z M, Chen H G, Li F D,etal. Construction of gene library and isolation of pRaZ15 containing complete nodulation genes inRhizobiumastragali. Chinese Journal of Biotechnology, 1991, 7(3): 213-219, 293. 張忠明, 陳華癸, 李阜棣, 等. 紫云英根瘤菌基因文庫的構建及含完整結瘤基因的重組質粒pRaZ15的分離. 生物工程學報, 1991, 7(3): 213-219, 293.
[34] Zhang S Q, Li J F, Chen L Y,etal. Establishment and screen of cyan fluorescent protein labeled strains of alfalfa rhizobia. Pratacultural Science, 2015, (5): 711-718. 張淑卿, 李劍峰, 陳力玉, 等. 苜蓿根瘤菌cfp熒光標記株的構建及篩選方法. 草業科學, 2015, (5): 711-718.
[35] Hoagland D R, Arnon D I. The water culture method for growing plants without soil. California Agricultural Experiment Station Bulletin, 1950, 347: 1-39.
[36] Malik K A, Bilal R. Survival and colonization of inoculated bacteria in kallar grass rhizosphere and quantification of N2fixation[M]//Skinner F A, Bodderand R M, Fendrik I. Nitrogen Fixation With Nonlegumes. Netherlands: Kluwer Academic Publishers, 1989: 301-310.
[37] Shi D C, Zhao K F. Effects of sodium chloride and carbonate on growth ofPuccinelliatunuifloraand on present state of mineral elements in nutrient solution. Acta Prataculturae Sinica, 1997, 6(2): 51-61. 石德成, 趙可夫. NaCl和Na2CO3對星星草生長及營養液中主要礦質元素存在狀態的影響. 草業學報, 1997, 6(2): 51-61.
[38] Liu J X, Wang R J, Wang X,etal. Effect of La(NO3)3on seedling growth and physiological characteristics of ryegrass under NaCl stress. Chinese Journal of Eco-Agriculture, 2011, 19(2): 353-357. 劉建新, 王瑞娟, 王鑫, 等. La(NO3)3對鹽脅迫下黑麥草幼苗生長及抗逆生理特性的影響. 中國生態農業學報, 2011, 19(2): 353-357.
[39] Wang L, Bai Y L. Correlation between corn leaf spectral reflectance and leaf total nitrogen and chlorophyll content under different nitrogen level. Scientia Agricultura Sinica, 2005, 38(11): 2268-2276. 王磊, 白由路. 不同氮處理春玉米葉片光譜反射率與葉片全氮和葉綠素含量的相關研究. 中國農業科學, 2005, 38(11): 2268-2276.
[41] Bonilla I, Mergold-Villaseor C, Campos M E,etal. The aberrant cell walls of boron-deficient bean root nodules have no covalently bound hydroxyproline-/proline rich proteins. Plant Physiology, 1997, 115: 1329-1340.
[42] Redondo-Nieto M, Rivilla R, El-Hamdaoui A,etal. Boron deficiency affects early infection events in the peaRhizobiumsymbiotic interaction. Australian Journal of Plant Physiology, 2001, 28: 819-823.
[45] Redondo-Nieto M, Pulido L, Reguera M,etal. Developmentally regulated membrane glycoproteins sharing antigenicity with rhamnogalacturonan II are not detected in nodulated boron deficientPisumsativum. Plant Cell and Environment, 2007, 30: 1436-1443.
[46] Reguera M, Espí A, Bolaos L,etal. Endoreduplication prior cell differentiation fails in boron deficient-legume nodules. Is boron involved in signaling during cell cycle regulation. New Phytologist, 2009, 183: 8-12.
[47] Redondo-Nieto M, Wilmot A, El-Hamdaoui A,etal. Relationship between boron and calcium in the N2-fixing legume-rhizobia symbiosis. Plant Cell and Environment, 2003, 26: 1905-1915.
[48] Downie J A. The roles of extracellular proteins, polysaccharides and signals in the interactions of rhizobia with legume roots. FEMS Microbiology Reviews, 2010, 34: 150-170.
[49] Becker A, Puhler A. Production of exopolysaccharides[M]//The Rhizobiaceae. Dordrecht, Boston: Kluwer Academic Publishers, 1998: 97-118.
[50] Kannenberg E L, Brewin N J. Host-plant invasion byRhizobium: the role of cell-surface components. Trends in Microbiology, 1994, 2: 277-283.
[51] Xu Y J, Zhao L F. Progress in research of structure and function of rhizobia exopolysaccharides. The Beverage Industry, 2008, 11(12): 7-9. 徐亞軍, 趙龍飛. 根瘤菌胞外多糖的結構與功能研究進展. 飲料工業, 2008, 11(12): 7-9.
[52] Kannenberg E L, Reuhs B L, Forsberg L S,etal. Lipopolysaccharides and K-antigens: their structures, biosynthesis, and functions[M]//The Rhizobiaceae. Dordrecht, Boston: Kluwer Academic Publishers, 1998, 160: 119-154.
[53] Remirez F. Acetobacter diazotrophicus, an IAA producing bacterium isolated from sugar cane cultivates of Mexico. Plant and Soil, 1993, 154: 145-150.
[54] Zhang S Q, Li J F, Shi S L,etal. Quantity and ecological dominance of endogenesis rhizobia in budseedling and seeds of alfalfa. Chinese Journal of Grassland, 2009, (5): 90-95. 張淑卿, 李劍峰, 師尚禮, 等. 內生根瘤菌在苜蓿芽苗與種子內的數量及優勢度. 中國草地學報, 2009, (5): 90-95.
[55] Hardarson G, Heichel G H, Vance C P,etal. Evaluation of alfalfa andRhizobiummelilotifor compatibility in nodulation and nodule effectiveness. Crop Science, 1981, 21: 562-567.
[56] Liu L C, Jiang C C, Liu G D,etal. The progress of physiological effect of boron in plants and its impact on several important metabolites. Chinese Agricultural Science Bulletin, 2014, 30(6): 270. 劉磊超, 姜存倉, 劉桂東, 等. 硼在植物體內的生理效應及其對幾種重要代謝產物影響的研究進展. 中國農學通報, 2014, 30(6): 270.
[57] Plibean D J. The physiological role of boron in plants. Plant Nutrition, 1983, 6(7): 563-582.
[58] Xiao J X, Yan X, Peng S A,etal. Relationship between boron deficiency occurance and annual changes in contents of boron and sugar of Newhall Navel orange. Acta Horticultural Sinica, 2006, 33(2): 356-359. 肖家欣, 嚴翔, 彭抒昂, 等. 紐荷爾臍橙缺硼表現與其硼、糖含量年變化的關系. 園藝學報, 2006, 33(2): 356-359.
[59] He S H, Chen F, Liu G,etal. Effect of foliar spraying different concentrations boron fertilizer on hybrid seed yield of the variety of Chinese cabbage. Journal of Zhejiang Agricultural Sciences, 2015, 56(3): 338-340. 何水華, 陳飛, 劉剛, 等. 葉面噴施不同濃度硼肥對雜交小白菜制種產量的影響. 浙江農業科學, 2015, 56(3): 338-340.
[60] Jia H T, Zhao C Y, Sheng Y,etal. Study on diurnal variation of photosynthesis forMedicagosativain arid area. Pratacultural Science, 2009, 26(7): 56-60. 賈宏濤, 趙成義, 盛鈺, 等. 干旱地區紫花苜蓿光合日變化規律研究. 草業科學, 2009, 26(7): 56-60.
[61] Liu H X, Shen X R, Guo Z G. Effects of silicon on seed germination and seedling growth of alfalfa. Acta Prataculturae Sinica, 2011, 20(1): 155-160. 劉慧霞, 申曉蓉, 郭正剛. 硅對紫花苜蓿種子萌發及幼苗生長發育的影響. 草業學報, 2011, 20(1): 155-160.
[62] Dong Z X. Study on Photosynthetic Characteristics of Different Varieties of Alfalfa[D]. Yangling: North West Agriculture and Forestry University, 2007. 董志新. 不同苜蓿品種光合特性研究[D]. 楊凌: 西北農林科技大學, 2007.
[63] Wei W X, Wang Y H, Sun X Z. Effect of boron deficiency on leaf and pollen structure of sunflower. Journal of Huazhong Agricultural University, 1993, (5): 464-467, 529-531. 魏文學, 王運華, 孫香枝. 缺硼對向日葵葉組織及花粉結構的影響. 華中農業大學學報, 1993, (5): 464-467, 529-531.
[64] Yang J M, Wang Z Y. Comparative studies on the photosynthetic properties of spur-type and ordinary apple trees. Scientia Agricultura Sinica, 1994, 27(4): 31-36. 楊建民, 王中英. 短枝型與普通型蘋果葉片光合特性比較. 中國農業科學, 1994, 27(4): 31-36.
Effect of boron on migration and colonization by rhizobia and seedling growth inMedicagosativa
MIAO Yang-Yang, ZHOU Tong, SHI Shang-Li*, KANG Wen-Juan, ZHANG Yun-Ting
CollegeofGrasslandScience,GansuAgriculturalUniversity,KeyLaboratoryforGrasslandEcosystemofMinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.S.CentersforGrazingLandEcosystemSustainability,Lanzhou730070,China
The effect of boron on the migration and colonization of rhizobia in Gannong No.5 alfalfa (MedicagosativaGannong No.5) tissues and subsequently seedling growth were investigated by root drenching using two cyan fluorescent protein (CFP) tagged rhizobia;Ensifermeliloti12531f (12531f) andEnsifermelilotiGN5f (gn5f) containing different boron concentrations. The results showed that the best supplementation levels were less than 1 and 100 mg/L boron for 12531f and gn5f respectively. The optimum boron level enhanced the colonization of both rhizobia in alfalfa roots; colonization densities of 2184.99 and 58307.11 cfu/g were achieved by using 100 mg/L boron co-inoculated 12531f and 0.5 mg/L boron co-inoculated gn5f, respectively. Rhizobia were able to migrate to the aerial tissues and colonize lower stems and leaves through application of 1 mg/L boron co-inoculated 12531f and 100 mg/L boron co-inoculated gn5f, respectively. No fluorescent tagged rhizobia were detected in the control treatment. Individual plant root nodule number, nodule weight, leaf number, plant height, root length, aerial fresh weight, aerial dry weight, root fresh weight and root dry weight were increased by 21.31%-909.28% for the 1 mg/L boron co-inoculated 12531f treatment compared with control and zero boron innoculation. These traits were increased by 15.07%-1424.24% for the 100 mg/L boron co-inoculated gn5f treatment compared with control and zero boron inoculation treatments. Leaf chlorophyll content was reduced by 12531f without boron whereas 1 mg/L boron co-inoculated 12531f significantly increased the leaf chlorophyll content by 18.31% and 36.86% compared with the control and zero boron inoculation, respectively (P<0.05). Boron supplemented gn5f enhanced the leaf chlorophyll content; 100 mg/L boron co-inoculated gn5f increased leaf chlorophyll content by 24.41% and 12.92% compared with control and zero born inoculation, respectively (P<0.05). The results suggest that 1 mg/L boron co-inoculation with 12531f, 100 mg/L boron co-inoculation with gn5f promoted the migration and colonization of rhizobia in alfalfa seedlings, enhancing growth, indicating possible benefits for alfalfa cultivation.
fluorescent tagged rhizobia; boron;Medicagosativa; migration and colonization; growth promoting
10.11686/cyxb2016340
http://cyxb.lzu.edu.cn
2016-09-06;改回日期:2016-11-28
國家自然科學基金項目(31560666)資助。
苗陽陽(1989-),女,滿族,遼寧本溪人,在讀博士。E-mail:yangyangmiao.com@163.com*通信作者Corresponding author. E-mail:shishl@gsau.edu.cn
苗陽陽, 周彤, 師尚禮, 康文娟, 張運婷. 硼對根瘤菌在紫花苜蓿體內運移和定殖及對幼苗生長的影響. 草業學報, 2017, 26(4): 120-133.
MIAO Yang-Yang, ZHOU Tong, SHI Shang-Li, KANG Wen-Juan, ZHANG Yun-Ting. Effect of boron on migration and colonization by rhizobia and seedling growth inMedicagosativa. Acta Prataculturae Sinica, 2017, 26(4): 120-133.

