著眼于知識體系完善和化學素養提升的習題課教學策略
江蘇省蘇州市吳江汾湖高級中學(215211) 金 茹 ●
著眼于知識體系完善和化學素養提升的習題課教學策略
江蘇省蘇州市吳江汾湖高級中學(215211) 金 茹 ●
從完善化學知識體系和提升化學素質角度研究了習題課教學的策略.
知識體系;化學素養;習題教學策略
習題課是中學化學課堂教學的重要課型,習題課應該怎么設計?是簡單地就題論題、將知識點一一羅列?還是海納百川、大搞題海戰術?還是舍簡就繁,做個尋章摘句老雕蟲?筆者認為習題課不僅要和學生羅列知識,更重要的是幫助學生建立知識體系,不能搞題海戰術,要百里挑一地精選習題激活學生的思維,不鉆牛角尖不專攻偏難題,是要緊扣概念、原理等學科主干知識,逐一掃除學生思維里的盲區,不為了方法而方法,注重思維過程,水到渠成地提升學生的化學學科素養.下面筆者就根據自己的教學實踐簡單談談幾點感悟.
一、從概念、原理出發,正本清源,找準思維著眼點
很多時候,學生在解題過程中出現困惑是因為概念和原理不清導致的,我們在習題課教學中,尤其應該注重將概念和原理作為習題教學的立足點,由此出發幫助學生找準思維著眼點.
例1 在T℃時,向體積為2 L的某恒容密閉容器內通入2 mol一氧化碳氣體和2 mol水蒸氣,發生反應 CO,一段時間后達到化學平衡狀態.(1)繼續向該容器里通入2mol一氧化碳氣體或2mol水蒸氣,則化學平衡向____移動.(填“正向“、”逆向“或”不移動“)(2)繼續向該容器里通入2mol一氧化碳氣體和2mol水蒸氣,則化學平衡向____移動.(填“正向“、”逆向“或”不移動“)
解析 第(1)問直接考查勒沙特利原理:在等溫、等容條件下,增大了一氧化碳或水蒸氣濃度,正反應速率瞬間加快,逆反應速率保持不變,致使v(正)>v(逆),從而導致反應向正方向移動.第(2)問則有分歧,有部分學生繼續使用勒沙特利原理,迅速得出平衡右移的結論.而有部分學生則認為不能簡單采用第一問單一平衡思路來解決,應以等效平衡原理為依據,“繼續向該容器里通入2 mol一氧化碳氣體和2 mol水蒸氣”,相當于往2 L容器中一次性通入4 mol一氧化碳氣體和4 mol水蒸氣,若容器體積相應變為4 L,則顯然與題設條件構成等效平衡,最終反應物的平衡轉化率、平衡濃度、百分含量保持不變.容器體積變為2 L,相當于增大壓強,考慮到該反應左右兩端屬于“m+n=p+q”型,即反應前后氣體體積保持不變,增大壓強對平衡無影響,所以得出平衡不移動的結論.貌似都有理有據,但真理只有一個,究竟怎樣去偽存真呢?此時還是應該從基本概念入手,從結果看,最終平衡與初始平衡屬于等效平衡,但并不完全相同,各物質的百分含量、溫度、體積均相同,而各物質的濃度、壓強則不同(對應成比例).不同的結果源自不同的過程,在繼續通入一氧化碳氣體和水蒸氣后,正反應速率瞬間增大,逆反應速率未及變化,此時v(正)>v(逆),平衡向正方向移動.達到新平衡時,濃度的數據也證明了這一點,一氧化碳和水蒸氣的濃度相對于通入氣體瞬間減小,二氧化碳和氫氣濃度則相應增大,都說明平衡正向移動了.
點評 化學平衡屬于典型的動態平衡,一旦改變了外界條件,正逆反應速率相應改變,v(正)與v(逆)不再相等,平衡向正向或逆向移動.亦即化學平衡移動原理研究的是過程.等效平衡是指一定條件下,同一個可逆反應的不同的初始狀態可以達到各種組分含量相同的平衡狀態.闡述的是平衡狀態與平衡狀態的關系,研究的是狀態.另外,各種組分含量相同并不等價于各種組分濃度相同,可以相同,也可以對應成比例.換言之,等效平衡其實包括各項參數全等的相同平衡和部分參數成比例的相似平衡.在習題教學時要注意以基本概念為出發點,嚴密梳理相關概念的內涵和外延,不斷完善認知體系.
二、注意層層設疑,拾階而上,提升思維著力點
有很多時候一個大問題擺在學生面前,學生不能立刻解決,如果我們從一個情境出發將問題細化,借助于層層設疑的方式給學生提供一串問題,往往能夠有效發散學生的思維,提高解決問題的能力和學習效果.
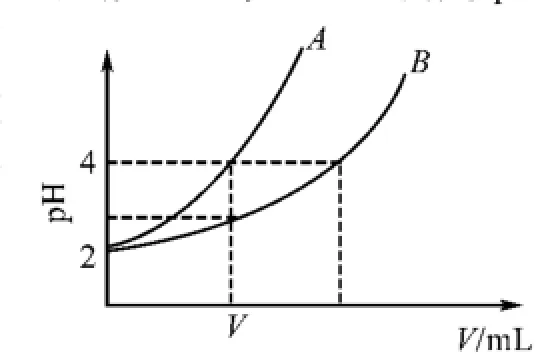
例2 在20℃時,兩種一元酸HA與HB,經測定pH均為2.現取等體積的酸并加水稀釋(忽略前后體積的變化),兩種物質的pH變化與所加入的水的體積關系如右圖所示,請完成下列問題:
(1)兩種酸的起始濃度是否一樣?電離度是否一樣?
(2)從圖形中觀察,稀釋相同倍數后,pH的變化如何?可以確定誰是弱酸?另外一種酸一定是強酸嗎?稀釋到pH為4,誰加入水的體積更多?
(3)比較兩種酸的電離度大小?稀釋前哪種酸的物質的量濃度大?
(4)向10 mL 0.01 mol/L的HA溶液中加入V mL水后,溶液的pH變為4,可見,HA是強酸嗎?V是多少?
(5)取兩塊大小、形狀均相同且足量的鋅粒,分別投入體積相同的兩份酸溶液中,產生氫氣速率較快的是哪種酸溶液?產生氣體體積較大的又是哪種?
(6)改變條件使得HB的電離度增大,下列正確的說法有( ).
A.c(H+)一定增大 B.c(B-)一定增大
C.溶液的溫度一定升高 D.n(B-)一定增大
(7)總結如何判定一種酸為弱酸?
點評 絕大多數學生并不能一開始就高屋建瓴地把握住知識的全貌,因此在設計問題時要有意識地給學生的思維鋪設階梯.問題(1)幫助學生認識氫離子濃度與酸起始濃度的關系,以理解弱酸的電離度.(2)幫助學生學會圖像解讀,從圖像數據中加以分析,得出兩種酸的相對強弱(3)通過回顧電離度概念,熟練運用電離度定義公式進行電離度與濃度的相互轉化.(4)在定性理解強、弱電解質稀釋的基礎上,定量計算強電解質溶液稀釋過程中的pH變化.(5)從氫離子濃度變化角度闡述強弱電解質的區別,同時將所學理論知識用于實際問題的解決.(6)引導學生運用電離平衡原理分析外界條件改變對弱電解質電離的影響.問題(7)對上述五個問題進行了歸納總結,促進了學生認知體系的升華.
G632
B
1008-0333(2017)03-0091-01

