非小細胞肺癌化療藥物耐藥性及其與ERCC1、RRM1表達的相關性*
張強,翟西菊,魏麗,王新立,李新霞,姚迎迎
臨床醫學
非小細胞肺癌化療藥物耐藥性及其與ERCC1、RRM1表達的相關性*
張強,翟西菊,魏麗,王新立,李新霞,姚迎迎
目的探討原代培養非小細胞肺癌(NSCLC)細胞對化療藥物的耐藥性,及其與非小細胞肺癌組織中ERCC1、RRM1基因表達的關系。方法取手術切除的新鮮非小細胞肺癌組織標本,制備成活細胞濃度為(2~3)×105/ m l的單細胞懸液,分別加入10倍血漿峰值藥物濃度順鉑(CDDP)、吉西他濱(GEM)、培美曲塞、依托泊苷(VP-16)。用MTT法檢測經上述藥物作用后腫瘤細胞活力及代謝活性的變化;同時取非小細胞肺癌組織制成石蠟切片,用免疫組化檢測ERCC1、RRM1蛋白的表達。結果(1)ERCC1和RRM1在80例NSCLC組織中的表達均高于癌旁組織,差異有統計學意義(P值均<0.05)。(2)ERCC1的陽性表達與順鉑的耐藥性有統計學意義(P<0.05);RRM1的陽性表達與吉西他濱的耐藥性有統計學意義(P<0.05)。結論ERCC1、RRM 1蛋白可能成為NSCLC患者化療耐藥的預測因子,二者聯合檢測有助于NSCLC患者個體化治療方案的選擇。
非小細胞肺癌;ERCC1;RRM 1;化療耐藥性;基因表達
肺癌是導致癌癥患者死亡的重要原因之一,其中非小細胞肺癌(non-small cell lung cancer,NSCLC)在我國約占肺癌總數的85%。手術切除及術后輔以放化療是NSCLC的標準治療方案,但治療效果卻欠佳,NSCLC患者的化療有效率僅為30%~40%,生存時間提高有限[1-3],患者中位生存期約為1年[4,5]。其最主要原因是腫瘤耐藥及經驗用藥,所以基于化療藥物敏感性試驗的個體化化療成為治療趨勢。通過體外藥敏試驗,在化療實施前篩選出有效的化療藥物,可以避免腫瘤耐藥及經驗用藥等問題,對于實現腫瘤化療的合理化、個體化有實用價值。
人切除修復交叉互補基因1(excision repair cross-complementing gene 1,ERCC1)定位于染色體19q13.2~19q13.3,是NER系統中的關鍵基因。ERCC1缺陷將會導致嚴重的DNA修復障礙[6]。RRM1是核苷酸還原酶(RR)調節M1亞單位。它能使二磷酸核苷酸轉化為二磷酸脫氧核苷酸,后者是DNA合成和修復過程中必不可少的原料,因此,RR是DNA合成和修復的限速酶[7]。該文從臨床實際出發,采用MTT比色法檢測NSCLC一線化療方案中常用的4種藥物的敏感性,探討NSCLC原代細胞對化療藥物的耐藥性;用免疫組化法檢測ERCC1、RRM1在NSCLC組織中的表達,并進一步分析其表達與化療藥物耐藥性的相關性,為NSCLC的臨床化療提供個體化用藥的實驗資料和依據。
1 資料與方法
1.1 一般資料收集2012年1月—2015年12月在泰山醫學院附屬醫院胸外科手術切除的,術后經病理證實的80例NSCLC標本。術前均未接受放化療。其中男42例,女38例;年齡39~76歲,中位年齡54歲。
1.2 方法
1.2.1 MTT藥物敏感試驗[8]取外科手術切除的新鮮NSCLC組織80例。所取組織無壞死、變性,經酸性離子水反復沖洗后置于添加有100 IU/m l青霉素和100μg/m l鏈霉素的Hank的平衡鹽溶液中。在超凈工作臺內,用無菌剪刀剪碎腫瘤組織,放入37℃含有鏈霉蛋白酶(XXV,Sigma Chemical,St. Louis,MO)、膠原酶(I,Sigma)和DNA裂解酶I(I,Sigma)的無菌液中輕輕攪拌消化20 min后,添加足夠有效量的培養液。細胞通過尼龍網過濾,以1000 r/min離心10min,棄上清,用10%胎牛血清RPMI-1640培養液重懸。計數,調整活細胞濃度至(2~3)×105個/m l。試驗組:取單細胞懸液加入96孔培養板,每孔100μl,分別加入藥物終濃度為10倍血漿峰值濃度[9]的順鉑、吉西他濱、培美曲塞、VP-16,每組藥物設5個復孔;置于37℃、5%CO2濃度的培養箱中培養24 h后,每孔加入0.5%MTT(5mg/ ml)20μl,4 h后終止培養。每孔加入0.04N鹽酸異丙醇100μl,充分溶解所生成的結晶物,靜止10min,通過酶標儀檢測在570 nm波長光密度值(OD值)。取5復孔OD值的平均值作為腫瘤細胞在此藥物組的平均OD值。)對照組每孔加入分離純化后的單細胞懸液100μl,不加藥物;空白組每孔加入100μl培養液;腫瘤細胞抑制率=(對照組OD值-用藥組平均OD值)/(對照孔平均OD值-空白組OD值)× 100%。腫瘤細胞抑制率≥30%為敏感,<30%為耐藥。
1.2.2 免疫組化檢測NSCLC組織及癌旁組織經10%中性福爾馬林充分固定,常規石蠟包埋,免疫組化采用SP法,嚴格按試劑盒說明書進行。ERCC1主要在胞核和胞質中表達,RRM1主要在胞質中表達,陽性呈棕黃色顆粒。結果判定采用雙盲法,運用Lecia Qwin Plus軟件進行分析,定位準確的棕黃色顆粒面積>5%為陽性,<5%為陰性。
1.2.3 統計學方法采用SPSS 17.0統計包進行分析,計數資料用χ2檢驗,連續性校正χ2檢驗和Fisher精確概率計算法進行顯著性檢驗。P<0.05為差異具有統計學意義。
2 結果
2.1 免疫組化染色結果ERCC1主要定位于細胞核和細胞質,RRM1定位于細胞質呈棕黃色顆粒。見圖1~4。ERCC1和RRM1在80例NSCLC組織中的表達均高于癌旁組織(42 vs 22,40 vs 21),差異具有統計學意義(P值均為0.000)。

圖1 ERCC1在NSCLC中細胞核陽性表達(SP法×200)
圖2 ERCC1在癌旁組織中細胞核陽性表達(SP法×200)

圖3 RRM 1在NSCLC中細胞質陽性表達(SP法×200)
圖4 RRM 1在癌旁組織中細胞質陽性表達(SP法×200)
2.2 NSCLC組織中ERCC1、RRM 1與表達結果與M TT藥敏的關系將MTT檢測結果中抑制率≥30%者判為敏感,而<30%者判為耐藥。ERCC1的陽性表達與順鉑的體外耐藥性有統計學意義(P=0.010,P<0.05);與吉西他濱、培美曲塞及VP-16與的體外耐藥性無關(P>0.05);RRM1的陽性表達與吉西他濱的體外耐藥性有統計學意義(P=0.010,P< 0.05;與順鉑、培美曲塞及VP-16與的體外耐藥性無關(P>0.05)。見表1。
3 討論
在世界范圍內,肺癌是死亡率最高的疾病之一。晚期非小細胞肺癌患者的一線化療方案是鉑類聯合三代新藥如紫杉類、吉西他濱、培美曲塞、長春新堿、伊立替康等[10,11]。然而,晚期非小細胞肺癌患者的5年生存率仍低于15%。研究表明非小細胞肺癌患者治療效果不理想的原因之一是腫瘤細胞對于化療藥物的耐藥性。
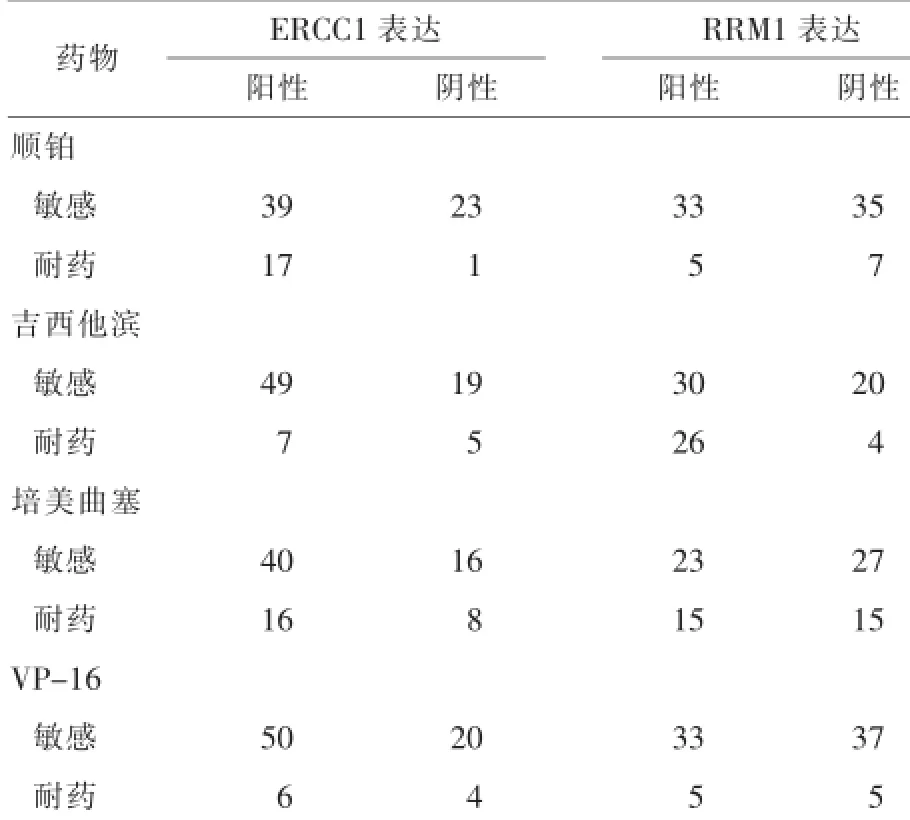
表1 NSCLC組織中ERCC1、RRM 1與表達結果與MTT藥敏的關系
ERCC1定位于19號染色體上,是核苷酸剪切修復家族中的重要成員之一,是核苷酸切除修復系統(NER)的關鍵酶,其與XPF形成異源二聚體,在受損DNA單鏈的5’端進行剪切而發揮功能。鉑類化療藥物的作用機制是:鉑類作為一種重金屬復合物與腫瘤細胞的DNA雙鏈形成加合物導致DNA損傷,進而引起腫瘤細胞死亡,從而起到抗腫瘤作用。當ERCC1在腫瘤組織中過表達并激活NER通路后,使停滯在G2/M期細胞的損傷DNA得到迅速修復,從而導致腫瘤對鉑類藥物產生耐藥性[12,13]。筆者分析了80例非小細胞肺癌患者腫瘤細胞和癌旁組織中ERCC1表達,研究表明ERCC1的陽性表達與順鉑的耐藥性有統計學意義(P<0.05),體外試驗的結果顯示ERCC1的陽性表達與順鉑的體外耐藥性有統計學意義(P=0.010),與Cho等的研究是一致的[12]。
RRM1是核苷酸還原酶調節M1亞單位,是DNA合成與修復通路中的限速酶,也是核苷類似物系化療藥物吉西他濱的結合位點,后者通過抑制核苷酸還原酶的活性起到殺傷腫瘤細胞的作用。Rosell等[1]采用定量PCR方法檢測了75例NSCLC組織標本中RRM1 mRNA表達,在接受了吉西他濱/順鉑聯合化療組發現RRM1 mRNA低表達的患者對化療的反應較好,患者從治療開始至腫瘤病灶出現進展的時間與RRM1 mRNA的表達水平呈負相關。Ceppi等[14,15]研究表明NSCLC組織中RRM1高表達的患者對吉西他濱耐藥。其作用機制可能是RRM1過表達逆轉二磷酸核苷酸成為二磷酸脫氧核苷酸,促進核苷類似物系化療藥物引起的DNA損傷修復,從而產生耐藥。該研究顯示RRM1的陽性表達與吉西他濱的體外耐藥性有統計學意義(P=0.010);與順鉑、培美曲塞及VP-16與的體外耐藥性無關(P>0.05),與上述結論一致。
最近國內外許多研究表明,藥敏試驗可以作為研究腫瘤化療療效的有效方法,腫瘤細胞的體外化療藥物敏感性試驗結果與體內化療療效的符合率達80%以上,且試驗結果為陰性者,幾乎可以肯定為體內臨床用藥的耐藥病例[9,16]。因此,通過體外MTT藥敏試驗對NSCLC不同個體進行化療藥物篩選是克服NSCLC耐藥性和提高患者生存率的有效途徑之一。
綜上所述,ERCC1、RRM1的表達水平可預測NSCLC患者的化療藥物耐藥性,在化療前聯合檢測ERCC1、RRM1可為NSCLC的臨床化療提供個體化用藥的方案和依據。
[1]Rosell R,Bivona TG,Karachaliou N.Genetics and biomarkers in personalisation of lung cancer treatment[J].Lancet,2013,382(9893):720-731.
[2]Field JK,Oudkerk M,Pedersen JH,et al.Prospects for population screening and diagnosis of lung cancer[J].Lancet,2013,382(9893):732-741.
[3]Huber RM,Reck M,Thomas M.Current status of and future strategies for multimodality treatment of unresectable stage III nonsmall cell lung cancer[J].The European Respiratory Journal,2013,42(4):1119-1133.
[4]Bidoli P,Zilembo N,Cortinovis D,et al.Randomized phase II three-arm trial with three platinum-based doublets in metastatic non-small-cell lung cancer.An Italian Trials in Medical Oncology study[J].Annals of Oncology:Official Journal of the European Society for Medical Oncology/ESMO,2007,18(3):461-467.
[5]Vilmar A,Sorensen JB.Excision repair cross-complementation group 1(ERCC1)in platinum-based treatment of non-small cell lung cancer with special emphasis on carboplatin:a review of current literature[J].Lung cancer,2009,64(2):131-139.
[6]Bep ler G,Kusmartseva I,Sharma S,et al.RRM1 modulated in vitro and in vivo efficacy of gemcitabine and platinum in nonsmall-cell lung cancer[J].Journal of Clinical Oncology:Official Journal of the American Society of Clinical Oncology,2006,24(29):4731-4737.
[7]Metzger R,Leichman CG,Danenberg KD,et al.ERCC1 mRNA levels complement thymidylate synthase mRNA levels in predicting response and survival for gastric cancer patients receiving combination cisplatin and fluorouracil chemotherapy[J].
Journal of Clinical Oncology:Official Journal of the American Society of Clinical Oncology,1998,16(1):309-316.
[8]Liu X,Wang X,Du W,et al.Suppressor of fused(Sufu)represses Gli1 transcription and nuclear accumulation,inhibits glioma cell proliferation,invasion and vasculogenic mimicry,improving glioma chemo-sensitivity and prognosis[J].Oncotarget,2014,5(22):11681-11694.
[9]Takenaka T,Yoshino I,Kouso H,et al.Combined evaluation of Rad51 and ERCC1 expressions for sensitivity to p latinum agents in non-small cell lung cancer[J].International Journal of Cancer. Journal International du Cancer,2007,121(4):895-900.
[10]Pujol JL,Barlesi F,Daures JP.Should chemotherapy combinations for advanced non-small cell lung cancer be platinumbased?A meta-analysis of phase III randomized trials[J]. Lung Cancer,2006,51(3):335-345.
[11]Smit EF,van Meerbeeck JP,Lianes P,et al.European Organization for R,Three-arm randomized study of two cisp latinbased regimens and paclitaxel plus gemcitabine in advanced non-small-cell lung cancer:a phase III trial of the European Organization for Research and Treatment of Cancer Lung Cancer Group-EORTC 08975[J].Journal of Clinical Oncology:Official Journal of the American Society of Clinical Oncology,2003,21(21):3909-3917.
[12]Cho YB,Chung HJ,Lee WY,et al.Relationship between TYMS and ERCC1 mRNA expression and in vitro chemosensitivity in colorectal cancer[J].Anticancer Research,2011,31(11):3843-3849.
[13]Han Y,Wang XB,Xiao N,et al.mRNA expression and clinical significance of ERCC1,BRCA1,RRM1,TYMS and TUBB3 in postoperative patients with non-small cell lung cancer[J]. Asian Pacific Journal of Cancer Prevention:APJCP,2013,14(5):2987-2990.
[14]Singh N,Aggarwal AN.ERCC1 and RRM1 expression in nonsmall-cell lung cancer:the good,the bad and the unknown[J]. Journal of Thoracic Oncology:Official Publication of the International Association for the Study of Lung Cancer,2009,4(8):1042-1043.
[15]Ceppi P,Volante M,Novello S,et al.ERCC1 and RRM1 gene expressions but not EGFR are predictive of shorter survival in advanced non-small-cell lung cancer treated with cisplatin and gemcitabine[J].Annals of Oncology:Official Journal of the European Society for Medical Oncology/ESMO,2006,17(12):1818-1825.
[16]Wang L,Li PF,Geng M,et al.Correlation between chemosensitivity to anticancer drugs and telomerase reverse transcriptase mRNA expression in gastric cancer[J].Diagnostic Pathology,2013,8(1):33.
[2016-07-08收稿,2016-08-06修回][本文編輯:董冰媛]
Drug-resistance of NSCLC to chemotherapy,and its relativity w ith ERCC 1 and RRM 1 expression
ZHANG Qiang①,ZHAI Xi-jü,WEI Li,et al.
①The Affiliated Hospital to Taishan Medical College,Tai'an,Shandong 271000,China
Objective To evaluate the drug-resistance of NSCLC to chemotherapy and to explore the relationship between ERCC1 or RRM1 expression and the resistance.M ethods NSCLC fresh specimens from surgically resected tisssues were sampled.A single-cell suspension of tumor cells(2×105to 3×105cells/m l)were separately exposed to cisp latin(CDDP),gemcitabine(GEM),pemetrexed,Etoposide(VP-16)at ten times peak plasm concentration(PPC).Inhibitory rate of cells was detected by MTT assay.Expression of ERCC1 and RRM1 in NSCLC tissues were detected by immunohistochemistry(IHC).Results 1)The positivity of ERCC1 and RRM1 was significantly hyper-expressed in NSCLC compared with control adjacent tissue(P<0.05).2)The positive expression of ERCC1 stained cells showed resistance to cisplatin(P<0.05);The positive expression of RRM1 stained cells showed resistance to GEM(P<0.05).Conclusion ERCC1,RRM1 protein may be taken as predictors of the NSCLC patients with drug-resistance to the chemotherapy,the joint detection helps NSCLC patients to choice individualized treatment plan.
NSCLC(non-small cell lung cancer);ERCC1;RRM1;Drug-resistance to chemotherapy;Gene expression
R734.2
A
10.14172/j.issn1671-4008.2017.01.004
山東省醫藥衛生科技發展計劃項目(2013WS0322)
271000山東泰安,泰山醫學院附屬醫院(張強,魏麗,王新立,李新霞,姚迎迎);泰安市腫瘤醫院(翟西菊)

