新生兒圍產期不同血糖水平對HIE預后的意義
張良江,薛彥銳,楊波平,陳樹嫻
(廣東省潮州市潮安區人民醫院兒科,廣東 潮州 515638)
新生兒圍產期不同血糖水平對HIE預后的意義
張良江,薛彥銳,楊波平,陳樹嫻
(廣東省潮州市潮安區人民醫院兒科,廣東 潮州 515638)
目的 評估新生兒缺血缺氧性腦病(HIE)血糖紊亂與遠期預后的關聯性。方法 回顧性分析2010年1月至2014年12月在廣東省潮州市潮安區人民醫院住院的HIE患兒114例,以發病18個月后貝利嬰兒發展量表(BSID)<80分為標準分為智能異常組77例和智能正常組37例,分析血糖異常情況與遠期預后的關聯性。結果 智能正常組高血糖、低血糖,及反復高血糖、反復低血糖比例均低于智能異常組,組間比較差異均有統計學意義(χ2值分別為8.274、9.003、4.404、7.881,均P<0.05),而兩組高血糖合并低血糖、反復高血糖合并低血糖發生率組間比較差異均無統計學意義(χ2值分別為0.030、0.720,均P>0.05);經Logistic回歸分析結果表明高血糖、低血糖、反復高血糖、反復低血糖4個因素均為BSID評分<80分的危險因素(χ2值分別為5.571、5.996、7.227、5.179,均P<0.05)。結論 HIE患兒發病早期內血糖紊亂發生率較高,而高血糖和低血糖均與遠期不良預后存在關聯性。
圍產期;缺血缺氧性腦病;血糖;智能;遠期預后
新生兒缺血缺氧性腦病(hypoxic ischaemic ence ̄phalopathy,HIE)是圍產期最嚴重的并發癥之一,是新生兒死亡和神經功能障礙的主要原因。隨著我國婦幼保健事業的發展,HIE的死亡率已經降至1.5‰~3‰,但因窒息造成不同程度傷殘的HIE患兒仍保持在30萬左右[1]。目前,亞低溫療法是最常用的治療HIE方法,發病后6h內采用該方法能明顯改善HIE預后,但仍有部分患兒死亡和遺留神經功能障礙[2];Shankaran等[3]的研究發現,更長或更深度的低溫療法也無法降低死亡率,因此尋找能影響和判斷預后的因素有重要的臨床意義。有研究對血糖異常和HIE預后的關系進行了探索,其認為兩者存在明顯的相關性[4];但也有學者認為血糖紊亂并不影響HIE預后[5]。目前的研究多以HIE短期預后作為終點指標,遠期預后評價極少涉及,因此兩者的確切聯系仍不明確。為進一步明確血糖異常對HIE遠期預后的影響,本研究回顧性分析了部分病例,為臨床決策提供更具體、充分的依據。
1資料和方法
1.1一般資料
回顧性分析2010年1月至2014年12月在廣東省潮州市潮安區人民醫院分娩確診為HIE的新生兒,入選標準:①孕周≥36周,單胎妊娠,性別不限;②病史、臨床癥狀和影像學檢查確診HIE,病程<12h;③住院期間有至少4次血糖監測數據,監測時間必須在靜脈補糖后4h;④18個月后未死亡同時接受神經功能檢測的患兒。排除標準:①合并心、肝、腎、血液系統疾病;②顱內出血、低鈣血癥、先天性疾病、遺傳代謝性疾病、產傷、宮內感染等引起的腦損傷。
1.2檢查指標
患兒病情資料包括:年齡、性別、孕周、體重、分娩方式、Apgar評分、并發癥、實驗室檢查(本院臨床采集末梢血測血糖)和影像學檢查。
1.3評價指標
①低血糖:末梢血血糖≤40mg/dL;②高血糖:末梢血血糖>150mg/dL;③神經功能評價:采用貝利嬰兒發展量表(Bayley Scales of Infant Development,BSID),該量表由Bayley于1969年編制,用于評定2個月~2.5歲嬰幼兒心理智能發展,包括運動量表、智力量表和行為記錄3個部分,其中智力發育指數(MDI)與運動發育指數(PDI)用于評定運動和智能的發展水平,是目前臨床上廣泛應用的兒童智能量表之一。本研究采用易受蓉1990年修訂的中國城市常模計算MDI和PDI,測試結果按發展指數等級的分布進行評分,130分以上為非常優秀,120~129分為優秀,110~119分為中上,90~109分為中等,80~89分為中下,70~79分為臨界狀態,69分為發育遲緩[6],本研究以BSID評分<80分為智能發育異常。
1.4統計學方法
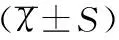
2結果
2.1一般情況
本次共有114例患兒符合入選標準,以發病18個月后BSID<80分為標準分為智能異常組和智能正常組,其中智能正常組37例(32.46%),智能異常組77例(67.54%),兩組性別、剖宮產率、孕周和并發癥發生率組間比較差異均無統計學意義(均P>0.05);而智能異常組出生時體重、Apgar評分、輕度HIE發生率均低于正常組,重度HIE發生率高于正常組(均P<0.05),見表1。
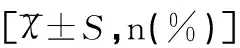
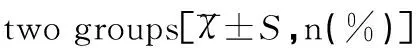
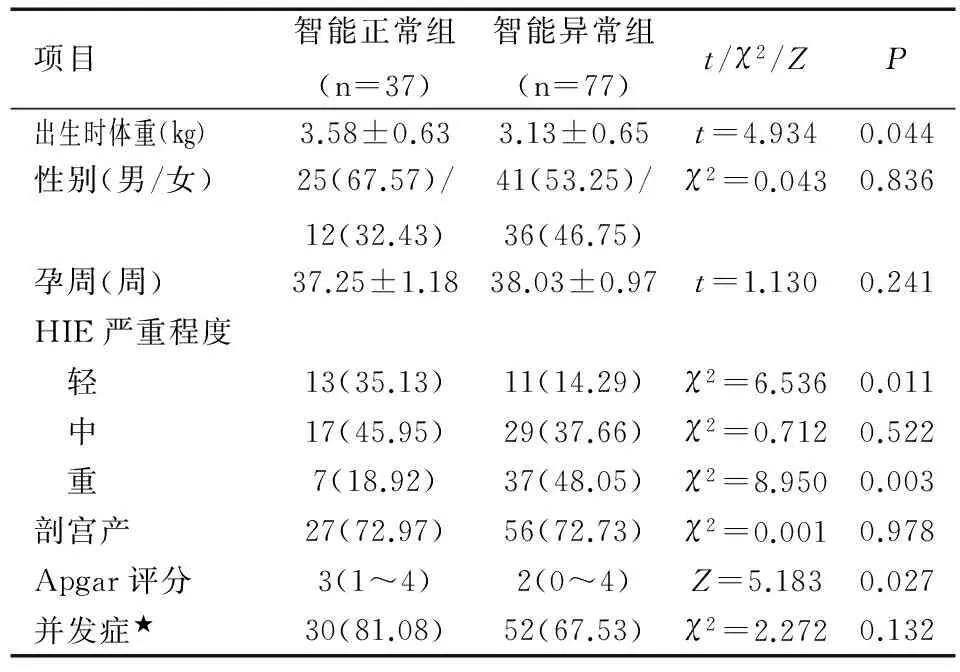
項目智能正常組(n=37)智能異常組(n=77)t/χ2/ZP出生時體重(kg)3.58±0.633.13±0.65t=4.9340.044性別(男/女)25(67.57)/12(32.43)41(53.25)/36(46.75)χ2=0.0430.836孕周(周)37.25±1.1838.03±0.97t=1.1300.241HIE嚴重程度 輕13(35.13)11(14.29)χ2=6.5360.011 中17(45.95)29(37.66)χ2=0.7120.522 重7(18.92)37(48.05)χ2=8.9500.003剖宮產27(72.97)56(72.73)χ2=0.0010.978Apgar評分3(1~4)2(0~4)Z=5.1830.027并發癥★30(81.08)52(67.53)χ2=2.2720.132
注:★包括胎膜早破、臍帶脫垂、臍帶纏繞、羊水糞染、肩先露、胎盤早剝、子宮破裂、胎兒窘迫等。
2.2血糖情況
智能正常組高血糖、低血糖,以及反復高血糖、反復低血糖發生率均低于智能異常組,組間比較差異均有統計學意義(均P<0.05),而兩組高血糖合并低血糖、反復高血糖合并低血糖發生率組間比較差異均無統計學意義(均P>0.05),見表2。
表2 兩組血糖異常情況比較結果[n(%)]
Table 2 Comparison of abnormal blood sugar between two groups [n(%)]
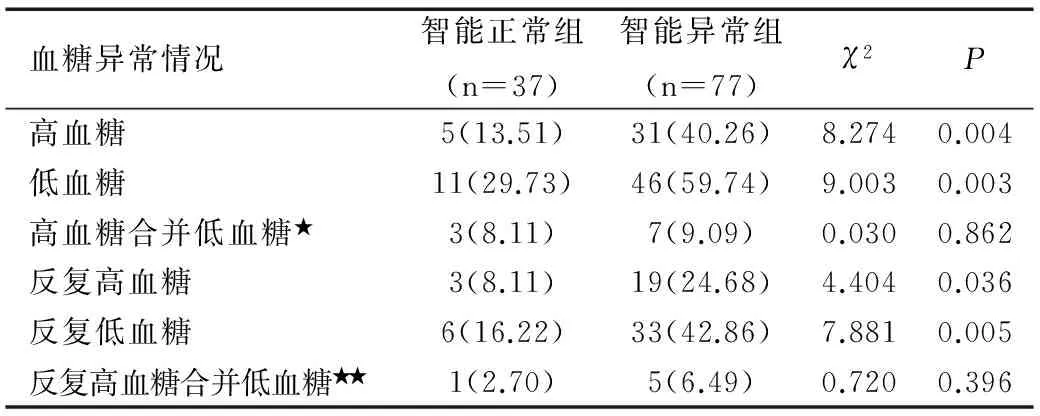
注:★指出現了1次高血糖和低血糖;★★指出現了2次及以上的高血糖和低血糖。
2.3智能異常危險因素Logistic回歸分析
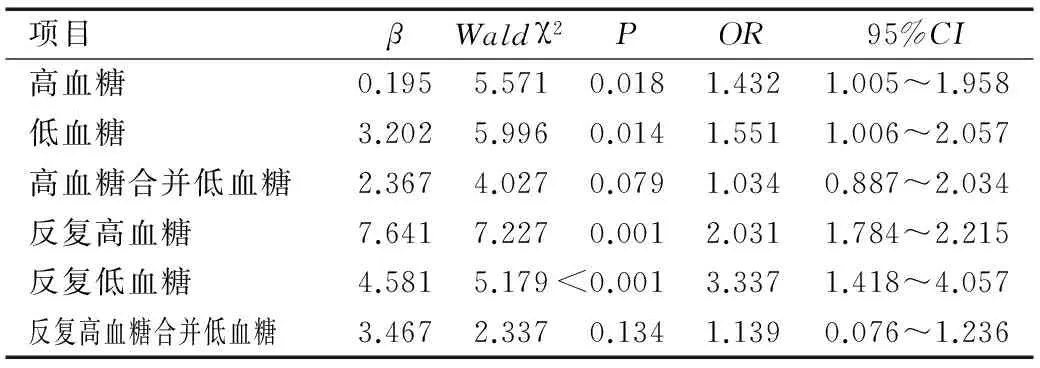
以入組時作為BSID評分<80分為自變量,高血糖、低血糖、高血糖合并低血糖、反復高血糖、反復低血糖、反復高血糖合并低血糖作為因變量引入Logistic回歸分析,結果表明高血糖、低血糖、反復高血糖、反復低血糖4個因素均為BSID評分<80分的危險因素(均P<0.05),而高血糖合并低血糖、反復高血糖合并低血糖與BSID評分<80分無明顯關聯性,見表3。
表3 智能異常危險因素Logistic回歸分析
Table 3 Logistic regression analysis of risk factors for intelligent abnormality
3討論
3.1血糖與神經功能損傷預后的關聯性
葡萄糖是體內重要能量的來源,代謝紊亂可引起明顯的神經元損傷,新生兒娩出母體后經胎盤提供的血糖即停止,體內的血糖穩態主要依靠儲存的肝糖原、激素水平和食物的攝取。由于HIE引起代謝和激素水平的紊亂,低血糖或高血糖在HIE患兒中經常發生,可對神經功能造成不同程度的影響[1]。本研究結果表明,產后早期血糖紊亂與HIE遠期預后有關。本研究結果與動物實驗結果一致,缺氧時低血糖犬神經元無氧糖酵解比血糖正常犬增強,導致磷酸肌酸、三磷酸腺苷(ATP)等高能磷酸儲備迅速耗竭,低血糖還可以選擇性地抑制豬體內腺苷誘導的腦血管擴張[7]。高血糖可使缺氧的豬、乳羊和成年大鼠神經元氧消耗減少和酸性物質生成增多,導致神經功能損傷加重,而創傷出現后的治療已無明顯效果[8]。由于母體接受激素而出現的高血糖同樣可以加重腦損傷,這也是臨床上糖皮質激素催熟后高血糖時程更長和神經系統并發癥更多的原因[9]。在大鼠心臟驟停的模型中單純注射葡萄糖可引起神經組織損傷,而聯合胰島素注射時腦組織病理損傷明顯減輕[10]。值得注意的是,由于本研究為回顧性分析,無法確認血糖水平與HIE預后存在因果關系。同時,HIE患兒出現低血糖合并高血糖時與HIE預后無關,表明醫源性因素可能起主要作用。
HIE患兒由于窒息、缺氧、禁食、合并感染等創傷造成肝糖原儲備衰竭,糖異生功能不成熟,容易出現低血糖,而且發生率很高[11]。雖然新生兒低血糖的標準目前尚有很大的爭議,但低血糖對神經功能的影響在足月和早產兒均有充分的研究,PET/CT對HIE患兒腦組織進行掃描發現病灶周圍腦組織糖代謝嚴重紊亂,而亞急性期全腦組織糖代謝率與HIE嚴重程度和短期預后呈負相關[12],發病3天后的MRI也表明低血糖和窒息性腦損傷影像學表現相互重疊[13],而Nadeem等[5]對52例足月HIE患兒進行了24個月的調查,結果發現低血糖與神經功能預后無關,兩者關系需要更多研究加以明確。
3.2顱腦損傷患兒血糖升高的病理生理機制
血糖升高的主要原因是機體在應激狀態下兒茶酚胺、胰高血糖素及皮質醇等水平上升,增加肝糖原分解及糖異生,同時機體存在胰島素分泌相對減少或胰島素抵抗等。另外,重度缺氧可導致胰島素受體數量及受體最大特異性結合率降低,胰島素靶細胞受體無法產生預期的生物效應,因此高血糖是嚴重顱腦損傷的表現[1]。動物實驗表明,窒息可導致血糖穩態失衡,最后引起神經功能障礙,而誘導性高血糖能降低神經元細胞對缺氧的反應,增加細胞間隙過氧化產物和天冬氨酸鹽的水平,加快神經元凋亡[14]。Al Shafouri等[15]認為急性腦缺氧之前的高血糖可明顯加重神經損傷,Spies等[16]則認為早期的高血糖與HIE患兒遠期的粗大運動功能障礙有關。相比于低血糖,對HIE和醫源性因素以外的高血糖研究目前比較匱乏,其與HIE的預后更不明確。
3.3本研究的不足
本研究也存在若干不足之處:①病例為回顧性分析,同時排除了死亡病例,無法確定血糖與HIE預后的因果關系,確切的證據需要前瞻性的研究;②由于診療習慣的原因,無法收集患兒確診HIE前的血糖數據,可能會低估血糖異常的實際發生率;③患兒發病后的葡萄糖滴注速度和劑量無公認的標準,臨床實踐中患兒補液方法也未作統一規定,其對血糖異常的貢獻值難以量化,因此同時出現高血糖和低血糖的患兒可能受外源性葡萄糖的影響較大;④所收集的血糖值均來源于末梢血,患兒靜脈血血糖值無法得到,而且測量時間也未統一,后續的研究需要對各種影響因素進行規范化。
綜上所述,HIE患兒發病早期內血糖紊亂發生率較高,而高血糖和低血糖均與遠期不良預后存在關聯性,后續的研究應該進一步確證血糖紊亂對神經功能損傷的預測作用。
[1]李相紅.新生兒缺氧缺血性腦病急性期血糖變化及臨床意義的研究進展[J].中國中西醫結合兒科學,2012,4(1):43-44.
[2]Jacobs S E,Berg M,Hunt R,etal.Cooling for newborns with hypoxic ischaemic encephalopathy[J/CD].Cochrane Database Syst Rev,2013,(1):CD003311.
[3]Shankaran S, Laptook A R, Pappas A,etal.Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy:a randomized clinical trial[J].JAMA,2014,312(24):2629-2639.
[4]Basu P, Som S, Choudhuri N,etal.Contribution of the blood glucose level in perinatal asphyxia[J].Eur J Pediatr,2009,168(7):833-838.
[5]Nadeem M,Murray D M,Boylan G B,etal.Early blood glucose profile and neurodevelopmental outcome at two years in neonatal hypoxic-ischaemic encephalopathy[J].BMC Pediatr,2011,11:10.
[6]周藝,喻璨,蔣麗仙.135 名低出生體重兒的貝利嬰幼兒發展量表測試分析[J].昆明醫科大學學報,2013,34(11):102-104.
[7]Kyng K J,Skajaa T,Kerrn-Jespersen S,etal.A piglet model of neonatal hypoxic-ischemic encephalopathy[J].J Vis Exp,2015,(99):e52454.
[8]Hosono T, Kamo A, Hakotani S,etal.Effect of hypothermia on motor function of adult rats after neonatal hyperthermic hypoxic-ischemic brain insult[J].Eur J Appl Physiol,2010,109(1):35-39.
[9]Reynolds R M.Programming effects of glucocorticoids[J].Clin Obstet Gynecol,2013,56(3):602-609.
[10]Liu Y, Li X, Xie C,etal.Prevention effects and possible molecular mechanism of mulberry leaf extract and its formulation on rats with insulin-insensitivity[J].PLoS One,2016,11(4):e0152728.
[11]Basu S K, Kaiser J R, Guffey D,etal.Hypoglycaemia and hyperglycaemia are associated with unfavourable outcome in infants with hypoxic ischaemic encephalopathy:a post hoc analysis of the CoolCap Study[J].Arch Dis Child Fetal Neonatal Ed,2016,101(2):F149-F155.
[12]Shi Y, Zhao J N, Liu L,etal.Changes of positron emission tomography in newborn infants at different gestational ages, and neonatal hypoxic-ischemic encephalopathy[J].Pediatr Neurol,2012,46(2):116-123.
[13]Wong D S,Poskitt K J,Chau V,etal.Brain injury patterns in hypoglycemia in neonatal encephalopathy[J].AJNR Am J Neuroradiol,2013,34(7):1456-1461.
[14]姚華.20例危重兒合并高滲血癥的回顧分析[J].中國婦幼健康研究,2014,25(1):135-137.
[15]Al Shafouri N, Narvey M, Srinivasan G,etal.High glucose variability is associated with poor neurodevelopmental outcomes in neonatal hypoxic ischemic encephalopathy[J].J Neonatal Perinatal Med,2015,8(2):119-124.
[16]Spies E E, Lababidi S L, McBride M C.Early hyperglycemia is associated with poor gross motor outcome in asphyxiated term newborns[J].Pediatr Neurol,2014,50(6):586-590.
[專業責任編輯:李占魁]
Prognostic significance of different perinatal blood glucose levels for HIE neonates
ZHANG Liang-jiang, XUE Yan-rui, YANG Bo-ping, CHEN Shu-xian
(DepartmentofPediatrics,People’sHospitalofChaoanDistrictinChaozhou,GuangdongChozhou515638,China)
Objective To evaluate the correlation of neonatal hypoxic ischemic encephalopathy (HIE) long-term prognosis and blood sugar disorder. Methods From January 2010 to December 2014, 114 patients of HIE hospitalized in People’s Hospital of Chaoan District in Chaozhou were retrospective analyzed. They were divided into abnormal intelligence group (n=77) and normal intelligence groups (n=37) according to Bayley Scales of Infant Development (BSID)<80 in 18 months latter. Correlation of blood glucose abnormalities and long-term prognosis was analyzed. Results Proportions of hyperglycemia, hypoglycemia and repeated hyperglycemia and repeated hypoglycemia in normal intelligence group were lower than those in abnormal intelligence group with significant differences (χ2value was 8.274, 9.003, 4.404 and 7.881, respectively, allP<0.05). There were no significant differences in the incidence of hyperglycemia complicating hypoglycemia and repeated hyperglycemia complicating hypoglycemia between two groups (χ2value was 0.030 and 0.720, respectively, bothP>0.05). Logistic regression analysis showed that hyperglycemia, hypoglycemia, repeated hyperglycemia and repeated hypoglycemia were risk factors for BSID score<80 (χ2value was 5.571, 5.996, 7.227 and 5.179, respectively, allP<0.05). Conclusion The incidence of blood sugar disorder in early stage of HIE is high. Hypoglycemia and hyperglycemia are positively correlated with poor long-term prognosis.
perinatal period; hypoxic ischemic encephalopathy (HIE); blood glucose; intelligence; long-term prognosis
2016-10-11
張良江(1980-),男,副主任醫師,主要從事新生兒疾病臨床診療工作。
10.3969/j.issn.1673-5293.2017.03.006
R714.7
A
1673-5293(2017)03-0237-03

