膽道鏡清創治療胰腺炎胰周膿腫經驗總結
郝金成+梁雅靜+曹廣濤
(日照市中醫醫院普外科,山東日照 276800)
[摘 要] 目的:分析膽道鏡清創治療胰腺炎胰周膿腫的效果與安全性,總結治療經驗。方法:2012年2月~2016年2月59例胰腺炎胰周膿腫患者接受介入超聲穿刺置管引流、竇道擴張、膽道鏡清創治療,記錄其引流情況、清創情況、治療效果、并發癥發生情況及1年隨訪結果。結果:59例患者介入超聲穿刺引流均成功實施,56例患者于數次清創后達到治愈標準,治愈率為94.92%。56例接受膽道鏡清創治療的患者中,共發生并發癥4例。隨訪期間59例患者均未見病灶殘余。結論:膽道鏡清創治療胰腺炎胰周膿腫效果確切、安全可靠。應注重徹底引流、避免臟器損傷,以達到挽救生命、控制損傷、保證療效目的。
[關鍵詞] 膽道鏡;清創;胰腺炎;胰周膿腫
中圖分類號:R657.5 文獻標識碼:A 文章編號:2095-5200(2017)04-027-03
DOI:10.11876/mimt201704011
Experience of choledochoscopy debridement in treatment of pancreatitis complicated with peripancreatic abscess HAO Jincheng,LIANG Yajing,CAO Guangtao. (Department of general surgery,Rizhao City Hospital of traditional Chinese Medicine Rizhao 276800 China)
[Abstract] Objective: This study aimed to analyse the effect and safety of choledochoscopy debridement in the treatment of pancreatitis complicated with peripancreatic abscess, and to summarize the experience of treatment. Methods: From February 2012 to February 2016, 59 patients with pancreatitis complicated with peripancreatic abscess received ultrasound-guided percutaneous drainage, sinus dilation, and choledochoscopy debridement, and their drainage, debridement, treatment effect, complications occurrence and 1 year follow-up results were recorded. Results: 59 patients were all successfully treated with ultrasound-guided percutaneous drainage. 56 patients were cured after several debridement. The cure rate was 94.92%. Of the 56 patients who underwent cholera debridement, 4 had complications. There were no lesion residues in 59 patients during follow-up. Conclusions: Choledochoscopy debridement is effective and safe in the treatment of pancreatitis complicated with peripancreatic abscess. Thorough drainage and avoiding organ damage should be paid attention, in order to save lives, control damage and ensure the efficacy.
[Key words] choledochoscope; debridement; pancreatitis; peripancreatic abscess
胰腺炎后期大量炎性組織液滲出至胰腺周圍,引發的周圍組織壞死、感染及膿腫形成具有病變廣泛、持續時間長的特點,也是影響患者生存質量的主要原因[1]。對于胰腺炎胰周膿腫的治療,一直是困擾臨床的棘手問題,既往多采取外科手術或置管引流,但外科手術創傷較大且風險較高,而置管引流效果易受復雜胰周間隙影響,單純外科手術及內科保守治療均存在其局限性[2]。隨著影像學技術與微創技術的發展,越來越多的學者傾向于借助超聲引導建立引流并使用膽道鏡清創、沖洗膿腔,以期在控制損傷的同時確保治療的針對性[3]。我院于2012年2月~2016年2月,對59例患者實施膽道鏡清創治療,取得了滿意的效果,現將治療結果與經驗總結如下。
1 資料與方法
1.1 對象
59例胰腺炎胰周膿腫患者均參照中華醫學會消化病學分會胰腺疾病學組制定的胰腺炎胰周膿腫相關標準確診[4],經保守治療后無效中轉介入超聲聯合膽道鏡清創治療,且隨訪時間≥1年。59例患者中,男32例,女27例,年齡20~81歲,平均(47.52±6.81)歲,病程3~22 d,平均(6.05±1.83)d;膿腫部位:胰頭周圍23例,小網膜囊36例,其中53例伴胰尾脾門區膿腫。
1.2 治療方法
患者接受介入超聲穿刺引流、竇道擴張、膽道鏡清創治療,治療路徑:1)介入超聲穿刺引流:術前禁食12 h,于仰臥位行超聲掃描,明確病變部位、病變范圍、病灶外形及病灶深度,結合CT定位,選擇1~3個穿刺點,穿刺點選取標準[5]:①接近靶目標,避免穿刺距離過長;②確認安全穿刺路徑,避免傷及大血管或內臟器官;③穿刺層面超聲顯像清晰,未見盲區形成。常規消毒穿刺點周圍皮膚,2%利多卡因局部麻醉,于超聲引導下置入18G穿刺針,經針芯將0.035”引導絲置入預定部位,留置導絲,沿導絲走行置入8~12F引流管,外接引流管引流,引流物送病原菌培養及藥敏檢查,根據培養及檢查結果調整抗生素使用方案。2)竇道擴張(穿刺通道直徑>1.5 cm者無須實施竇道擴張):介入超聲穿刺引流1周且可見竇道形成后,行竇道擴張治療[6]。于超聲引導下,沿引流管置入引導絲,拔除引流管,使用10~24F筋膜擴張器套件將竇道逐步擴張至24F,插入外鞘,取出擴張管,于外鞘置入20~24F引流管,拔除外鞘,引流管外接引流袋。3)膽道鏡清創:竇道擴張1周后,拔除引流管,行病灶清創。于竇道置入膽道鏡,仔細觀察病灶內部狀態,使用活檢鉗、取石網將壞死組織、膿苔取出,而后以生理鹽水徹底灌洗膿腔,清創后重新連接引流管調整引流管位置,保證引流的充分性。根據患者病變情況選擇清創頻次,一般早期清創每周實施1~2次,若壞死組織、膿液明顯減少,可將清創頻次下調至每2周1次[7]。
治療效果以治愈拔管判定,并記錄治愈時間,治愈拔管標準[8]:1)胰周膿腫相關臨床癥狀全部消失,在不使用抗生素及激素的前提下,體溫、血象等指標恢復正常且持續≥1周;2)影像學檢查未見胰周病變;3)引流管未見分泌物流出,持續≥5 d;4)鏡檢未見病灶內異物,內壁可見新鮮肉芽組織生長;1年隨訪過程中主要觀察患者病灶殘余及遠期并發癥發生情況。
2 結果
2.1 療效及隨訪
59例患者介入超聲穿刺引流均成功實施,穿刺點數量:單管引流5例,雙管引流18例,三管引流36例;置管深度5~21 cm,平均(13.59±3.47)cm;清創次數2~10次,平均(5.52±0.87)次。
56例患者于數次清創后達到治愈標準,治愈率為94.92%,其余3例患者因膽道鏡置入困難,中轉開腹清創引流后治愈,無死亡患者。56例經膽道鏡清創治愈者治愈時間35~113 d,平均(72.54±11.83)d,多數患者在清創1~3次后臨床癥狀明顯改善,出院后定期門診治療,17例患者因病情較重住院至痊愈。56例接受膽道鏡清創治療的患者中,共發生并發癥4例,其中腸外瘺1例,創面滲血3例,均經對癥處理后痊愈。
隨訪期間59例患者均未見病灶殘余,其中3例患者存在進食后腹脹、食欲不振等遠期并發癥但正在輕微,經對癥處理后癥狀消失。
2.2 典型病例
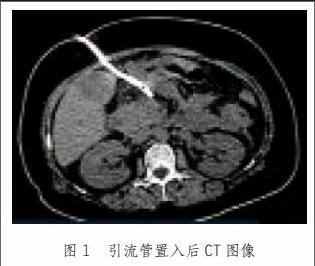
楊某,男,55歲,因“餐后急性腹痛3 h”入院,影像學檢查示:重癥急性胰腺炎合并胰周膿腫,膿腫位于小網膜囊且伴胰尾脾門區膿腫,常規超聲引導病灶穿刺引流失敗,改行介入超聲穿刺置管引流,于膽囊與消化道間隙微通道進針,置入引流管1根(圖1)。竇道擴張、膽道鏡清創治療均順利實施,首次清創時病灶創面可見明顯滲血,行局部電凝后成功止血。患者治愈時間為57 d,共計清創4次,隨訪1年未見病灶殘余與遠期并發癥。
3 討論
胰周膿腫是胰腺炎的嚴重并發癥之一,多數患者存在高熱、昏迷甚至胰性腦病等病變,需及時治療。傳統的胰周膿腫病灶外科處理方式為開腹病灶清除及膿腫引流,雖然可取得一定的效果,但開腹手術較大的創傷往往導致各類并發癥的出現,甚至直接造成患者死亡[9-10]。因此,近年來臨床愈發注重胰腺炎胰周膿腫治療方案的優化。
單純超聲引導下置管引流往往無法取得滿意的效果,其局限性在于引流管較細,易被壞死組織阻塞造成引流不暢,不僅難以達到充分引流,還可能因引流管阻塞引發新并發癥出現[11]。故清創操作是胰周膿腫治療過程中的重要環節,既往有學者將腹腔鏡用于胰周壞死組織的清創,取得了一定成效,但腹腔鏡清創術中易受角度影響,操作難度較高且清創能力有限[12]。加之胰周膿腫往往呈“山谷”樣特點,即谷內存在大量壞死組織,且單次清創無法完全清除谷底脫落組織,故多數患者往往需反復接受多次清創[13-14],
這也給清創治療的便捷性提出了更高的要求。
我中心在介入超聲穿刺置管引流的基礎上,將膽道鏡清創用于胰腺炎胰周膿腫的治療,結果表明,該法治愈率高達94.92%,且患者近遠期并發癥發生率較均低,安全性及治療效果均值得肯定,其優勢主要包括:1)1)操作簡便:膽道鏡清創全部操作均可在床旁進行,避免多次移動患者導致的不良事件風險[15];2)創傷較低:借助超聲引導穿刺,能夠最大限度保證穿刺位置的合理性與準確性,而膽道鏡清創全程在微創、直視下進行,基本可以避免臟器或大血管損傷,與此同時,膽道鏡下可直接電凝處理局部滲血,可有效控制持續出血;3)清創徹底:借助組織檢查鉗、取石網籃取出壞死組織后,通過膽道鏡可導入大量生理鹽水沖洗膿腔,徹底清除膿腔內殘留壞死組織碎片與淤積膿液,且上述操作均具有可重復性,能夠最大限度保障清創的徹底性[16];4)引流方便:在影像學引導下穿刺點可自由選擇,通過多部位置管,保證各區域膿腫的充分引流,同時,引流管的管徑一般能夠滿足膿腫引流需求,可取得較好的引流效果。
筆者結合多年臨床經驗及本研究診治,總結經驗如下:1)穿刺針的選擇:若穿刺通道直徑大于1.5 cm,可直接以粗套管針穿刺,此時不僅可滿足一次置管到位要求,還可跳過竇道擴張環節,為膽道鏡清創創造條件[17];2)保證引流的徹底性:超聲引導下引流應采取低位引流,每次更換引流管時,管道腹內端均需達到膿腔深部及清創最遠點,以擴大引流范圍、避免深部壞死組織碎片殘留;3)積極主動清創:胰周膿腫具有壞死組織多、病變范圍廣的特點,且膿腔為假性腔,故在注重徹底清創的同時,不應期望一次清創即清除全部壞死組織,盲目強行清創可能造成消化道瘺、大出血發生風險顯著上升[18]。因此,條件允許時建議實施多次清創,每次清創操作中注重周圍臟器組織與大血管的保護,盡可能降低清創操作對內環境的影響。
參 考 文 獻
[1] Ignee A, Jenssen C, Cui X W, et al. Intracavitary contrast-enhanced ultrasound in abscess drainage–feasibility and clinical value[J]. Scand J Gastroenterol, 2016, 51(1):41-47.
[2] Fujii-Lau L L, Levy M J. Endoscopic ultrasound-guided pancreatic duct drainage[J]. J Hepatobiliary Pancreat Sci, 2015, 22(1):51-57.
[3] Kawakami H, Itoi T, Sakamoto N. Endoscopic ultrasound-guided transluminal drainage for peripancreatic fluid collections: where are we now[J]. Gut Liver, 2014, 8(8):341-355.
[4] 中華醫學會消化病學分會胰腺疾病學組. 中國急性胰腺炎診治指南(2013年,上海)[J]. 中華消化雜志, 2013, 33(4):656-660.
[5] Cheng C H, Wu C H, Bair M J. Endoscopic-ultrasound-guided cystogastrostomy for walled-off necrosis of the pancreas[J]. Adv Dig Med, 2016, 3(4):207-208.
[6] Tilara A, Gerdes H, Allen P, et al. Endoscopic ultrasound-guided transmural drainage of postoperative pancreatic collections[J]. J Am Coll Surg, 2014, 218(1):33-40.
[7] 陽鳳, 彭燕. 重度急性胰腺炎并發胰腺膿腫的診治進展[J]. 胃腸病學, 2016, 21(3):190-192.
[8] Lee B U, Song T J, Lee S S, et al. Newly designed, fully covered metal stents for endoscopic ultrasound (EUS)-guided transmural drainage of peripancreatic fluid collections: a prospective randomized study[J]. Endoscopy, 2014, 46(12):1078-1084.
[9] 邱懿德, 黃偉俊, 蘇樹英, 等. 介入超聲置管引流聯合膽道鏡清創治療胰周膿腫[J]. 肝膽胰外科雜志, 2014, 26(6):495-497.
[10] Denzer U W, Sioulas A D, Abdulkarim M, et al. Endoscopic ultrasound-guided drainage of abdominal fluid collections after pancreatic surgery: Efficacy and long-term follow-up[J]. Z Gastroenterol, 2016, 54(09):1047-1053.
[11] 陽鳳, 徐勁, 羅旭娟, 等. 切開引流術和經皮穿刺置管引流術治療重癥急性胰腺炎并發胰腺膿腫的療效分析[J]. 臨床肝膽病雜志, 2016, 32(3):530-532.
[12] Fabbri C, Luigiano C, Lisotti A, et al. Endoscopic ultrasound-guided treatments: are we getting evidence based--a systematic review[J]. World J Gastroenterol, 2014, 20(26):8424-8448.
[13] 徐迅, 劉希勝, 俞同福, 等. CT引導結合Seldinger技術穿刺引流治療胰腺周圍深部膿腫[J]. 實用放射學雜志, 2016, 32(6):978-980.
[14] Mandai K, Uno K, Yasuda K. Endoscopic ultrasound-guided drainage of postoperative intra-abdominal abscesses[J]. World J Gastroenterol, 2015, 21(11):3402.
[15] Sharma V, Rana S S, Bhasin D K. Endoscopic ultrasound guided interventional procedures[J]. World J Gastroenterol Endosc, 2015, 7(6): 628.
[16] Chapman C G, Waxman I, Siddiqui U D. Endoscopic ultrasound (EUS)-guided pancreatic duct drainage: the basics of when and how to perform EUS-guided pancreatic duct interventions[J]. Clini Endosc, 2016, 49(2):161.
[17] Larson M M. Ultrasound Imaging of the Hepatobiliary System and Pancreas[J]. Vet Clin North Am Small Anim Pract, 2016, 46(3):453-480.
[18] Kobayashi S, Ikeura T, Takaoka M. Gastric wall abscess formation after endoscopic ultrasound-guided fine-needle aspiration of pancreatic cancer[J]. Dig Endosc, 2016, 28(2):220.
第一作者:郝金成,本科,主治醫師,研究方向:普外科臨床,Email:15206330725@139.com。

