植物三酰甘油合成相關基因研究進展
陶芬芳,邢 蔓,岳寧燕,鄔賢夢,2*
(1湖南農業大學農學院,長沙410128;2南方糧油作物協同創新中心,長沙410128)
植物三酰甘油合成相關基因研究進展
陶芬芳1,邢 蔓1,岳寧燕1,鄔賢夢1,2*
(1湖南農業大學農學院,長沙410128;2南方糧油作物協同創新中心,長沙410128)
三酰甘油是植物油脂的主要組成部分,在植物生長發育過程中發揮著重要作用。提高三酰甘油的含量并改良其品質,是油料作物育種的重要目標之一。系統介紹了與植物脂肪酸及三酰甘油合成相關基因的研究現狀,以期為今后進一步深入開展相關研究提供借鑒。
植物;三酰甘油;合成途徑;基因
三酰甘油(triacylglycerol,TAG)是由3分子長鏈脂肪酸和甘油在多種酶的催化下形成的脂肪分子,是植物體脂類的主要組成成分,摸清其合成過程中的關鍵酶及其控制基因,對于提高植物油脂的產量和改良其品質具有重要意義。隨著生物技術的發展,基因工程被廣泛運用到植物油脂品質改良中,并已取得了一系列的研究成果[1]。目前,提高植物油脂的含量主要有2條途徑:一是對脂肪酸合成途徑進行調控,即通過調節其合成過程中重要酶類的活性強弱來控制脂肪酸的積累;二是通過調控TAG的組裝過程來調節油脂的積累,在Kennedy途徑中,各酰基轉移酶依次將脂肪酸組裝到甘油上,從而形成三酰甘油,若增加各酰基轉移酶:甘油-3-磷酸酰基轉移酶(GPAT)、溶血磷脂酸酰基轉移酶(LPAT)以及二酰甘油酰基轉移酶(DGAT)的含量將有可能增強該途徑的代謝作用,有利于提高油脂的含量。
1 植物三酰甘油合成途徑
三酰甘油在內質網上由脂肪酸和甘油經多種酶催化而成。在Kennedy合成途徑中,酰基CoA的脂肪酸分別被GPAT、LPAT以及DGAT轉移到甘油上[2]。
最新研究還發現,除了Kennedy途徑中DGAT能催化二酰甘油合成三酰甘油外,還存在著其他兩條途徑。一條是磷脂二酰甘油酰基轉移酶(PDAT)將磷脂酰膽堿(PC)sn-2位的酰基轉移到二酰甘油(DAG)上,形成TAG和溶血磷脂酰膽堿[3]。另一條是Stobart等[4]1997年發現的,在未成熟紅花種子中,二酰甘油上的一個脂酰基被逆脂酰轉移酶(TA)轉移到另一個二酰甘油上,從而形成三酰甘油和一酰甘油,且這是一個可逆反應(圖1)。
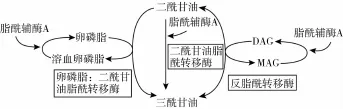
圖1 三酰甘油合成途徑[5]
在向日葵、擬南芥、蓖麻等高等植物體內,PDAT參與了二酰甘油到三酰甘油的合成過程[3]。在紅花中,則這兩條新的合成途徑同時參與了三酰甘油的合成[4]。這說明二酰甘油到三酰甘油的合成過程在不同的植物中是有差異的,三酰甘油的合成途徑具有多樣性。
2 與植物三酰甘油合成相關的基因
2.1 調控植物脂肪酸合成的主要基因
植物脂肪酸的合成是一個復雜的過程,在多酶復合體系催化下,乙酰輔酶A經一系列加載、縮合及還原反應釋放出不同鏈長(C8~C18)的脂肪酸,并與酰基載體蛋白(ACP)結合成脂肪酸合成酶復合體。從脂肪酸合成途徑來看,有許多基因影響著種子中油酸的合成,其中質體中主要有β-酮脂酰-ACP合成酶Ⅱ(KASⅡ)基因、硬脂酰脫氫酶(SAD)基因、ACP硫脂酶(FAT)基因、酰基輔酶A合成酶(ACS)基因,在內質網中主要有內質網油酸脫氫酶(FAD2)基因、脂肪酸延長酶1(FAE1)基因。
KASⅡ是將16∶0-ACP延長到18∶0-ACP的酰基蛋白合成過程中的關鍵酶,決定16碳脂肪酸/18碳脂肪酸的比率。很早就有關于油菜中KAS基因家族CDNA被分離和克隆的報道[6]。擬南芥中的研究表明,胚胎發育早期對于提高16∶0 ACP非常敏感,通過RNA干擾KASⅡ表達,胚胎發育后期16∶0 ACP水平高達53%,為野生型的7倍[7]。
SAD是編碼18∶0-ACP的Δ9脫氫的脫氫酶基因。利用實時熒光定量PCR檢測發現,GhSAD2在脂肪酸合成過程中起到了脫氫酶的作用[8]。通過抑制大豆SAD2基因的表達,其硬脂酸的含量增加[9]。
FAT是負責將ACP水解成相應的游離脂肪酸的重要水解酶。FAT A主要負責不飽和ACP的水解,FAT B主要負責飽和ACP的水解。Moreno-Pérez等[10]發現,敲除擬南芥中的FAT A基因后,成熟種子中油酸含量降低,三酰甘油的含量也有所減少。
ACS能將細胞體內脂肪酸轉化成相應的輔酶A硫脂底物,根據其底物的碳鏈長度可將其分為短鏈ACS、中鏈ACS和長鏈ACS,且該底物可參與細胞內脂肪酸碳鏈的延長、三脂酰甘油的合成及脂肪酸氧化降解等過程[11~13]。
FAD2基因是植物種子中控制油酸含量的關鍵基因,催化多不飽和脂肪酸生物合成的第一步反應[14,15]。通過RNAi沉默技術抑制fad2基因的表達,周曉嬰等[16]發現種子中多不飽和脂肪酸含量顯著降低,獲得了無篩選標記高油酸含量的轉基因油菜種質;陳葦等[17]也得到了油酸含量顯著提高且能穩定遺傳的后代材料。
FAE1基因位于內質網上,是第一個被發現的調控芥酸等超長鏈脂肪酸合成的關鍵基因[18]。周萬平[19]通過抑制FAE1基因,獲得了含油量為51.7%、芥酸含量為1.0%的轉基因油菜株系;而Mietkiewska等[20]將海甘藍的FAE1基因轉化到埃塞俄比亞芥中,獲得了芥酸含量增加40%的轉基因植株。
2.2 調控三酰甘油合成的主要基因
2.2.1 甘油-3-磷酸酰基轉移酶(GPAT)基因
在Kennedy合成途徑中,GPAT是催化三酰甘油生物合成的第一步,通過改變GPAT的含量可能調控該途徑的代謝作用,從而調控油脂的積累。現如今,在很多植物中均已克隆出GPAT,如擬南芥、玉米、豌豆等。其中擬南芥中共有9個GPAT,GPAT1在花粉發育過程中起到關鍵作用,但AtGPAT1的缺失,種子中油的含量無顯著變化[21];GPAT5與根和種皮中木栓質的合成有關[22];而GPAT4與GPAT8則與角質的形成有關[23];最近發現的GPAT9跟GPAT8一樣定位于內質網(ER)上,但與哺乳動物中的參與脂類合成的GPAT具有很高的同源性,可能在植物中扮演著相同的角色[24]。
2.2.2 溶血磷酸酰基轉移酶(LPAT)基因
位于細胞質中的LPAT在磷脂酸(PA)的合成過程中起重要作用,PA是TAG合成過程的關鍵中間體,可繼續進行脫磷酸反應合成TAG。該酶活性的提高可減輕脂類合成過程中的反饋抑制作用。
在擬南芥和油菜中轉入酵母的LPAT基因,均可獲得種子中長鏈脂肪酸的比例增加且含油量顯著提高的轉基因植株[25]。油菜的兩種LPAT基因(BAT1.13和BAT1.5)在擬南芥中過表達,可以增加擬南芥種子重量及其脂肪酸含量[26]。目前,在擬南芥、油菜、椰子等多種植物中均已將LPAT的同源基因分離克隆出來[27~29]。研究表明LPAT具有多種異構酶,且其生物學功能不同。以擬南芥為例,擬南芥中至少存在6種異構酶,其中質體中的LPAT1是胚胎發育所必須的[30]。LPAT2在多種組織中表達,定位于內質網上,對雌配子具有致死作用,LPAT3主要在花粉中表達[31]。LPAT4和LPAT5在體外檢測不到其活性,可能與心磷脂合成有關[32]。2009年新發現的一個由At4g24160編碼的可溶性LPAT,兼具三酰基甘油脂肪酶和磷脂酰膽堿水解酶活性,推測其在維持植物中脂質體內平衡具有重要作用[33]。棉花LPAT家族基因表達分析發現:棉花LPAT家族基因不僅與種子中油分合成有關,還參與棉纖維發育進程[34]。在油菜中克隆的LPAT基因包括BAT2[35](屬于油菜LPAT1的范疇),BAT1.5、BAT1.12、BAT1.13[36](屬于油菜LPAT2的范疇)及LPAT5[37,38],BnLPAT5為普遍表達型基因,但在根中的表達量是莖和胚中表達量的2倍,表明BnLPAT5在根的生長發育過程中扮演著一定的角色。其余油菜LPAT異構酶基因均未見報道。
2.2.3 二酰甘油酰基轉移酶(DGAT)基因
二酰甘油酰基轉移酶(DGAT)是Kennedy途徑中催化三酰甘油合成的最后一步,是該途徑中唯一的限速酶[39]。Gajdo?等利用缺陷型產油酵母Q4菌株(不能積累脂質和形成脂質體)研究發現,單一的二酰甘油酰基轉移酶的表達就能恢復TAG積累和LB的形成[40]。在植物中發現了4種不同類型的DGAT基因,分別為DGAT1、DGAT2、DGAT3[41,42]和WS/DGAT。DGAT1首先由Cases等[43]在小鼠中克隆出來,屬于酰基輔酶A膽固醇酰基轉移酶家族(ACAT),在擬南芥中僅有一個拷貝,且僅在動植物體中存在。DGAT2是Lardizabal等[44]從脂質體中克隆出來的,屬于DGAT2超家族,廣泛存在于真菌、藻類、植物和動物基因組中。張曉瓊等[45]對二倍體棉花和6種模式植物的DGAT2基因結構和蛋白保守基序進行生物信息學分析表明:被子植物的DGAT2蛋白受到嚴格的功能限制,具有高度相似的生物學功能。DGAT1和DGAT2蛋白均以微粒體的形式存在,并結合在內質網膜上;WS/DGAT是在乙酸鈣不動桿菌中鑒定出的一種雙功能酶,既有蠟酯合成功能又具DGAT功能;DGAT3基因定位于細胞質中,是Saha等[41]從發育中的花生子葉克隆出的,與DGAT1和DGAT2基因家族的相似性不足10%,與WS/DGAT基因家族相似性達13%,但僅具有高水平的DGAT活性,而無蠟酯合成功能,為區別于其他基因家族,被稱為DGAT3基因。
DGAT基因的器官表達具有特異性。大多數雙子葉植物例如大豆、斑鳩菊、油菜的DGAT1基因與擬南芥有著相似的表達模式,即在發育中的種子、花瓣以及花芽中高表達,而在葉和莖中卻是低表達[46~48]。旱金蓮DGAT1只在發育的種子中表達[49]。蓮座DGAT1基因隨著葉片的衰老其表達量不斷提高,直到第六周達最高水平[50]。蓖麻和桐樹的DGAT1在各器官中的表達水平幾乎沒有差異,但DGAT2的表達具有器官差異性,其中蓖麻DGAT2在種子中的表達量比葉中的高18倍,并在種子發育過程中瞬時特異性表達;桐樹DGAT2在發育的種子中表達量也極高,能顯著增加三酰甘油中桐油酸的積累[51,52]。在花生種子發育過程中,僅能在未成熟的種子中檢測到DGAT3的表達,而在種子發育后期以及根和葉中均沒有表達[41]。研究表明,DGAT不僅與組織中脂類積累有很大關系,還與植物種子萌發、幼苗發育和葉片衰老等過程中的脂類代謝有關[53,54]。唐桂英等[55]研究發現,AhDGAT3A作為一類二酰甘油酰基轉移酶,在花中具有高表達,利用染色體步移技術克隆得到5′上游調控區。通過在線軟件分析發現,該基因啟動子上游調控區包含多個調控花粉中表達的順式元件,所以該基因可能與花粉萌發過程中所需脂類的積累有很大關系。房逢立等[56]通過對花生DGAT3的生物信息學分析研究得出,花生DGAT3屬于非膜結合蛋白;李書霞等[57]通過對玉米DGAT基因家族的全基因組生物信息學分析也未預測到DGAT3的跨膜結構,可以推測DGAT3發揮功能時并不需要和膜相互作用,這相對于DGAT1、DGAT2來說,在基因工程中DGAT3更方便被利用來提高油料作物的產油量。尚未見其他關于油菜DGAT3的報道,但是Chi等[58]關于花生DGAT功能的研究為油菜分子育種提供了理論依據。
DGAT蛋白的底物選擇具有特異性,含特定成分的二酰甘油優先被某一植物DGAT選擇。含有長鏈脂肪酸的DAG在旱金蓮[59]和油菜[60]中會被DGAT1優先選擇為底物催化TAG的合成,而甘油二油酸酯優先被菠菜[61]DGAT1選擇為底物。雖然大量關于DGAT底物特異性與選擇性方面的研究得出的結論并不一致,但這也說明了DGAT基因的多樣性和重要性。因此關于植物體內DGAT底物選擇性和酰基輔酶A偏向性的研究,將有助于對調控植物種子中脂肪酸組成的分子基礎進行進一步的了解,為基因工程技術改良種子中脂肪酸組成提供理論指導。
2.2.4 磷脂二酰甘油脂酰轉移酶(PDAT)基因
磷脂二酰甘油脂酰轉移酶(PDAT)是不依賴于酰基輔酶A合成途徑中催化二酰甘油合成三酰甘油的最后一步。穆嬌[62]克隆得到的兩個白菜型油菜PDAT1雖然重復基因結構上存在差異,但它們均能提高葉片中TAG含量及葉片中不飽和脂肪酸的含量。不同物種中PDAT的功能具有一定的差異。在向日葵、蓖麻中PDAT利用某些含特殊酰基基團的PC作為底物,合成TAG[63]。酵母中,PDAT參與對數期TAG的合成[64]。海甘藍中,PDAT催化形成的TAGSn-3位沒有長鏈脂肪酸[65]。擬南芥功能型缺失突變體pdat1與PDAT1過表達植株中,TAG含量無明顯變化[66,67]。然而,當采用RNA干擾At-DGAT1(pdat1突變體)或PDAT1(dgat1突變體)后,種子中油脂含量減少70%~80%,且花粉管不能正常萌發,胚發育受阻[68]。
3 展望
油脂在人類的生產生活中扮演著重要的角色,對植物油脂的需求也越來越大,這極大地促進了分子生物學的研究。植物三酰甘油合成是一個極其復雜的過程,涉及大量的基因及其編碼的酶類,改變其中任何一個關鍵酶,都有可能改變植物含油量或者油酸成分,所以弄清合成過程中的每一個環節具有重大意義。近年來,利用基因工程技術手段改造植物油脂生物合成與代謝途徑中相關基因取得了較大的進展,三酰甘油合成途徑越來越清晰,與植物脂肪酸和三酰甘油合成相關的基因多態性位點不斷被發現,如在擬南芥中發現了9個GPAT基因[21~24],且GPAT1~9之間功能存在差異;丁檢等獲得了8個棉花LPAT家族基因的全序列和染色體定位信息[34],這為分子育種提高植物含油量、改善油脂品質奠定了基礎。
[1] 劉立俠,柳 青,許守民,等.基因工程在改善植物油營養價值中的應用[J].植物學報,2005,22(5):623-631.
[2] Chapman KD,Ohlrogge JB.Compartmentation of triacylglycerol accumulation in plants[J].Journal of Biological Chemistry,2012,287(4):2288-2294.
[3] Dahlqvist A,Stahl U,Lenman M,et al.Phospholipid:diacylglycerol acyltransferase:an enzyme that catalyzes the acyl-CoA-independent formation of triacylglycerol in yeast and plants[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6487-92.
[4] Stobart K,Mancha M,Lenman M,et al.Triacylglycerols are synthesised and utilized by transacylation reactions in microsomal preparations of developing safflower(Carthamus tinctorius L.)seeds[J].Planta,1997,203(1):58-66.
[5] Archer MD,Barber J.Molecular to Global Photosynthesis[M].World Scientific,2004.
[6] Carlsson AS,Labrie ST,Kinney AJ,et al.A KAS2 cDNA complements the phenotypes of the Arabidopsis fab1 mutant that differs in a single residue bordering the substrate binding pocket[J].Plant Journal,2002,29(6):761-770.
[7] Pidkowich MS,Nguyen HT,Heilmann I,et al.Modulating seed beta-ketoacyl-acyl carrier protein synthase II level converts the composition of a temperate seed oil to that of a palm-like tropical oil[J].Proc Natl Acad Sci USA,2007,104(11):4742-4747.
[8] 蔡 曼,李衛華,王 娟,等.陸地棉GhSAD2基因克隆與表達特征研究[J].西北植物學報,2016,36(9):1713-1720.
[9] Ping Z,Josephw B,Robertg U,etal.Mutations in a delta9 -Stearoyl-ACP-desaturase gene are associated with enhanced stearic acid levels in soybean seeds[J].CropScience,2008,48(6):2305-2313.
[10]Moreno-Pérez AJ,Venegas-Calerón M,Vaistij FE,et al.Reduced expression of FatA thioesterases in Arabidopsis affects the oil content and fatty acid composition of the seeds[J].Planta,2012,235(3):629-639.
[11]Steinberg SJ,Morgenthaler J,Heinzer AK,etal.Very long -chain acyl-CoA synthetases.Human“bubblegum”represents a new family of proteins capable of activating very long-chain fatty acids[J].Journal of Biological Chemistry,2000,275(45):35162-35169.
[12]Fulda M,Shockey J,Werber M,et al.Two long-chain acyl-CoA synthetases from Arabidopsis thaliana involved in peroxisomal fatty acidβ-oxidation[J].Plant,2002,32(1):93-103.
[13]Pei Z,Oey NA,Zuidervaart MM,et al.The acyl-CoA synthetase“bubblegum”(lipidosin):further characterization and role in neuronal fatty acid beta-oxidation[J].Journal of Biological Chemistry,2003,278(47):47070-47078.
[14]Okuley J,Lightner J,Feldmann K,et al.Arabidopsis FAD2 gene encodes the enzyme that is essential for polyunsaturated lipid synthesis[J].Plant Cell,1994,6(1):147-158.
[15]Zakim D,Herman RH.Regulation of fatty acid synthesis[J].Annual Review of Plant Biology,1969,48:109-136.
[16]周曉嬰,申愛娟,張潔夫,等.RNAi沉默轉基因油菜fad2基因表達的種子特異性分析[J].分子植物育種,2012,10(3):305-310.
[17]陳 葦,李勁峰,董云松,等.甘藍型油菜Fad2基因的RNA干擾及無篩選標記高油酸含量轉基因油菜新種質的獲得[J].植物生理與分子生物學學報,2006,32(6):665-671.
[18]Lessire R,Costagllioli P.Acyl-CoA elongase:genomic studies[J].Plant Molecular Biology,2004,21(2):237 -242.
[19]周萬平.油菜脂肪酸延伸酶基因表達抑制降低芥酸含量研究[D].杭州:浙江師范大學碩士學位論文,2010.
[20]Mietkiewska E,Brost JM,Giblin EM,et al.Cloning and functional characterization of the fatty acid elongase 1(FAE1)gene from high erucic Crambe abyssinica cv.Prophet[J].Plant Biotechnology Journal,2007,5(5):636-645.
[21]Zheng ZF,Xia Q.Arabidopsis AtGPAT1,a member of the membrane-bound glycerol-3-phosphate acyltransferase gene family,is essential for tapetum differentiation and male fertility[J].The Plant Cell,2003,15(8):1872 -1887.
[22]Beisson F,Li YG,Pollard M,et al.The acyltransferase GPAT5 is required for the synthesis of suberin in seed coat and root of Arabidopsis[J].Plant Cell,2007,19(1):351-368.
[23]Li Y,Beisson F,Koo AJ,et al.Identification of acyltransferases required for cutin biosynthesis and production of cutin with suberin-like monomers[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(46):18339-18344.
[24]Gidda SK,Shockey JM,Rothstein SJ,et al.Arabidopsis thaliana,GPAT8 and GPAT9 are localized to the ER and possess distinct ER retrieval signals:Functional divergence of the dilysine ER retrieval motif in plant cells[J].Plant Physiology and Biochem istry,2009,47(10):867-879.
[25]Zou J,Katavic V,Giblin EM,et al.Modification of seed oil content and acyl composition in the Brassicaceae by expression of a yeast sn-2 acyltransferase gene[J].The Plant Cell,1997,9(6):909-923.
[26]Maisonneuve S,Bessoule JJ,Lessire R,et al.Expression of rapeseed microsomal lysophosphatidic acid acyltransferase isozymes enhances seed oil content in Arabidopsis[J].Plant Physiology,2010,152(2):670-684.
[27]Kim HU,Li Y,Huang AHC.Ubiquitous and endoplasmic reticulum-located lysophosphatidyl acyltransferase,LPAT2,is essential for female but notmale gametophyte development in Arabidopsis[J].The Plant Cell,2005,17(4):1073-1089.
[28]Bourgis F,Kader JC,Barret P,et al.A plastidial lysophosphatidic acid acyltransferase from oilseed rape[J]. Plant Physiology,1999,120(3):913-922.
[29]Knutzon DS,Lardizabal KD.Cloning of a coconut endosperm cDNA encoding a 1-acyl-5rt-glycerol-3-phosphate acyltransferase that acceptsmedium-chainlength substrates[J].Plant Physiology,1995,109:999-1006.
[30]Kim HU,Huang AHC.Plastid lysophosphatidyl acyltransferase is essential for embryo development in Arabidopsis[J].Plant Physiology,2004,134(3):1206-1216.
[31]Kim HU,Li Y,Huang AH.Ubiquitous and endop lasmic reticulum-located lysophosphatidyl acyltransferase,LPAT2,is essential for female but notmale gametophyte development in Arabidopsis[J].Plant Cell,2005,17(4):1073-1089.
[32]Li-Beisson Y,Shorrosh B,Beisson F,et al.Acyl-lipidmetabolism[J].The Arabidopsis Book,2013,11:e0161.
[33]Ghosh AK,Chauhan N,Rajakumari S,et al.At4g24160,a soluble acyl-coenzyme A-dependent lysophosphatidic acid acyltransferase[J].Plant Physiology,2009,151(2):869-881.
[34]丁 檢,吳 雙,蔡彩平,等.棉花溶血磷酸酯酰轉移酶(LPAT)家族基因的發掘和表達分析[J].作物學報,2015,41(3):378-385.
[35]Bourgis F,Kader JC,Barret P,et al.A plastidial lysophosphatidic acid acyltransferase from oilseed rape[J]. Plant Physiology,1999,120(3):913-922.
[36]Maisonneuve S,Bessoule JJ,Lessire R,et al.Expression of rapeseed microsomal lysophosphatidic acid acyltransferase isozymes enhances seed oil content in Arabidopsis[J].Plant Physiology,2010,152(2):670-684.
[37]Chen SL,Huang JQ,Lei Y,et al.Identification and characterization of a gene encoding a putative lysophosphatidyl acyltransferase from Arachis hypogaea[J].Journal of Biosciences,2012,37(1):1029-1039.
[38]肖旦望,劉 聰,陳社員,等.甘藍型油菜LPAT5基因克隆與表達分析[J].華北農學報,2014,29(5):33-38.
[39]Settlage SB,Kwanyuen P,Wilson RF.Relation between diacylglycerol acyltransferase activity and oil concentration in soybean[J].Journal of the American Oil Chemists’Society,1998,75(7):775-781.
[40]Gajdo?P,Ledesma-Amaro R,Nicaud JM,et al.Overexpression of DGAT in Yarrowia lipolytica affects lipid body size,number,and distribution[J].Fems Yeast Research,2016,16(6):fow062.
[41]Saha S,Enugutti B,Rajakumari S,et al.Cytosolic triacylglycerol biosynthetic pathway in oilseeds.Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase[J].Plant Physiology,2006,141(4):1533-1543.
[42]Lehner R,Kuksis A.Biosynthesis of triacylglycerols[J]. Progress in Lipid Research,1996,35(2):169-201.
[43]Cases S,Smith SJ,Zheng YW,et al.Identification of a gene encoding an acyl CoA:diacylglycerol acyltransferase,a key enzyme in triacylglycerol synthesis[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(22):13018-13023.
[44]Lardizabal KD,Mai JT,Wagner NW,etal.DGAT2:A new diacylglycerol acyltransferase gene family:Purification,cloning and expression in insect cells of two polypeptides from Mortierella ramannniana with diacylglycerol acyltransferase activity[J].Journal of Biological Chemistry, 2001,276(42):38862-38869.
[45]張曉瓊,喬 琳,胡利宗,等.棉花與模式植物DGAT2基因的鑒定與分析[J].江蘇農業科學,2016,44(10):69-73.
[46]Hobbs DH,Lu C,Hills MJ.Cloning of a cDNA encoding diacylglycerol acyltransferase from Arabidopsis thaliana and its functional expression[J].FEBS Letters,1999,452(3):145-149.
[47]Wang HW,Zhang JS,Gai JY,etal.Cloning and comparative analysis of the gene encoding diacylglycerol acyltransferase from wild type and cultivated soybean[J]. Theoretical and Applied Genetics,2006,112(6):1086-1097.
[48]Yu K,Li R,Hatanaka T,et al.Cloning and functional analysis of two type 1 diacylglycerol acyltransferases from Vernonia galamensis[J].Phytochemistry,2008,69(5):1119-1127.
[49]Xu J,Francis T,Mietkiewska E,et al.Cloning and characterization of an acyl-CoA-dependent diacylglycerol acyltransferase 1(DGAT1)gene from Tropaeolum majus,and a study of the functionalmotifs of the DGAT protein using site-directedmutagenesis tomodify enzyme activity and oil content[J].Plant Biotechnology Journal,2008,6(8):799-818.
[50]Kaup MT,Froese CD,Thompson JE.A role for diacylglycerol acyltransferase during leaf senescence[J].Plant Physiology,2002,129(4):1616-1626.
[51]Shockey JM,Gidda SK,Chapital DC,et al.Tung tree DGAT1 and DGAT2 have nonredundant functions in triacylglycerol biosynthesis and are localized to different subdomains of the endoplasmic reticulum[J].Plant Cell,2006,18(9):2294-2313.
[52]Kroon JTM,Wei W,Simon WJ,et al.Identification and functional expression of a type2 acyl-CoA:diacylglycerol acyltransferase(DGAT2)in developing castor bean seedswhich has high homology to the major triglyceride biosynthetic enzyme of fungi and animals[J].Phytochemistry,2006,67(23):2541-2549.
[53]He X,Chen GQ,Lin JT,et al.Diacylglycerol acyltransferase activity and triacylglycerol synthesis in germ inating castor seed cotyledons[J].Lipids,2006,41(3):281-285.
[54]Zou J,Wei Y,Jako C,et al.The Arabidopsis thaliana TAG1 mutant has a mutation in a diacylglycerol acyltransferase gene[J].Plant Journal,1999,19(6):645-653.
[55]唐桂英,柳展基,徐平麗,等.花生二酰基甘油酰基轉移酶基因克隆與功能研究[J].西北植物學報,2013,33(5):857-863.
[56]房逢立,盧文珺.花生DGAT3的生物信息學分析[J].生物技術世界,2015(9):15-16.
[57]李書霞,劉 偉,李 威,等.玉米DGAT基因家族的全基因組分析[J].核農學報,2015,29(4):643-650.
[58]Chi X,Hu R,Zhang X,et al.Cloning and functional analysis of three diacylglycerol acyltransferase genes from peanut(Arachis hypogaea L.)[J].PloS One,2014,9(9):e105834.
[59]Lohden I,Frentzen M.Triacylglycerol biosynthesis in developing seeds of Tropaeolum majus L.and Limnanthes douglasii R.Br[J].Planta,1992,188(2):215-224.
[60]Taylor DC,Weber N,Barton DL,et al.Triacylglycerol bioassembly in microspore-derived embryos of Brassica napus L.cv Reston[J].Plant Physiology,1991,97(1):65-79.
[61]Martin B,Wilson R.Subcellular localization of TAG synthesis in spinach leaves[J].Lipids,1984,19(2):117-121.
[62]穆 姣.白菜型油菜PDAT1基因的克隆與功能分析[D].楊凌:西北農林科技大學碩士學位論文,2015.
[63]Dahlqvist A,Stahl U,Lenman M,et al.Phospholipid:diacylglycerol acyltransferase:an enzyme that catalyzes the acyl-CoA-independent formation of triacylglycerol in yeastand plants[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6487-6492.
[64]Oelkers P,Cromley D,Padamsee M,etal.The DGA1 gene determines a second triglyceride synthetic pathway in yeast[J].Journal of Biological Chemistry,2002,277(11):8877-8881.
[65]Furmanek T,Demski K,Bana W,et al.The utilization of the acyl-CoA and the involvement PDAT and DGAT in the biosynthesis of erucic acid-rich triacylglycerols in Crambe seed oil[J].Lipids,2014,49(4):327-333.
[66]Stahl U,Carlsson AS,Lenman M,etal.Cloning and functional characterization of a phospholipid:diacylglycerol acyltransferase from Arabidopsis[J].Plant Physiology,2004,135(3):1324-1335.
[67]Mhaske V,Beldjilali K,Ohlrogge J,et al.Isolation and characterization of an Arabidopsis thaliana,knockout line for phospholipid:diacylglycerol transacylase gene(At5g13640)[J].Plant Physiology and Biochemistry,2005,43(4):413-417.
[68]Jr HTH,Rogers MA.A comparative light and electronmicroscopic study ofmicrosporogenesi[J].Canadian Journal of Botany,1974,52(3):435-441.
Research Advances of Genes Related to Plant Triacylglycerol Synthesis
TAO Fen fang1,XING Man1,YUE Ningyan1,WU Xianmeng1,2*
(1 College of Agronomy,Hunan Agricultural University,Changsha,Hunan 410128;2 South Cooperative Innovation Center of Food Crops and Oil Crops,Changsha,Hunan 410128,China)
Triacylglycerol(TAG)is themain deposited lipids ofmost plants,and it plays an important role in the process of plant growth and development.To improve oil content and its quality is one of the important goals of oil crop breeding.The research progress about the genes related to plant fatty acid and triacylglycerol synthesis was systematically introduced,hoping to provide reference for the further research in the future.
p lant;TAG;synthetic path way;gene
Q789
A
1001-5280(2017)03-0330-07
10.16848/j.cnki.issn.1001-5280.2017.03.27
2017- 02- 05
陶芬芳(1991-),女,碩士研究生,Email:1453282987@qq.com。*通信作者,Email:wuxm126@163.com。
“十三·五”國家重點研發計劃項目(2016YFD0101300);湖南省省長專項(湘財農指[2016]114)。

