“點撥·自學·引導”教學模式在高中化學教學中的應用研究
徐煜
隨著新課程改革的深化,教師應該意識到“灌輸式”“題海式”教學模式已經無法滿足提高學生核心素養的教學目標要求,教師要明確學生在化學知識學習過程中的主體性地位,但是教師的主導性作用在教學中不能缺失.因此,筆者提出了“點撥·自學·引導”教學模式.
一、設置預習任務,引導學生自主預習
教師應該在課前點撥和引導學生自學.這種前置式的學習方式,能提高學生的課堂聽課效率.
例如,在講“化學計量在實驗中的應用”時,筆者在課前布置學生自主閱讀教材.為了提高學生閱讀、自學的效果,筆者提出了若干引導性問題.問題1:物質的量的定義是什么?符號和單位如何?問題2:阿伏加德羅常數是如何定義的?問題3:使用“mol”時,我們要注意些什么?問題4:N、NA與n之間存在著怎樣的關系?問題5:摩爾質量是如何定義的?與質量之間的轉化公式如何?
練一練:下列說法正確的是 ( ).
A.Na的摩爾質量為23 g
B.Na的摩爾質量為23
C.Na的摩爾質量為23 g/mol
D.Na的摩爾質量為23×10-3kg/mol
設計意圖:預習不等于讓學生自己看書.設置問題,可以引導學生有方向性地進行預習.課前“練一練”,可以檢測學生的預習狀態和自學效果.同時,通過預習環節的設計,能夠讓學生發現本節課的教學重點、難點,發現自己在預習過程中出現的困惑,生成新的問題,并帶到課堂上進行探究.
二、引導學生自主探究知識、發現規律
課前的問題設計是點撥和引導,在課堂教學過程中,依然需要教師的點撥和引導.只有這樣,學生的自主學習才能更有效.
例如,在講“化學計量在實驗中的應用”時,導入環節,筆者提出問題,引導學生進行思考,聯系自己課前預習的成果.導入環節的引導:在初中時知道,分子、原子、離子等我們肉眼看不見的粒子,可以構成客觀存在的、具有一定質量的物質.這說明,在我們肉眼看不見的粒子與物質的質量之間,必定存在著某種聯系.那么,聯系它們的橋梁是什么呢?學生有了預習的基礎,對概念有了一般性了解,知識教學可以轉換為自主學習與問題研討.
任務1:閱讀教材上的內容,理解物質的量在粒子數目上的大小關系.問題1:1mol粒子的數目大約是多少?問題2:12C原子特指什么結構的碳原子?在學生探究問題1和問題2后,教師稍加點撥,就可以和學生一起建立“阿伏加德羅常數”這個概念.在掌握了一定規律后,如何強化對阿伏加德羅常數的理解呢?可以進一步追加問題,用來檢驗學生自主學習的效果.實際上,設置問題進行檢驗的過程,也是教師引導和點撥的過程.追問1:1 mol H2所含氫氣分子的個數是多少?追問2:2 mol H2含有多少個氫原子?追問3:1 mol SO42-是多少個硫酸根離子?隨著上述學習任務的完成,新的疑問又來了.在使用“mol”時,我們要注意些什么?這也是學生在預習環節中就感到困惑的問題.此時可以引導學生進行討論.為了檢驗學生的理解程度,可以進一步設置問題進行檢測.
任務2:自主探究“摩爾質量”.首先,借助于問題,引導學生自主思考.問題1:初中所學某種原子的相對原子質量也是以碳-12原子為標準得出來的,它是怎樣定義的?問題2:假如一原子的質量為m1,碳-12原子的質量為mC,則該原子的相對原子質量A1怎樣表示?請用代數式表示出來.問題3:若另一種原子的質量為m2,則它的相對原子質量A2又該怎樣表示?問題4:A1比A2與m1、m2的關系是什么呢?請大家推導.問題5:一個C原子如何變成1molC原子,由此推出C的相對原子質量為多少?問題6:一個O原子如何變成1molO原子,由此推出O的相對原子質量為多少?問題7:一個Fe原子如何變成1molFe原子,由此推出Fe的相對原子質量為多少?其次,進一步研究,可以得到如下關系:m÷M×Mn×NA÷NAN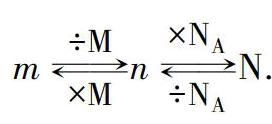
.最后,設置檢測題檢測學生的學習成果,引導學生對自己的學習過程進行客觀評價.檢測題1:71g Na2SO4 中含有Na+和SO42-物質的量各是多少?檢測題2:19.6g H2SO4 中氧元素的質量是多少?檢測題3:含有1.5×1022個分子,其質量為2.7g, 其相對分子質量為多少?檢測題4:0.2 mol KClO3中所含的Cl原子數與多少克CaCl2中所含的Cl-離子數相等?
總之,學生是學習的主體,但是學生的學習離不開教師的點撥和引導.教師的教學活動和問題設計都應該以提高學生素養為目的.

