成體肝祖細胞的研究進展
李 飛, 馬振增, 陸倫根
(上海交通大學附屬上海市第一人民醫院 消化科, 上海 200080)
成體肝祖細胞的研究進展
李 飛, 馬振增, 陸倫根
(上海交通大學附屬上海市第一人民醫院 消化科, 上海 200080)
肝臟具有極強的再生能力,在遭受急性損傷時,由成熟肝細胞增殖完成肝再生。但在肝臟遭受慢性損傷時,成熟肝細胞增殖能力受損或耗竭,肝祖細胞活化、增殖、分化,參與肝再生。介紹了肝祖細胞的特征及來源,在肝損傷后組織修復和肝癌發生中的作用,以及用于細胞移植治療肝臟疾病的潛能和面臨的問題。認為對于肝祖細胞的生物學特性及其在肝損傷和肝癌中的作用和發病機制的認識有利于肝病的治療。
肝祖細胞; 肝再生; 癌, 肝細胞; 干細胞移植; 綜述
肝祖細胞又稱為小肝細胞、膽管上皮樣細胞,是一類分布于成體肝臟,具有雙向分化潛能的異質性細胞。研究表明,肝祖細胞在肝再生、肝癌的發生發展中發揮重要作用,并有望用于慢性肝病的治療。本文回顧了近幾年的文獻,對肝祖細胞的特征、起源,及其在肝再生和肝癌以及細胞移植治療中的作用作一綜述。
1 肝祖細胞的特征和起源
肝祖細胞直徑約為10 μm,細胞核呈卵圓形,核大,胞漿少,因此小鼠肝祖細胞又稱為卵原細胞。肝祖細胞表達細胞角蛋白(cytokeratin CK)19、上皮細胞黏附分子、 卵圓細胞標志物6[1]、叉頭框蛋白A2[2]、Sox9[3],部分表達CD44、Alb和AFP[4]。有文獻[5-7]報道,肝祖細胞表面也表達造血干細胞標志物Thy-1、Lgr5 和c-kit。由于肝祖細胞可能具有多種起源,及其分化狀態的異質性,迄今為止,尚未找到一種相對特異的標志物來鑒定肝祖細胞。
關于肝祖細胞的起源,現存多種觀點。多數學者認為,肝祖細胞主要來自赫氏小管區和終末膽管。Paku等[8]用2-乙酰氨基芴(2-acetyailamifluorene, 2-AAF)刺激大鼠制備肝損傷模型后腹腔注射5-溴脫氧尿嘧啶核苷(bromodeoxyuridine,BrdU)標記肝臟增殖細胞發現,24 h內赫氏小管區細胞即進入細胞周期(圖1);免疫組化分析發現增殖細胞表達CK和AFP,二者均為肝祖細胞標志物,表明肝祖細胞起源于赫氏小管區。Kuwahara等[9]用對乙酰氨基酚(acetaminophen,APAP)制備小鼠肝損傷模型后,通過標記滯留細胞法發現在赫氏小管區出現CK和BrdU雙陽性細胞,該細胞體積小,細胞核呈類圓形,核漿比大,能長期存在并增殖和分化為肝細胞;定量分析表明肝祖細胞及其分化而來的肝細胞占增殖細胞總數的90%以上。Huch等[6]發現Lgr5+肝祖細胞基因表達譜與膽管上皮細胞基因表達譜類似,該結果也表明肝祖細胞可能來源于終末膽管細胞。
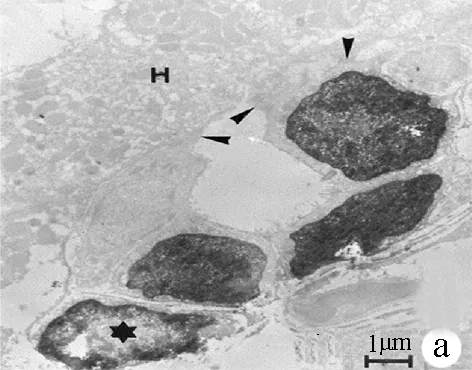
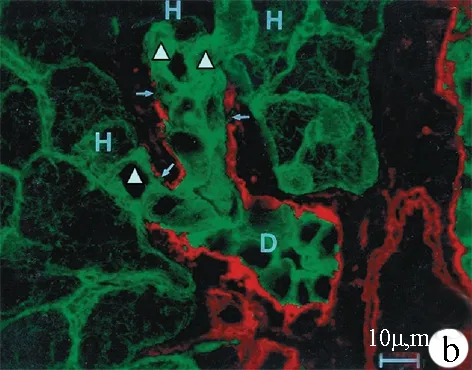
圖1 肝祖細胞起源 a:免疫電鏡顯示,2-AAF刺激大鼠2 d后肝臟赫氏小管區細胞開始增生。該赫氏小管由4個細胞構成,其中3個標記BrdU,進入有絲分裂期;圖中★顯示一BrdU細胞,緊鄰赫氏小管細胞;b:2-AAF刺激合并部分肝切除后3 d,終末膽管(D)部分基底膜(紅色,層黏連蛋白標記)連續性中斷(箭頭),并出現膽管樣細胞(綠色,角蛋白標記,▲),與肝細胞(H)直接接觸
但也有學者報道,肝祖細胞可起源于骨髓干細胞。有文獻[10]報道6例器官移植患者,2例骨髓移植系男性向女性患者提供骨髓,4例肝移植則為女性向男性提供肝臟,結果顯示所有受體肝組織均見Y染色體陽性(Y+)肝細胞,提示骨髓移植女患者Y+肝細胞源于男性供體,而肝移植男患者Y+肝細胞源于自身骨髓或血源性干細胞。Tsolaki等[11]報道骨髓干細胞能夠發育成肝祖細胞。該研究團隊將不同種系的雄性大鼠骨髓移植給經致死量放射線照射后的雌性受體鼠,再用肝毒性藥物和部分肝切除術制備肝損傷模型,誘導肝祖細胞的活化和增殖;再以供體鼠骨髓細胞的特異標志物(Y染色體、雙肽酶Ⅳ和L21-6抗原)為標記進行免疫組化染色,結果發現有部分肝祖細胞為供體骨髓細胞來源。
另有研究表明,肝祖細胞可由成熟肝細胞去分化而來。Braun等[12]將含有LacZ基因的成熟肝細胞移植給受體鼠3個月后給予肝毒性藥物和部分肝切除,在不同時間點對肝組織進行組化分析發現:19%的肝祖細胞來源于供體肝細胞;35%的肝實質細胞來源于供體肝細胞。該實驗表明肝祖細胞可以起源于成熟肝細胞的去分化。但是,Wang等[13]將Fah+/+肝細胞移植給Fah-/-小鼠使90%肝細胞呈Fah陽性,再經3~6周1,4-二氫-2,4,6-三甲基-3,5-吡啶二甲酸二乙酯飼料喂養,經檢測發現超過97%的肝祖細胞呈Fah陰性,該實驗表明肝祖細胞并非主要由成熟肝細胞去分化而來。由此可見,肝祖細胞具有多種起源,其中,赫氏小管區和終末膽管是其主要來源。而肝細胞和骨髓干細胞可能在特定病理條件下才去分化或轉分化為肝祖細胞,或者作為肝祖細胞起源的儲備。
2 肝祖細胞與肝再生
肝臟能通過兩種再生方式進行組織結構和功能的修復。在大部肝切除手術后,成熟肝細胞首先表現為體積增大,然后在20~24 h內即進入細胞周期開始有絲分裂恢復肝臟的體積和功能,大鼠完成該過程僅需2周,人類需要2個月[14-15]。但在遭受嚴重或慢性肝損傷時,成熟肝細胞的增殖能力被抑制或者耗竭,肝祖細胞活化、增殖,由門靜脈區向肝實質逐漸延伸,并分化為成熟的肝細胞和膽管細胞,實現對受損肝臟的修復。Sackett等[16]通過構建Foxl1-Cre;Rosa26 lacZ轉基因小鼠示蹤肝祖細胞在肝損傷后的增殖、分化過程,結果顯示肝祖細胞可分化為成熟的肝細胞和膽管細胞。
肝祖細胞增殖反應與肝損傷嚴重程度呈正相關,影響其活化、增殖、分化的因素較多,現已發現腫瘤細胞因子樣凋亡微弱誘導劑(TNF-like weak inducer of apoptosis ,TWEAK)、肝細胞生長因子(hepatocyte growth factor, HGF)、表皮細胞生長因子(epidermal growth factor,EGF)、成纖維細胞生長因子(fibroblast growth factor,FGF)7、IL-6、 TNFα等細胞因子或炎癥因子能調節其生物學行為[15]。TWEAK及其受體Fn14對肝祖細胞增殖的調節作用備受關注。在正常肝組織中,Fn14主要表達于膽管細胞和平滑肌細胞,而在慢性丙型肝炎、酒精性肝病、非酒精性脂肪性肝病和肝癌患者中,Fn14的表達升高,并主要表達在膽管細胞和膽管樣結構。動物實驗[17-19]表明,在小鼠肝臟過表達TWEAK后,受損肝組織中肝祖細胞增生反應更為明顯,而通過封閉型抗體阻斷TWEAK或在Fn14被敲除后,肝祖細胞增殖能力下降,表明TWEAK/Fn14通路能促進肝祖細胞介導的肝組織修復過程。Ishikawa等[20]通過構建肝組織特異HGF/c-Met(HGF/HGF受體)基因敲除鼠研究HGF/c-Met信號通路在肝祖細胞介導的肝再生中的作用。發現與對照組相比,HGF敲除鼠肝祖細胞的增殖能力下降了2/3,由其分化而來的肝細胞數量也顯著下降;同時肝祖細胞由門靜脈區向中央靜脈區遷移的距離明顯縮短;同時發現HGF敲除鼠肝祖細胞周圍巨噬細胞減少,造成其微環境改變。由此可見,HGF能影響小鼠肝祖細胞增殖、分化和遷移能力,并改變其微環境。FGF在組織發育和器官形成中發揮重要作用,同時參與調節上皮組織和器官的損傷修復。研究[21]發現,肝臟基質細胞表達多種FGF亞型,并且肝祖細胞表達FGF受體2b(FGFR2b) 。據此推測,FGF可能參與調節肝祖細胞的生物學行為。Takase等[22]發現,FGF-7在急性肝衰竭患者血清中顯著升高;在肝損傷小鼠肝祖細胞中也高表達,并與肝祖細胞的數量呈正相關。該研究團隊還發現FGF-7基因敲除小鼠肝損傷后肝祖細胞增殖反應顯著下降,模型小鼠的死亡率也明顯升高;再通過轉基因技術在FGF-7基因敲除小鼠肝組織恢復FGF-7的表達后,肝祖細胞數量增加,由肝祖細胞分化而來的肝細胞亦增加,血清生化指標獲得明顯改善,表明FGF-7在肝祖細胞介導的肝再生中發揮極其重要的作用。在肝祖細胞分化過程中,wnt/β-catenin和notch信號通路發揮相互平衡的作用。wnt/β-catenin促進肝細胞的分化;而notch信號通路促進膽管細胞的分化,并抑制肝細胞的分化[14]。
3 肝祖細胞與肝癌
肝祖細胞與肝癌的發生密切相關。研究表明28%~50%的肝細胞癌表達肝祖細胞標志物,如CK-19、AFP和CD133,因此有學者推測肝細胞癌可能起源于肝祖細胞。Roskams等[23]發現CK-19陽性的肝細胞癌患者瘤體更大,癌細胞侵襲性和轉移能力顯著增強,患者預后更差;免疫標記顯示癌細胞表達肝祖細胞標志物。Lee等[24]通過基因表達聚類分析發現,部分肝細胞癌患者癌組織與大鼠胚胎肝母細胞具有類似的基因表達譜,這類患者在性別、年齡和AFP表達情況等方面相似;與具有肝細胞基因表達譜的肝細胞癌患者相比,這類患者中位生存期明顯縮短,預后差,表明部分肝細胞癌可起源于肝祖細胞。Tang等[25]發現在再生肝臟中,每3×104~5×104個細胞中含有2~4個細胞表達干細胞標志物Stat3、Pgf5 和Nanog,同時表達分化前蛋白TGFβ受體Ⅱ和胚肝胞襯蛋白,但表達干細胞標志物的癌細胞卻低表達TGFβ受體Ⅱ和胚肝胞襯蛋白, TGFβ信號通路下調,IL-6/Stat3信號通路上調,提示肝細胞癌可能起源于IL-6/Stat3信號通路上調同時TGFβ信號通路下調的肝干/祖細胞。而在胎肝祖細胞中過表達β-catenin 信號分子26周后,92%的小鼠自發形成肝惡性腫瘤(肝細胞癌或肝母細胞瘤),其中肝細胞癌組織高表達β-catenin和成體肝祖細胞標志物AFP、Sox4、Sox9等原始細胞標志物[26]。上述實驗均提示肝細胞癌可以由肝祖細胞轉化所致,但其發病機制仍有待進一步探索。臨床病理研究表明,膽管細胞型肝癌亦可起源于肝祖細胞。Komuta等[27]對30例膽管細胞型肝癌患者的癌組織和癌旁肝祖細胞分析表明,部分膽管細胞型肝癌患者癌組織表達肝祖細胞標志物,基因表達譜也類似,其中19例患者癌組織中有導管樣腺體形成,這些特征都表明部分膽管細胞型肝癌可能起源于肝祖細胞。
4 肝祖細胞與細胞移植治療
目前肝移植是終末期肝病患者唯一有效的治療手段,但由于供體肝的缺乏,絕大多數患者無法獲得肝移植治療。肝祖細胞可以從患者自身獲得并在體外進行大量擴增,且能避免異體移植所帶來的免疫排斥,因此采用肝祖細胞進行移植有望成為肝移植外的另一治療方案[28]。Najimi等[29]將人肝祖細胞通過脾靜脈移植給重癥聯合免疫缺陷小鼠(SCID小鼠)10周后,在受體小鼠肝臟出現人肝細胞結節,免疫組化顯示該細胞表達Alb、前白蛋白和AFP。該實驗表明肝祖細胞在移植到受體小鼠肝臟后能增殖并分化為肝細胞,具備潛在的細胞移植治療肝臟疾病的可能。而Maerckx等[30]將人肝祖細胞移植給Gunn小鼠(該小鼠肝細胞缺乏葡萄糖醛酸轉移酶,致膽紅素結合障礙,引起血清中非結合膽紅素升高和黃疸),受體小鼠膽紅素代謝障礙能獲得一定程度好轉,表明肝祖細胞移植能改善肝臟的功能,進一步表明肝祖細胞移植能用于肝病治療。雖然如此,肝祖細胞移植治療進入臨床應用其安全性和可行性仍存在諸多問題:(1)安全性。肝祖細胞移植入體內后是否會定位到肝臟以外的器官而出現不可預知的副作用;另外,肝祖細胞是否會在受者體內形成腫瘤也有待進一步實驗證實[15];(2)標準化。肝祖細胞的異質性、肝臟疾病的多樣性、患者個體差異性使得肝祖細胞移植治療更為復雜,因此需要制訂相應的標準對其適應證和技術方案進行規范[31]。
5 小結
綜上, 肝祖細胞參與肝臟多種病理過程,對其活化、增殖和分化的機制研究及其影響因素的探索具有重要的理論意義。隨著研究的深入,肝祖細胞被發現在慢性肝損傷和原發性肝癌中發揮重要作用,其相關機制也被部分闡明,這對肝臟疾病的防治具有重要意義,有利于開發誘導肝祖細胞向肝細胞和膽管細胞分化以及預防或抑制原發性肝癌的藥物。
[1] YOON SM, GERASIMIDOU D, KUWAHARA R, et al. Epithelial cell adhesion molecule (EpCAM) marks hepatocytes newly derived from stem/progenitor cells in humans[J]. Hepatology, 2011, 53(3): 964-973.
[2] ROGLER CE, BEBAWEE R, MATARLO J, et al. Triple staining including FOXA2 identifies stem cell lineages undergoing hepatic and biliary differentiation in cirrhotic human liver[J]. J Histochem Cytochem, 2017, 65(1): 33-46.
[3] TARLOW BD, FINEGOLD MJ, GROMPE M. Clonal tracing of Sox9+ liver progenitors in mouse oval cell injury[J]. Hepatology, 2014, 60(1): 278-289.
[4] GIRI S, ACIKGOZ A, BADER A. Isolation and expansion of hepatic stem-like cells from a healthy rat liver and their efficient hepatic differentiation of under well-defined vivo hepatic like microenvironment in a multiwell bioreactor[J]. J Clin Exp Hepatol, 2015, 5(2): 107-122.
[5] KON J, ICHINOHE N, OOE H, et al. Thy1-positive cells have bipotential ability to differentiate into hepatocytes and biliary epithelial cells in galactosamine-induced rat liver regeneration[J]. Am J Pathol, 2009, 175(6): 2362-2371.
[6] HUCH M, DORRELL C, BOJ SF, et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration[J]. Nature, 2013, 494(7436): 247-250.
[7] HUCH M, DOLLé L. The plastic cellular states of liver cells: Are EpCAM and Lgr5 fit for purpose?[J]. Hepatology, 2016, 64(2): 652-662.
[8] PAKU S, JANOS S, NAGY P, et al. Origin and structural evolution of the early proliferation oval cells in rat liver[J]. Am J Pathol, 2001, 158(4): 1313-1323.
[9] KUWAHARA R, KOFMAN AV, LANDIS CS, et al. The hepatic stem cell niche: identification by label-retaining cell assay[J]. Hepatology, 2008, 47(6): 1994-2002.
[10] THEISE ND, NIMMAKAYALU M, GARDNER R, et al. Liver from bone marrow in humans[J]. Hepatology, 2000, 32(1): 11-16.
[11] TSOLAKI E, YANNAKI E. Stem cell-based regenerative opportunities for the liver: State of the art and beyond[J]. World J Gastroenterol, 2015, 21(43): 12334-12350.
[12] BRAUN KM and SANDGREN EP. Cellular origin of regernarating parenchyma in a mouse model of severe hepatic injury[J]. Am J Pathol, 2000, 157(2): 561-569.
[13] WANG X, FOSTER M, AL-DHALIMY M, et al. The origin and liver repopulating capacity of murine oval cells[J]. Proc Natl Acad Sci, 2003, 100(9): 11881-11888.
[14] ITOH T, MIYAJIMA A. Liver regeneration by stem/progenitor cells[J]. Hepatology, 2014, 59(4): 1617-1626.
[15] DARWICHE H, PETERSEN BE. Biology of the adult hepatic progenitor cell: “ghosts in the machine”[J]. Prog Mol Biol Transl Sci, 2010, 97(8): 229-249.
[16] SACKETT SD, LI Z, HURTT R, et al. Foxl1 is a marker of bipotential hepatic progenitor cells in mice[J]. Hepatology, 2009, 49(3): 920-929.
[17] JAKUBOWSKI A, AMBROSE C, PARR M, et al. TWEAK induces liver progenitor cell proliferation[J]. J Clin Invest, 2005, 115(9): 2330-2340.
[18] TIRNITZ-PARKER JE, VIEBAHN CS, JAKUBOWSKI A, et al. Tumor necrosis factor-like weak inducer of apoptosis is a mitogen for liver progenitor cells[J]. Hepatology, 2010, 52(1): 291-302.
[19] LU WY, BIRD TG, BOULTER L, et al. Hepatic progenitor cells of biliary origin with liver repopulation capacity[J]. Nat Cell Biol, 2015, 17(8): 971-983.
[20] ISHIKAWA T, FACTOR VM, MARQUARDT JU, et al. Hepatocyte growth factor/c-met signaling is required for stem-cell-mediated liver regeneration in mice[J]. Hepatology, 2012, 55(4): 1215-1226.
[21] STEILING H, WERNER S. Fibroblast growth factors key players in epithelial[J]. Curr Opin Biotechnol, 2003, 14(8): 533-547.
[22] TAKASE HM, ITOH T, INO S, et al. FGF7 is a functional niche signal required for stimulation of adult liver progenitor cells that support liver regeneration[J]. Genes Dev, 2012, 27(2): 169-181.[23] ROSKAMS T. Liver stem cells and their implication in hepatocellular and cholangiocarcinoma[J]. Oncogene, 2006, 25(27): 3818-3822.
[24] LEE JS, HEO J, LIBBRECHT L, et al. A novel prognostic subtype of human hepatocellular carcinoma derived from hepatic progenitor cells[J]. Nat Med, 2006, 12(4): 410-416.
[25] TANG Y, KITISIN K, JOGUNOORI W, et al. Progenitor/stem cells give rise to liver cancer due to aberrant TGF-beta and IL-6 signaling[J]. Proc Natl Acad Sci, 2008, 105(7): 2445-2450.
[26] MOKKAPATI S, NIOPEK K, HUANG L, et al. beta-catenin activation in a novel liver progenitor cell type is sufficient to cause hepatocellular carcinoma and hepatoblastoma[J]. Cancer Res, 2014, 74(16): 4515-4525.
[27] KOMUTA M, SPEE B, VANDER BORGHT S, et al. Clinicopathological study on cholangiolocellular carcinoma suggesting hepatic progenitor cell origin[J]. Hepatology, 2008, 47(5): 1544-1556.
[28] ZHAO L, HUANG DC, GONG MJ, et al. Repair effect of hepatic progenitor cell transplantation on acute liver failure mouse model induced by carbon tetrachloride[J].J Jilin Univ: Med Edit, 2015, 41(3): 464-469. (in Chinese) 趙麗, 黃道超, 龔夢嘉, 等. 肝祖細胞移植對四氯化碳誘導急性肝衰竭小鼠模型肝損傷的修復作用[J].吉林大學學報: 醫學版, 2015, 41(3): 464-469. (in Chinese)
[29] NAJIMI M, KHUU DN, LYSY PA, et al. Adult-derived human liver mesenchymal-like cells as a potential progenitor reservoir of hepatocytes?[J]. Cell Transplant, 2007, 16(10): 717-728.
[30] MAERCKX C, TONDREAU T, BERARDIS S, et al. Human liver stem/progenitor cells decreas serum bilirubin in hyperbilirubinemic Gunn rat[J]. World J Gastroenterology, 2014, 20(30): 10553-10563.
[31] SANCHO-BRU P, NAJIMI M, CARUSO M, et al. Stem and progenitor cells for liver repopulation: can we standardise the process from bench to bedside?[J]. Gut, 2009, 58(4): 594-603.
引證本文:LI F, MA ZZ, LU LG. Research advances in adult hepatic progenitor cells[J]. J Clin Hepatol, 2017, 33(5): 994-997. (in Chinese) 李飛, 馬振增, 陸倫根. 成體肝祖細胞的研究進展[J]. 臨床肝膽病雜志, 2017, 33(5): 994-997.
(本文編輯:朱 晶)
Research advances in adult hepatic progenitor cells
LIFei,MAZhenzeng,LULungen.
(DepartmentofGastroenterology,ShanghaiFirstPeople'sHospital,ShanghaiJiaoTongUniversity,Shanghai200080,China)
The liver has a strong regenerative capacity, and in case of acute injury, the proliferation of mature hepatocytes helps to complete liver regeneration. However, in case of chronic injury, the proliferative capacity of mature hepatocytes is damaged or exhausted, and the activation, proliferation, and differentiation of hepatic progenitor cells are involved in liver regeneration. This article summarizes the characteristics and origins of hepatic progenitor cells, their role in tissue repair after liver injury and development of liver cancer, and potentials and problems of cell transplantation in the treatment of liver diseases. It is pointed out that an understanding of the biological characteristics of hepatic progenitor cells, their role in liver injury and liver cancer, and related pathogenesis helps with the treatment of liver diseases.
hepatic progenitor cells; liver regeneration; carcinoma, hepatocellular; stem cell transplantation; review
10.3969/j.issn.1001-5256.2017.05.043
2016-10-14;
2017-01-08。
國家自然科學基金資助項目(81470858);2015年上海市領軍人才計劃(056)
李飛(1985-),男,博士,主要從事肝祖細胞在肝再生中的作用及其機制研究。
陸倫根,電子信箱: lungenlu1965@163.com。
R735.7
A
1001-5256(2017)05-0994-04

