磁共振動態磁敏感對比增強鑒別膠質瘤復發與放射性壞死的薈萃分析
韓芳,姚振威,張清,徐洋,伍建林*
磁共振動態磁敏感對比增強鑒別膠質瘤復發與放射性壞死的薈萃分析
韓芳1,姚振威2,張清1,徐洋1,伍建林1*
目的采用薈萃分析來評估磁共振動態磁敏感對比增強(dynamic susceptibility weighted contrast enhanced,DSC),鑒別膠質瘤復發與放射性壞死的診斷價值。材料與方法檢索PubMed、Embase、Web of Knowledge、Cochrane Libraries數據庫,檢索時間限定到2016年6月為止,語種限定為英文和中文,采用Meta-disc軟件進行數據分析。結果共有9篇文獻納入本研究,包括251例患者和270個病灶,DSC鑒別放射性壞死與腫瘤復發的敏感性、特異性、陽性似然比、陰性似然比分別為0.88(95%CI:0.82~0.93)、0.85(95%CI:0.77~0.91)、4.47(95%CI:2.9~6.91;I2=0,P<0.001)、0.15(95%CI:0.10~0.23;I2=0,P<0.001)。診斷優勢比(diagnostic odds ratio,DOR)為33(95%CI:15.86~68.66),DSC的受試者工作特征曲線下面積為0.94,Q*指數為0.873。DOR的I2=0,代表9篇研究之間異質性很小。結論本薈萃分析證明不僅磁共振相對腦血容量值可以有效鑒別膠質瘤復發與放射性壞死,而且DSC具有較高的敏感性和特異性。
磁共振成像;相對腦血容量;Meta分析;神經膠質瘤;放射性壞死
韓芳, 姚振威, 張清, 等. 磁共振動態磁敏感對比增強鑒別膠質瘤復發與放射性壞死的薈萃分析. 磁共振成像, 2017, 8(2): 143-148.
膠質瘤復發與放射性壞死的臨床、影像學表現存在一定程度的重疊,造成兩者不容易鑒別[1]。放療可以增加毛細血管的通透性以及改變血腦屏障,從而提高對比劑泄漏,使增加腫瘤的強化程度[2]。放射性壞死在病理上主要表現為纖維素樣壞死、血管擴張、正常腦血管內皮損傷[3]。相反,腫瘤復發表現為腫瘤細胞增殖和新生血管形成[4]。磁共振動態磁敏感對比增強(dynamic susceptibility weighted contrast enhanced,DSC)作為磁共振先進的成像技術,可以提供腫瘤組織的結構特性和血流動力學特點[5-6]。
多篇研究結果表明動態磁敏感對比增強成像技術在鑒別膠質瘤復發與放射性壞死的鑒別方面有 其 獨特的優勢[6-13]。高級別 膠質瘤患者相 對腦血容量(relative cerebral blood volume,rCBV)明顯升高,部分歸因于增加的新生血管;放射性壞死區rCBV減低可能與血管內皮細胞損傷和纖維素壞死相關[14-15]。雖然已有大量的研究應用DSC鑒別膠質瘤復發與放射性壞死,但是每個研究的敏感性和特異性均不同。因此,本研究采用薈萃分析方法來評估DSC鑒別膠質瘤復發與放射性壞死的準確性。
1 材料和方法
1.1 檢索范圍與策略
檢索PubMed、Embase、Web of Knowledge、Cochrane Libraries數據庫的相關文獻,檢索時間限定到2016年6月為止,檢索策略基于以下關鍵詞:“dynamic susceptibility contrast-enhanced magnetic resonance imaging” or “DSCE-MRI” or“relative cerebral blood volume” or “rCBV”;AND (“glioma” or “brain neoplasm”) AND (“tumor recurrence” or “radiation necrosis”) AND (“sensitivity” or “specificity” or “falsenegative” or “false-positive” or “diagnosis” or“accuracy”)。中文檢索式為膠質瘤、復發、放射性壞死,動態磁敏感對比增強灌注成像。研究對象為人類,語種選擇為中文和英文。組織病理診斷作為參考標準。 為減少漏查文獻,筆者也進行了手動檢索。
1.2 納入標準
(1)應用在所有患者進行DSC檢查;(2)至少6個月的臨床或影像學隨訪或者組織病理學分析作為參考標準;(3)研究患者數量至少10例;(4)真陽性、真陰性、假陽性、假陰性的數據可以在2×2列表中計算得出。(5)文獻類型為前瞻性、回顧性研究。(6)語種限定為中文和英文。
1.3 排除標準
(1)動物研究、病例報告、摘要、評論、書信、社論、評論、體外研究、會議論文;(2)沒有原始研究數據的文獻;(3)使用影像學其他指標來鑒別膠質瘤復發與放射性壞死;(4)公開發表的中文及英文以外的文獻;(5)尚未發表或重復發表的文獻等。
1.4 文獻質量評價與資料提取
參考納入標準與排除標準,由兩位評價員對文獻質量方法學進行評價,評價過程如遇不一致,則經第3位評價員共同商討解決。評價后,分別獨立提取相關數據,包括基本信息(平均年齡、性別、患者數)和成像技術特點(磁場強度、給藥劑量和速度、閾值,真陽性值、假陽性值、假陰性值和真陰性值)。
1.5 數據分析
所有數據分析均采用Meta-disc軟件進行數據合成和統計學分析。根據原始數據,分別計算得出DSC的敏感性、特異性、陽性似然比(positive likelihood ratio,PLR)、陰性似然比(negative likelihood ratio,NLR)、診斷比值比(diagnostic odds ratio,DOR)及其相應的95%可信區間(CI)以及匯總受試者工作特征曲線(receiver operating characteristic curve,ROC曲線),并得出納入文獻異質性的Q值和異質性指數(I2)。采用I2大小作為評價文獻異質性大小的指標,P<0.05認為差異有統計學意義,同時繪制森林圖。
2 結果
2.1 文獻檢索結果及納入文獻基本特征
從394篇初始文獻進行檢索,剔除重復文獻后剩余324篇。經過篩選標題及摘要,共有30篇文章被選中進行全文篩選。進行全文檢索時,排除了11篇綜述和4篇不相關的文章,6篇文章由于其沒有提供相關的診斷數據被刪除。最終只有9篇符合納入標準[6-12,16]。文獻篩選流程見圖1。
2.2 納入文獻基本特征
9篇有關DSC鑒別膠質瘤復發與放射性壞死研究的基本信息見表1。9項研究共納入251例患者和270個病灶;3篇研究采用1.5 T磁共振,5篇采用3.0 T磁共振,只有1篇研究同時采用1.5 T和3.0 T進行研究;只有5篇研究提供翻轉角度和層厚信息。MR掃描參數也均不相同,具體見表1。
2.3 數據分析結果
DSC鑒別膠質瘤復發與放射性壞死的敏感性和特異性分別為0.88(95%CI:0.82~0.93)和0.85(95%CI:0.77~0.91),見圖2。陽性似然比和陰性似然比分別是4.47(95% CI:2.90~6.91;I2=0;P<0.001)和0.15(95%CI:0.10~0.23; I2=0;P<0.001),見圖3。ROC曲線下面積是0.94,見圖4。I2=0.0%,代表9篇研究之間異質性很小,見圖5。Meta回歸分析結果顯示,無論是否提高注射速率(P=0.8)還是選擇不同的閾值(P=0.53),均不會影響診斷結果。同時本研究也證明樣本量與診斷效能無關。
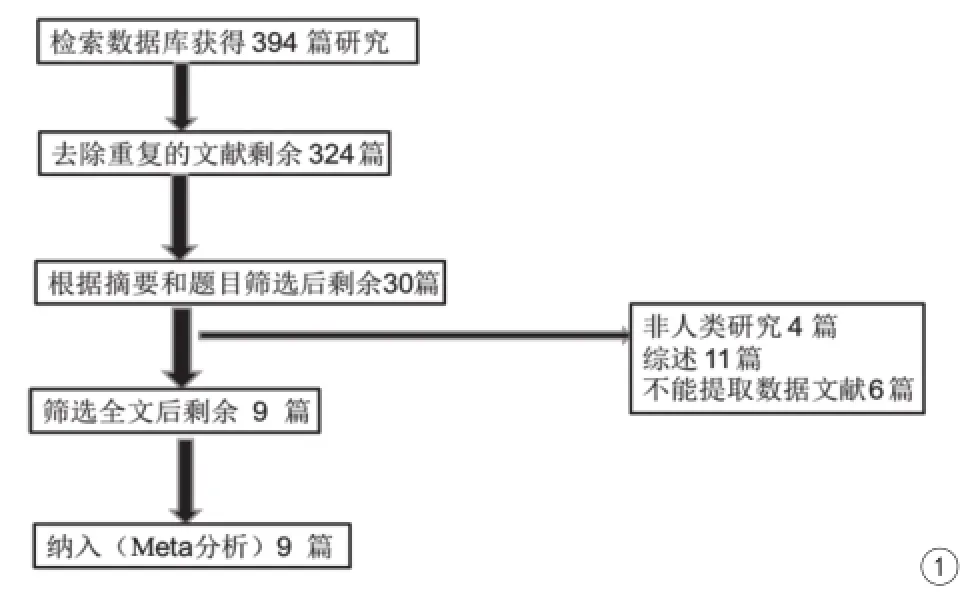
圖1 文獻篩選流程及結果Fig. 1 Literature screening process and results.
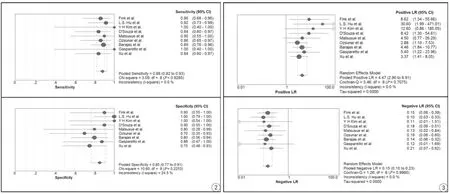
圖2 磁共振動態磁敏感對比增強鑒別膠質瘤復發與放射性壞死的敏感性和特異性的森林圖 圖3 磁共振動態磁敏感對比增強鑒別膠質瘤復發與放射性壞死的陽性似然比和陰性似然比森林圖Fig. 2 The pooled sensitivity and specificity's forest map of DSC for discriminating glioma recurrence and radiation necrosis. Fig. 3 The pooled PLR and NLR’s forest map of DSC for discriminating glioma recurrence and radiation necrosis.
3 討論
由于影像學表現非常相似[2],通常采用傳統的磁共振技術(T1WI和T2WI增強成像)不能準確地鑒別膠質瘤復發與放射性壞死。膠質瘤復發和放射性壞死通常表現為腫瘤樣病變,增強掃描表現為不均勻強化和不同程度的周圍水腫[17-18]。然而,病理方面膠質瘤復發與放射性壞死顯著不同,放射性壞死在病理上主要表現為纖維素樣壞死、血管擴張、正常腦血管內皮損傷。相反,腫瘤復發表現為腫瘤細胞增殖和新生血管形成[4],DSCMRI可以提供腫瘤的血流動力學信息。磁共振動態磁敏感對比增強成像能提供腫瘤新生血管形成和毛細血 管灌注的生 理信息[19]。rCBV 參數可以通過DSC-MR灌注成像獲得[13,20-22]。先前文獻報道,rCBV是DSC應用最廣泛的參數,它可以用于鑒別放射性壞死與膠質瘤復發。膠質瘤復發患者的病灶往往表現為rCBV平均值明顯升高,而放射性壞死表現為rCBV平均值明顯減低。不同的DSC研究在鑒別膠質瘤復發與放射性壞死方面的敏感性和差異性均有差異,所以筆者采用Meta分析的方法,希望通過增加樣本量,減少隨機誤差來評估DSC在鑒別膠質瘤復發與放射性壞死方面的檢驗效能。
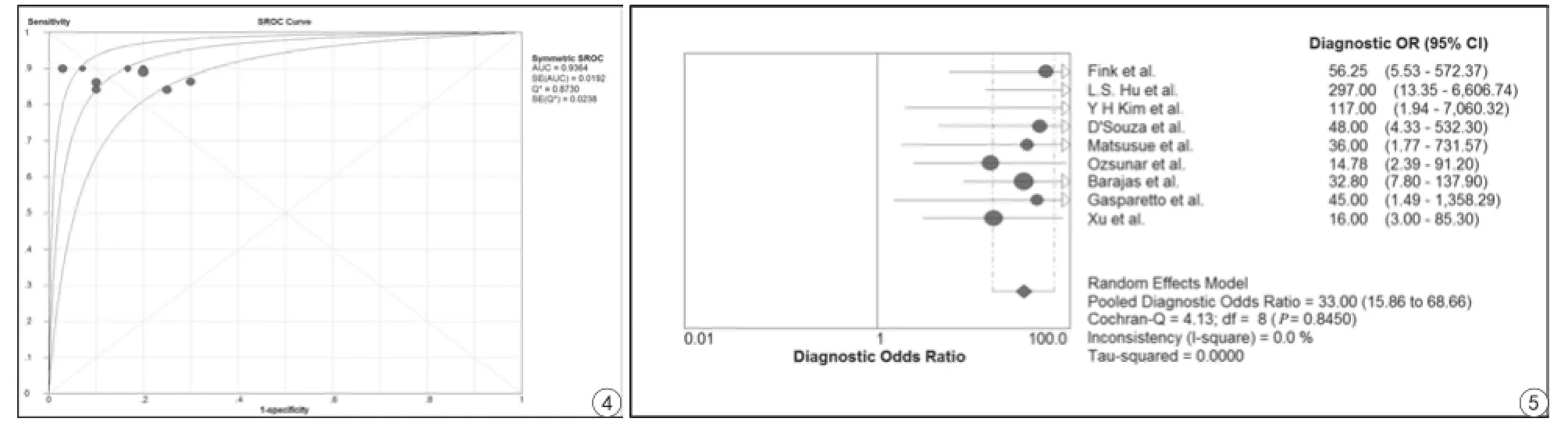
圖4 磁共振動態磁敏感對比增強鑒別膠質瘤復發與放射性壞死的ROC曲線 圖5 磁共振動態磁敏感對比增強鑒別膠質瘤復發與放射性壞死的DOR森林圖Fig. 4 The ROC curve of DSC for discriminating glioma recurrence and radiation necrosis. Fig. 5 The DOR’s forest map of DSC for discriminating glioma recurrence and radiation necrosis.
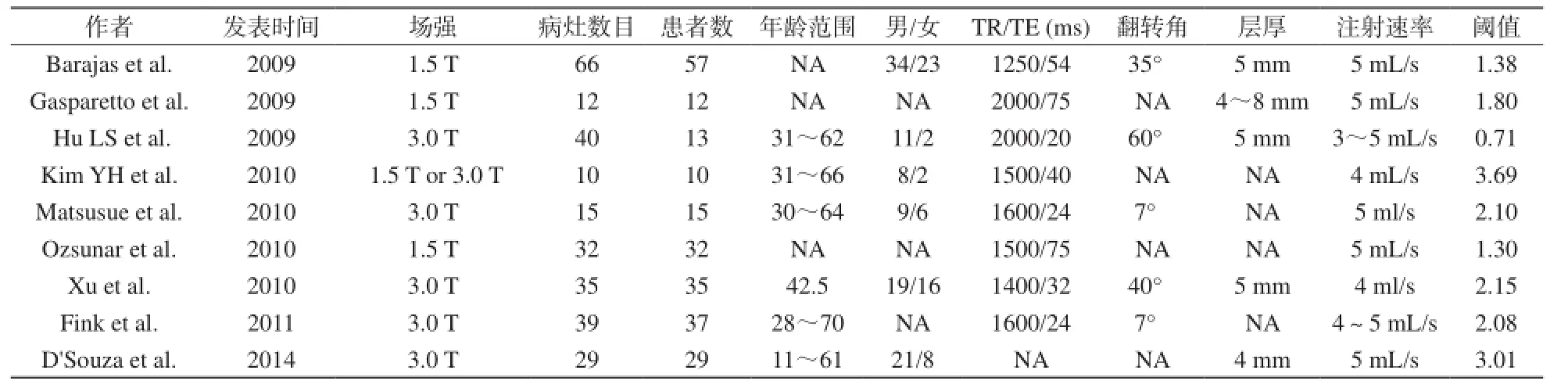
表1 Meta分析中納入研究的基本特征Tab.1 The basic characteristics of eligible studies in the Meta-analysis
DOR值范圍從0到無窮大,值越大,代表其診斷效能越大。本研究DOR值是33,說明DSC可以有助于鑒別膠質瘤復發與放射性壞死。然而DOR值在臨床上意義不是很大,PLR或者NLR更有助于臨床認可。如果PLR>10,或者NLR<0.1,說明診斷或排除某種疾病的可能性就顯著增加。本研究PLR=4.47和NLR=0.15,說明DSC在鑒別膠質瘤復發與放射性壞死有較高的診斷價值。此外,本研究中ROC曲線下面積是0.94。基于以上的研究結果表明DSC在鑒別診斷膠質瘤復發與放射性壞死方面效能很高。Barajas[12]報道稱膠質瘤復發患者的病灶rCBV平均值,最大值和最小值均明顯高于放射性壞死(P<0.01)。Sugahara[23]認為強化的病灶rCBV值高于2.6屬于膠質瘤復發。最近有研究認為通過采用DSC技術獲得rCBV,檢測腫瘤復發的敏感性和特異性分別為81%、76.9%[24],這些研究結果與筆者的基本一致[12,25]。
本研究還發現,不同的注射速率、不同的樣本量、不同的閾值均不會影響診斷結果。以上結果可能與筆者納入的研究較少有關,因此在未來的研究中,筆者希望納入更多質量較高的研究,分別對不同場強以及不同的序列進行亞組分析。目前尚沒有研究來探討DSC在鑒別膠質瘤復發與放射性壞死方面的診斷價值,筆者納入的研究語言沒有只限定為英文,不僅針對不同的注射速率、不同的樣本量、不同的閾值是否影響診斷效能進行了分析,而且本研究的異質性較低,結果可信度很高。
本研究也存在一定程度潛在的局限性。首先,樣本量小,目前的文獻中只有9個研究采用DSC鑒別膠質瘤復發和放射性壞死。其次,rCBV值受很多因素的影響,例如對比劑注射速率、磁共振成像后處理技術、掃描參數的不同,均有可能影響DSC灌注時間曲線。再次,由于信號強度與對比劑濃度缺乏線性關系,同時大血管或者骨組織也會影響rCBV的值[26]。一些理論和實驗證據表明rCBV可能與不同的治療措施相關,最新研究認為治療類型不同程度上會影響rCBV鑒別膠質瘤復發與放射性壞死[6]。 聯 合 化 療 和 放療可能導致的放射性壞死很早出現(在2~6個月)及同時增加其發病率[27]。另外,有研究認為rCBV值與腫瘤的級別密切相關[10,14,28]。對于以上的影響因素,希望以后可以增加樣本量對其進行亞組分析。大多數研究采用了兩種不同的參考標準(組織病理學檢查和或臨床隨訪及影像隨訪),從而導致對診斷敏感性和特異性的高估。最后,由于造成各研究的異質性主要歸因于不同閾值。本研究只選擇了中、英文相關文獻,可能存在一定的語種偏倚,盡管Deek's漏斗圖顯示本研究不存在發表偏倚,但一些潛在的不可避免的偏倚仍存在于研究中,希望今后可以選擇更多的臨床隨機對照研究來提高其診斷效能。
總之,目前的研究證明DSC在鑒別膠質瘤復發或放射性壞死方面顯示了較高的特異性和敏感性。在臨床上,通過采用DSC獲得rCBV來鑒別膠質瘤復發和放射性壞死。然而,本研究結果存在一定的局限性,希望在今后的研究中通過更多的前瞻性設計、大樣本的隨機對照試驗建立來進一步地驗證其診斷價值。
[References]
[1]Prager AJ, Martinez N, Beal K, et al. Diffusion and perfusion MRI to differentiate treatment-related changes including pseudoprogression from recurrent tumors in high-grade gliomas with histopathologic evidence. AJNR American journal of neuroradiology, 2015, 36(5): 877-885.
[2]Jr HDCL, Rodriguez I, Domingues RC, et al. Pseudoprogression and pseudoresponse: imaging challenges in the assessment of posttreatment glioma. AJNR American journal of neuroradiology, 2011, 32(11): 1978-1985.
[3]Hopewell JW, Calvo W, Jaenke R, et al. Microvasculature and radiation damage. Springer Berlin Heidelberg, 1993, 130: 1-16.
[4]Oh BC, Pagnini PG, Wang MY, et al. Stereotactic radiosurgery: adjacent tissue injury and response after high-dose single fraction radiation: Part I--Histology, imaging, and molecular events. Neurosurgery, 2007, 60(1): 31-44.
[5]Xu JL, Li YL, Lian JM, et al. Distinction between postoperative recurrent glioma and radiation injury using MR diffusion tensor imaging. Neuroradiology, 2010, 52 (12): 1193-1199.
[6]Gasparetto EL, Pawlak MA, Patel SH, et al. Posttreatment recurrence of malignant brain neoplasm: accuracy of relative cerebral blood volume fraction in discriminating low from high malignant histologic volume fraction. Radiology, 2009, 250(3): 887-896.
[7]Ozsunar Y, Mullins ME, Kwong K, et al. Glioma recurrence versus radiation necrosis? A pilot comparison of arterial spin-labeled, dynamic susceptibility contrast enhanced MRI, and FDG-PET imaging. Academic radiology, 2010, 17(3): 282-290.
[8]Matsusue E, Fink JR, Rockhill JK, et al. Distinction between glioma progression and post-radiation change by combined physiologic MR imaging. Neuroradiology, 2010, 52(4): 297-306.
[9]Fink JR, Carr RB, Matsusue E, et al. Comparison of 3.0 Tesla proton MR spectroscopy, MR perfusion and MR diffusion for distinguishing glioma recurrence from posttreatment effects. Journal of magnetic resonance imaging: JMRI, 2012, 35(1): 56-63.
[10]Kim YH, Oh SW, Lim YJ, et al. Differentiating radiation necrosis from tumor recurrence in high-grade gliomas: assessing the efficacy of 18F-FDG PET, 11C-methionine PET and perfusion MRI. Clinical neurology and neurosurgery, 2010, 112(9): 758-765.
[11]D'Souza MM, Sharma R, Jaimini A, et al. 11C-MET PET/CT and advanced MRI in the evaluation of tumor recurrence in high-grade gliomas. Clinical nuclear medicine, 2014, 39(9): 791-798.
[12]Barajas RF, Chang JS, Segal MR, et al. Differentiation of recurrent glioblastoma multiforme from radiation necrosis after external beam radiation therapy with dynamic susceptibility-weighted contrastenhanced perfusion MR imaging. Radiology, 2009, 253(2): 486-496.
[13]Hu LS, Baxter LC, Smith KA, et al. Relative cerebral blood volume values to differentiate high-grade glioma recurrence from posttreatment radiation effect: direct correlation between imageguided tissue histopathology and localized dynamic susceptibilityweighted contrast-enhanced perfusion MR imaging measurements. AJNR American journal of neuroradiology, 2009, 30(3): 552-558.
[14]Aronen HJ, Gazit IE, Louis DN, et al. Cerebral blood volume maps of gliomas: comparison with tumor grade and histologic findings. Radiology, 1994, 191(1): 41-51.
[15]Law M, Yang S, Wang H, et al. Glioma grading: sensitivity, specificity, and predictive values of perfusion MR imaging and proton MR spectroscopic imaging compared with conventional MR imaging. AJNR American journal of neuroradiology, 2003, 24(10): 1989-1998.
[16]Xu JL, Shi DP, Dou SW, et al. Distinction between postoperative recurrent glioma and delayed radiation injury using MR perfusion weighted imaging. Journal of medical imaging and radiation oncology, 2011, 55(6): 587-594.
[17]Tran DK, Jensen RL. Treatment-related brain tumor imaging changes: So-called "pseudoprogression" vs. tumor progression: Review and future research opportunities. Surgical neurology international, 2013, 4(Suppl 3): 129-135.
[18]Babu R, Huang PP, Epstein F, et al. Late radiation necrosis of the brain: case report. Journal of neuro-oncology, 1993, 17(1): 37-42.
[19]Kim HR, Kim SH, Lee JI, et al. Outcome of radiosurgery for recurrent malignant gliomas: assessment of treatment response usingrelative cerebral blood volume. Journal of neuro-oncology, 2015, 121(2): 311-318.
[20]Lupo JM, Cha S, Chang SM, et al. Dynamic susceptibility-weighted perfusion imaging of high-grade gliomas: characterization of spatial heterogeneity. AJNR American journal of neuroradiology, 2005, 26(6): 1446-1454.
[21]Cha S, Lupo JM, Chen MH, et al. Differentiation of glioblastoma multiforme and single brain metastasis by peak height and percentage of signal intensity recovery derived from dynamic susceptibilityweighted contrast-enhanced perfusion MR imaging. AJNR American journal of neuroradiology, 2007, 28(6): 1078-1084.
[22]Sadeghi N, D'Haene N, Decaestecker C, et al. Apparent diffusion coefficient and cerebral blood volume in brain gliomas: relation to tumor cell density and tumor microvessel density based on stereotactic biopsies. AJNR American journal of neuroradiology, 2008, 29(3): 476-482.
[23]Sugahara T, Korogi Y, Tomiguchi S, et al. Posttherapeutic intraaxial brain tumor: the value of perfusion-sensitive contrast-enhanced MR imaging for differentiating tumor recurrence from nonneoplastic contrast-enhancing tissue. AJNR American journal of neuroradiology, 2000, 21(5): 901-909.
[24]Seeger A, Braun C, Skardelly M, et al. Comparison of three different MR perfusion techniques and MR spectroscopy for multiparametric assessment in distinguishing recurrent high-grade gliomas from stable disease. Academic radiology, 2013, 20(12): 1557-1565.
[25]Di Costanzo A, Scarabino T, Trojsi F, et al. Recurrent glioblastoma multiforme versus radiation injury: a multiparametric 3.0 T MR approach. La Radiologia medica, 2014, 119(8): 616-624.
[26]Essig M, Shiroishi MS, Nguyen TB, et al. Perfusion MRI: the five most frequently asked technical questions. AJR American journal of roentgenology, 2013, 200(1): 24-34.
[27]Chamberlain MC, Glantz MJ, Chalmers L, et al. Early necrosis following concurrent Temodar and radiotherapy in patients with glioblastoma. Journal of neuro-oncology, 2007, 82(1): 81-83.
[28]Sugahara T, Korogi Y, Kochi M, et al. Correlation of MR imagingdetermined cerebral blood volume maps with histologic and angiographic determination of vascularity of gliomas. AJR American journal of roentgenology, 1998, 171(6): 1479-1486.
Role of dynamic susceptibility contrast-enhanced magnetic resonance imaging in differentiating glioma recurrence from radiation necrosis: a Meta-analysis
HAN Fang1, YAO Zhen-wei2, ZHANG Qing1, XU Yang1, WU Jian-lin1*
1Department of Radiology, Affiliated Zhongshan Hospital of Dalian University, Dalian 116001, China
2Department of Radiology, Huashan Hospital Affiliated to Fudan University, Shanghai 200040, China
*
Wu JL, E-mail: cjr.wujianlin@vip.163.com
Received 12 Dec 2016, Accepted 16 Jan 2017
Objectives:Using Meta-analysis to estimate the diagnostic value of differentiating glioma recurrence from radiation necrosis.Materials and Methods:We systematically searched PubMed, Embase, Web of Science, and Cochrane electronic databases to identify relevant published articles until June, 2016. English and Chinese language restrictions were applied. The data were analyzed by Meta-disc software.Results:Nine studies were used for general data pooling. The study included a total of 251 patients and 270 lesions. The pooled of DSC sensitivity was 0.89 (95% CI: 0.83, 0.93) and specificity was 0.88 (95% CI: 0.78, 0.94). Overall, positive likelihood ratio (PLR) was 4.47 (95% CI: 2.9-6.91; I2= 0, P<0.001) and negative likelihood ratio (NLR) was 0.15 (95%CI: 0. 1-0.23; I2=0, P<0.001). The pooled diagnostic odds ratio (DOR) was 33 (95% CI: 15.86, 68.66). The area under the receiver operating characteristic curve of DSC was 0.94 and the Q*index was 0.873. I2=0, representing a small heterogeneity between the 9 studies.Conclusion:Our Meta-analysis suggested that the rCBV values derived from DSC-MRI could be useful in differentiating glioma recurrence from radiation necrosis, DSC showed high sensitivity and specificity in differentiating glioma recurrence from radiation necrosis.
Magnetic resonance imaging; Relative cerebral blood volume; Metaanalysis; Glioma; Radiation necrosis
1.大連大學附屬中山醫院影像科,大連 116001
伍 建林,E-mail:cjr.wujianlin@ vip.163.com
2016-12-12
R445.2;R739.41
A
10.12015/issn.1674-8034.2017.02.014
2.復旦大學附屬華山醫院影像科,上海 200040
接受日期:2017-01-16