T1 mapping定量技術在慢性心肌缺血模型豬的初步應用研究
陳媛媛,方繼良*,柳桂勇,俞裕天,賀毅,洪洋,羅萍,榮培晶*
T1 mapping定量技術在慢性心肌缺血模型豬的初步應用研究
陳媛媛1,方繼良1*,柳桂勇1,俞裕天2,賀毅3,洪洋1,羅萍1,榮培晶2*
目的采用心臟磁共振T1 mapping技術,檢測正常豬及其在慢性心肌缺血造模后的心肌T1定量值,為心肌缺血診斷提供新的定量參數,探索T1 mapping技術分析判斷慢性心肌缺血或梗死的可行性。材料與方法選取13只中華小型豬,于冠脈左前降支近中段手術植入蛋白縮窄環,4 w后建成慢性心肌缺血小型豬模型;于造模前后行3.0 T心臟磁共振掃描(cardiac magnetic resonance,CMR),在短軸位的心尖、乳頭肌水平層面行T1 mapping掃描,分別在增強前后測定左心室壁感興趣區的心肌T1定量值,應用獨立樣本t檢驗,統計分析比較造模前后、增強前后T1值的差異。結果12只正常豬完成了造模前磁共振檢查,所有層面平掃心肌平均T1值為(1108.9±10.5) ms,其中心尖部心肌平均T1值為(1050.2±16.7) ms,乳頭肌層心肌平均T1值為(1139.7±54.4) ms,兩個層面平均T1值差異有統計學意義(P<0.05);11只慢性心肌缺血模型豬完成了CMR掃描,心尖部心肌平均T1值為(1210.6±94.2) ms,比造模前升高,差異有統計學意義(P<0.05);乳頭肌層心肌平均T1值為(1236.0±114.3) ms,與造模前差異無統計學意義(P>0.05);但是,乳頭肌層的前壁、前間壁與其造模前后的平均T1 mapping的差異具有統計學意義(P值分別為0.017和0.006)。結論左室前壁、前間壁為前降支供血區,T1 mapping在造模前后差異具有統計學意義(P<0.05),因此,此技術對診斷心肌慢性缺血或梗死有定量參考價值。
中華小型豬;心肌缺血;磁共振成像;T1 mapping技術;左心室前壁;模型,動物
Quantification of myocardial T1 mapping in minipig with chronic myocardial ischemia
陳 媛 媛 , 方 繼 良 , 柳桂 勇 , 等 . T1 mapping定量技術在慢性心肌缺血模型豬的初步應用研究. 磁共振成像, 2017, 8(2): 131-135.
心臟磁共振成像(cardiac magnetic resonance imaging,CMR)具有無創、分辨率高等優點,已成為評價心肌疾病的重要檢查手段。近年來,隨著磁共振技術的發展,CMR有了新的應用,如T1 mapping定量檢測心肌特性技術,可以通過定量的T1值和細胞外容積值的改變反映心肌損傷的程度,為心肌缺血或梗死等的診斷、治療提供新的參考值[1]。本研究以中華小型豬為研究對象,制備成慢性心肌缺血動物模型,在造模前后檢測心肌T1 mapping,對其定量值分析比較,為將來心肌慢性缺血或梗死研究提供新的參考指標。
1 材料與方法
1.1 研究對象
采用13只實驗用健康中華小型豬(體重18~30 kg),由北京通和生泰比較醫學研究所動物實驗中心提供(實驗動物許可證號為SCXK(京)2015-004)。所有動物均接受與實驗室動物使用和護理指南相一致的人文關懷。實驗程序通過了中國醫學科學院阜外醫院實驗動物委員會倫理委員會批準(倫理委員會批號:2013-1-25-973)。
實驗對象接受左前降支近中段交界區蛋白縮窄環植入術,造模術后7 d常規抗感染治療(青霉素480萬單位/d,肌肉注射),造模術后飼養4 w建成慢性心肌缺血小豬模型。
1.2 心臟磁共振掃描方法
使用西門子Skyra 3.0 T 磁共振儀掃描,將實驗豬麻醉后仰臥位固定在木架上,貼接心臟電極片,掃描方向為自頭向尾。(1)心臟定位掃描:進行二腔心,四腔心和短軸位(從心尖處開始掃描)的定位;(2)心臟電影:四腔心、兩腔心及短軸位,包括心底-心尖共8層;(3)T1 mapping:短軸位心尖-乳頭肌-心底共3層,兩腔心中央1層;(4)負荷心肌灌注:以ATP 0.15 mg/(min?kg)藥量泵入,同時行磁共振增強(對比劑使用方法見下文)行灌注掃描:左室短軸3層,四腔心1層;(5)高壓注射對比劑,采用馬根維顯1 ml/10kg,鹽水20 ml,5 ml/s的流率;ATP注入后3 min 30 s開始掃描;(6)延遲掃描:先追加對比劑,馬根維顯1 ml/10kg,2 ml/s流率,20 ml鹽水,復制心臟電影層面,延遲10 min后掃描;(7)T1 mapping:短軸位3層,兩腔心1層。
1.3 圖像測量分析
根據美國心臟病協會建議的心肌17節段分析法劃定感興趣區(region of interest,ROI),包含血池,不包含心外膜外脂肪組織。
把掃描后的T1定量圖傳入到西門子公司Syngo Via 后處理工作站上,采用ROI測量T1值,ROI大小平均為3~5 mm2。根據左室分段,選取各節段中央部分,無明顯偽影的位置測量。左心室局部變薄及有延遲強化作為梗死區的特征影像變化,左室壁負荷灌注局部缺損及運動減弱但無延遲強化評判為心肌缺血狀態。
1.4 統計學分析
使用SPSS 23.0軟件進行統計學分析,采用獨立樣本t檢驗或秩和檢驗,比較造模前后心尖與乳頭肌層的心肌平掃T1平均值;比較造模前后乳頭肌層心肌各段:前壁、前間壁、下間壁、側壁、下壁的平掃T1平均值;比較造模后缺血及梗死區與正常區的心肌平掃T1平均值;統計增強后乳頭肌層心肌各段T1平均值(均數±標準差)。采用95%可信區間,P<0.05認為差異有統計學意義。
2 結果
2.1 T1 mapping合格圖像統計
13只中華小型豬中,1只未參與實驗即死亡,1只造模術后死亡,其余完成實驗掃描,部分掃描圖像結果有偽影存在,影響數據提取,去除,最后得到11只豬的資料,合格層面39層,平掃造模前心尖為3個層面,乳頭肌為7個層面,平掃造模后心尖為6個層面,乳頭肌為7個層面;增強掃描造模前心尖為4個層面,乳頭肌為8個層面,增強掃描造模后心尖為2個層面,乳頭肌為2個層面。
2.2 T1定量值統計分析
2.2.1 平掃造模前后心尖層與乳頭肌層T1值
12只正常豬造模前所有層面平掃心肌平均T1值為(1108.9±10.5) ms。正常豬與慢性心肌缺血模型豬心尖層初始T1值(即造模前后T1值)差異有統計學意義(P<0.05),造模后T1值升高(P=0.008);乳頭肌層初始T1值造模前后無統計學差異(P>0.05)。造模前心尖與乳頭肌層心肌T1值差異有統計學意義(P<0.05),乳頭肌層T1值高于心尖層,造模后兩個層面差異無統計學意義(P=0.964)。見表1。
2.2.2 造模前后乳頭肌層心肌各段平掃T1值
造模后乳頭肌層心肌前壁、前間壁T1值升高,造模前后差異有統計學意義(P<0.05)。下間壁、側壁、下壁造模前、后心肌T1值相對穩定,差異無統計學意義(P>0.05)。見表2。
2.2.3 造模后心肌各段缺血與梗死區、正常區T1值
10只小豬(1只無數據)共33個T1值測量點,觀察左心室各節段缺血及梗死征象,發現缺血及梗死區T1值顯著高于正常區,差異有統計學意義(P<0.05)。見表3、圖1。

表1 造模前后心尖和乳頭肌兩個層面的總平均初始T1值和95%置信區間Tab.1 T1 values of the apex and the papillary muscle before and after modeling
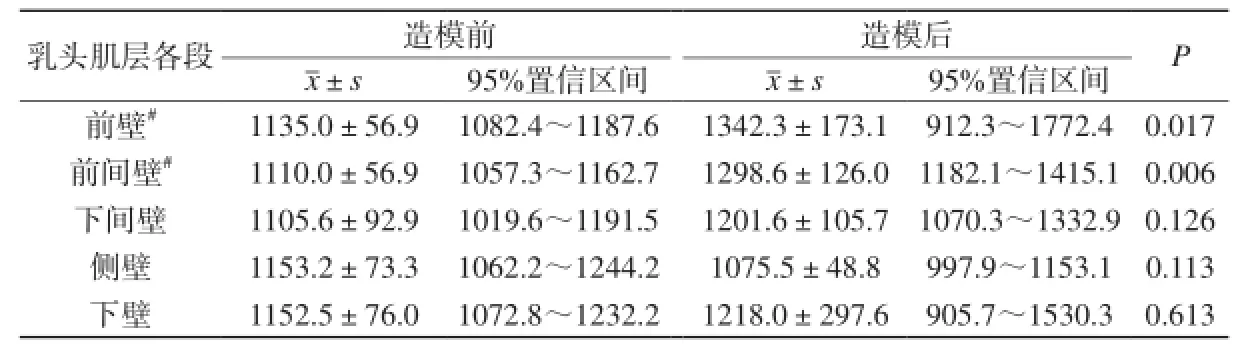
表2 造模前后乳頭肌層心肌各段平均初始T1值及95%置信區間Tab.2 T1 values of the different segments at the slice of papillary muscle before and after modeling
2.2.4 乳頭肌層面各段心肌增強后T1值
正常豬增強后乳頭肌層心肌各段平均T1值從前壁到下壁依次為(658.1±114.3) ms、(664.0± 129.4) ms、(642.7±113.2) ms、(677.8±125.1) ms、(613.0±51.2) ms,血池平均T1值為(420.1± 128.4) ms。具體見圖2。造模后增強因小豬運動幅度大等原因,未進行T1 mapping掃描。
3 討論
本研究總結了中華小型豬慢性心肌缺血模型造模前后掃描所見的心肌多個節段T1定量值。研究表明,無對比劑T1 mapping可以較準確地識別急性心肌梗死時受損心肌的水腫范圍,其測得的T1值增高與細胞水腫和蛋白沉淀有關[2]。
3.1 與既往豬MR T1 mapping的異同
豬心臟解剖結構及冠脈供血等與人類較為接近[3],因此 常 選用豬作為心 臟 缺血模型動物 。 Hood 等[4]研 究 發 現 正 常 約 克 豬 心 肌 平 掃平均T1值為(960±96) ms,比筆者的研究結果(1050.2~1139.4 ms)較低,可能與研究實驗條件、磁共振儀[他們使用的是1.5 T (Signa,GE Healthcare),筆者用的是3.0 T (Skyra,Siemens)]、小豬品種不同等因素有關。
3.2 造模后小豬心肌T1值升高原因分析
心肌急性損傷時,出現局部缺血或炎癥,在周圍形成可逆性間質水腫,使T1和T2值升高。釓劑延遲增強(Late gadolinium enhancement,LGE)可反映心肌炎性損傷的部位和程度[5]。近年新出現的T1 mapping技術,不僅能檢測水腫的程度,而且在每一個像素精確量化弛豫時間,達到局部定量檢測,沒有必要參考對比正常心肌或骨骼肌。相比于T2技術,它比較穩定,較少依賴于執行掃描和人員的主觀評測[6]。
本實驗中小型豬造模后T1值升高,尤其是在乳頭肌層的前壁、前間壁,其前后差異有統計學意義,其原因是筆者在左冠狀動脈前降支上中段行植入蛋白縮窄環手術,導致前壁、前間壁的心肌缺血及梗死[7],可見相應缺血或梗死區的心肌壁變薄,MR可見延遲強化。非缺血或梗死區造模前后心肌T1值差異無統計學意義,也可證明了T1 mapping技術的穩定性。
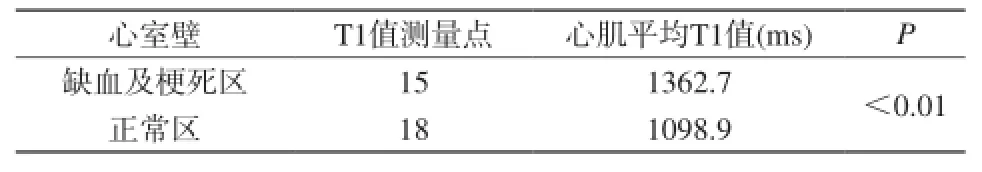
表3 造模后心室壁缺血或梗死區與正常區T1值Tab.3 The comparsion between infarction and non-infarction at T1 result
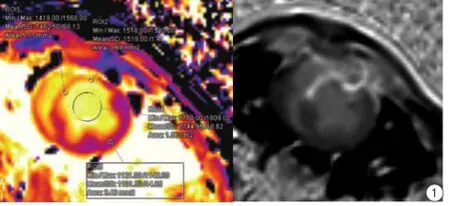
圖1 11號豬乳頭肌層面造模后T1 mapping圖及其延遲強化圖。ROI 1:前間壁,缺血心肌;ROI2:前壁,缺血心肌,前壁和前間壁延遲強化;ROI4:血池;ROI5:側后壁,正常心肌Fig. 1 T1 mapping and LGE at the papillary muscle of the 11thminipig after modeling. ROI 1: The anteroseptal ischemic myocardium; ROI 2: The antetheca ischemic myocardium, the myocardial late gadolinium enhancement (LGE) at the antetheca and anteroseptal myocardium; ROI4: Blood pool; ROI5: The posterior wall of normal myocardium.
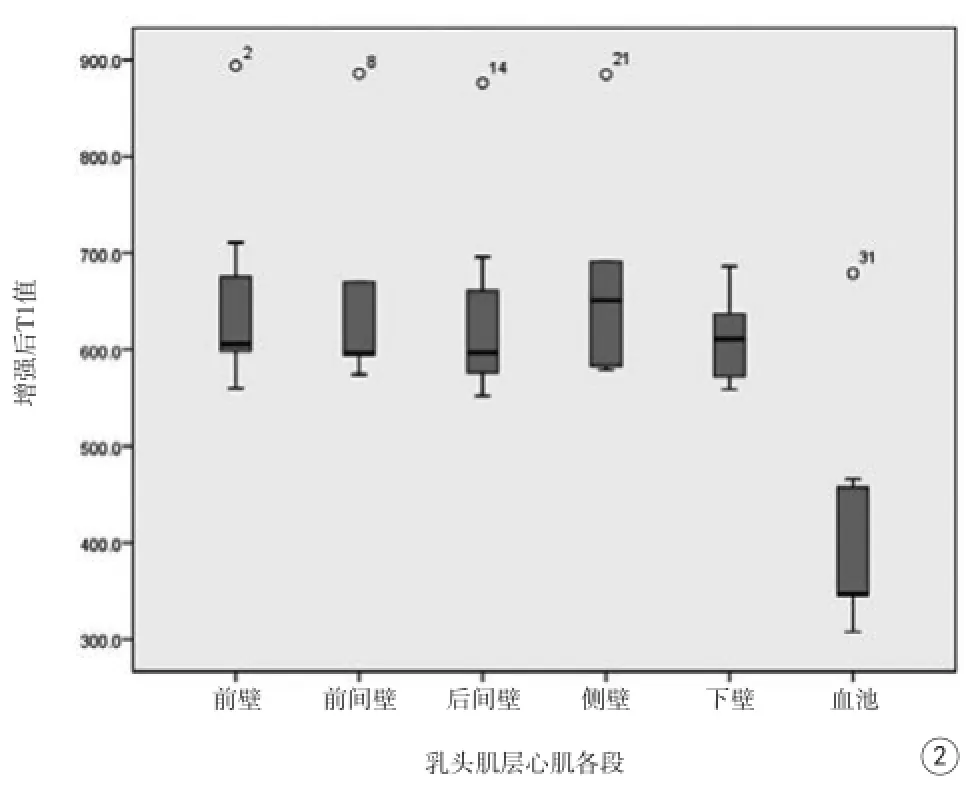
圖2 正常豬增強后乳頭肌層心肌各段T1值Fig. 2 T1 result of the different segments at the slices of papillary muscle in enhanced minipig.
3.3 正常人體心肌T1值研究
有較多研究健康人左室心肌T1值,Goebel等[8]采用1.5 T MR研究顯示正常人心肌平均T1值為(955±34) ms。劉明熙等[9]采用3.0 T MR測得左室心肌從基底部到心尖部的平均初始T1值分別為(717.6±100.6) ms、(773.9±101.2) ms和(955.4±191.1) ms,而Florian等[10]采用3.0 T MR測得T1值依次為1157.1 ms、1158.7 ms、1180.6 ms。從這些研究來看,雖然有差異,但均值多為950~1200 ms,與筆者的小豬結果相似。但從基底部到心尖部的正常人研究表明平掃值逐漸升高,而筆者的小豬研究結果顯示乳頭肌層稍高于心尖部,可能與受試者(人與豬)的心肌差異有關。
本研究顯示,增強后心肌T1值較增強前顯著降低,與既往研究[10-12]結果一致。
3.4 心肌梗死的心肌T1值研究
Avinash等[13]使用3.0 T磁共振儀掃描ST段抬高型心肌梗死13例和非ST段抬高型心肌梗死患者12例,結果顯示ST段抬高型心肌梗死患者病灶區心肌平均T1值為1517 ms,遠離病灶區心肌平均T1值為1214 ms;非ST段抬高型心肌梗死患者病灶區心肌平均T1值為1549 ms,遠離病灶區心肌平均T1值為1262 ms。
其病灶區數值較本研究造模后T1值(1362.7 ms)略高,可能與該研究選用的患者平均患病時間為13.6年、本研究在豬身上檢測、在造模術后4 w即進行磁共振掃描有關,且本研究模型豬心肌病變除梗死外尚有缺血改變。
3.5 T1 mapping技術對診斷心肌缺血或梗死的意義
此類研究實驗條件(掃描儀器、掃描參數、感興趣區、受試者一般情況)等不盡相同。心肌T1值的測量尚沒有統一標準,目前不能明確正常人T1值的95%參考范圍。
筆者的研究結果顯示模型豬心肌缺血或梗死后心肌T1值明顯增高,與CMR延遲強化顯示部位近似,借鑒動物研究結果,對臨床定量診斷心肌缺血及梗死有一定的參考意義。對慢性心肌梗死進行定量檢測是評估左心室功能損傷程度和發展到心力衰竭的一個重要參數[14]。T1 mapping技術可以使心肌纖維瘢痕在不使用含釓造影劑的情況下得以檢測,其精確度已經在實驗和臨床中被證實[15]。延遲強化為診斷慢性心肌缺血的黃金標準,但T1 mapping技術表現出高精確度[12]。
本研究結果表明,在中華小型豬慢性心肌缺血模型中,T1 mapping技術可定量評價心肌缺血或梗死的程度。
3.6 本研究的局限性
本研究樣本量較小,且實驗操作中小豬體位等難以控制,動物不能控制呼吸及心跳,均對圖像質量有較大影響,只得到部分質量合格的心尖及乳頭肌兩個層面圖像,對數據統計產生了影響,需要進一步增加樣本量,優化實驗技術,達到高質量圖像,將能建立小豬正常及心肌缺血的參考標準T1定量值。
[References]
[1]Liu MX. A preliminary study of myocardial quantitative evaluation using a cardiac magnetic resonance T1 and T2 mapping techniques. Xi'an: Fourth Military Medical University, 2015: 1-62.劉明熙. 磁共振T1、T2 mapping技術定量評價心肌的初步研究.西安: 第四軍醫大學, 2015: 1-62.
[2]Zhao SH. Cardiac MR: recent technical developments. Chin J Magn Reson Imaging, 2014, 5(S1): 73-77.趙世華. 心臟磁共振技術新進展. 磁共振成像, 2014, 5(S1): 73-77.
[3]Wen L, Cui JH, Huang H, et al. Establishment of swine model of chronic myocardial ischemia suitable for medical imaging. Third Military Medical University Journal, 2010, 32(12): 1245-1248.文利, 崔建華, 黃河, 等. 適于影像學研究的豬慢性心肌缺血模型的制備. 第三軍醫大學學報, 2010, 32(12): 1245-1248.
[4]Hood MN, Song T, Bedocs P, et al. Multiacquisition T1-mapping MRI during tidal respiration for quantification of myocardial T1 in swine with heart failure. Cardiopulmonary Imaging, 2013, 201(12): 563-570.
[5]H-Ici DO, Jeuthe S, Al-Wakeel N, et al. T1 mapping in ischaemic heart disease. Eur Heart J Cardiovasc Imaging, 2014, 15(6): 594-602.
[6]Germain P, Ghannudi SE, Jeung MY, et al. Native T1 mapping of the heart-a pictorial review. Clin Med Insights Cardiol, 2014, 8(Suppl 4): 1-11.
[7]Gao L, Wang W, Li YL, et al. Simvastatin therapy normalizes sympathetic neural control in experimental heart failure: roles of angiotensin II type 1 receptors and NAD(P)H oxidase. Circulation, 2005, 112(12): 1763-1770.
[8]Goebel J, Seifert I, Nensa F, et al. Can native T1 mapping differentiate between healthy and diffuse diseased myocardium in clinical routine cardiac MR imaging?. PLoS One, 2016, 11(5): 155591.
[9]Liu MX, Zhang WS, Zhang ZH, et al. A preliminary study of the quantitative T1 mapping technique in evaluation of the native left ventricular myocardial T1 value in different segments. China Medical Equipment, 2015, 30(6): 33-38.劉明熙, 張挽時, 張子衡, 等. T1 mapping定量技術評價左室不同區域心肌初始T1值的初步研究. 中國醫療設備, 2015, 30(6): 33-38.
[10]Von KF, Prothmann M, Dieringer MA, et al. Myocardial T1 and T2 mapping at 3T: reference values, influencing factors and implications. J Cardiovasc Magn Reson, 2013, 15(1): 1-15.
[11]Ma XH, Zhao L, Li SN, et al. MR T1 mapping imaging in assessment of diffuse myocardial fibrosis of hypertrophic and dilated cardiomyopathy. Chin J Med Imaging Technol, 2016, 32(1): 52-56.馬曉海, 趙蕾, 李松南, 等. 磁共振T1 mapping成像評價肥厚型和擴張型心肌病彌漫性心肌纖維化. 中國醫學影像技術, 2016, 32(1): 52-56.
[12]Qi L, Zhang LJ, Lu GM. Progress of myocardial T1 mapping technique and clinical applications. J Med Postgra, 2015, 28(6): 650-655.祁麗, 張龍江, 盧光明. 心肌磁共振T1 Mapping技術及其臨床應用進展. 醫學研究生學報, 2015, 28(6): 650-655.
[13]Kali A, Choi EY, Sharif B, et al. Native T1 Mapping by 3.0 T CMR imaging for characterization of chronic myocardial infarctions. JACC Cardiovasc Imaging, 2015, 8(9): 1019-1030.
[14]Van KM, Magro M, Thiele H, et al. Prognostic value of microvascular obstruction and infarct size, as measured by CMR in STEMI patients. JACC Cardiovasc Imaging, 2014, 7(9): 930-939.
[15]Oorschot JWV, Aidi HE, Lorkeers SJJO, et al. Endogenous assessment of chronic myocardial infarction with T(1)-mapping in patients. J Cardiovasc Magn Reson, 2014, 16(1): 1-9.
CHEN Yuan-yuan1, FANG Ji-liang1*, LIU Gui-yong1, YU Yu-tian2, HE Yi3, HONG Yang1, LUO Ping1, RONG Pei-jing2*
1Guang'anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China
2Institute of Acupuncture and Moxibustion, China Academy of Chinese Medical Sciences, Beijing 100700, China
3Anzhen Hospital Affiliated to Capital Medical University, Beijing 100029, China
*Correspondence to: Fang JL, E-mail: fangmgh@163.com; Rong PJ, E-mail: drrongpj@163.com
Received 8 Aug 2016, Accepted 23 Oct 2016
ACKNOWLEDGMENTSThis work was supported by National Basic Research Program of China (973 Program, No. 2012CB518503); National Natural Science Foundation of China (No. 81273674).
Abstract Objective:The purpose of this study is to quantify the myocardial T1 mapping values in minipig modelling for chronic myocardial ischemia.Materials and Methods:The minipigs were implanted the protein constriction ring (Ameroid) at left anterior descending artery to induce ischemia. The minipigs were scanned twice in a 3.0 T MRI scanner at the short axial slices of the apex, the papillary muscle, at the time of the baseline of the normal heart and at the 4th week after the operation with the chronic myocardial ischemia. The independent-samples t test was employed to analyze the difference of the T1 mapping values of the heart muscles between the two conditions.Results:In this study, 12 minipigs completed CMRI scan before modeling, The unenhanced myocardial average T1 values was (1108.9±10.5) ms, the mean myocardialT1 values were (1050.2±16.7) ms and (1139.7±54.4) ms respectively at the apex and papillary muscle myocardium, the difference was statistically significant. There were 11 minipigs completed CMR scan after modeling, the apical myocardial average T1 values was (1210.6±94.2) ms, it was higher than baseline, the difference was statistically significant. The mean myocardial T1 value of the papillary muscle was (1236.0±114.3) ms at chronic ischemia minipigs, no significant difference with baseline. Furthermore, statistically significant differences existed in the anterior and anteroseptal of the papillary muscle.Conclusion:The T1 mapping technique is valuable as a new important index for the diagnosis of chronic ischemic myocardium.
Key wordsMinipig; Myocardial ischemia; Magnetic resonance imaging; T1 mapping; Anterior wall of the left ventricle; Models, animal
基金項目:
科技部重點課題(973項目)(編號:2012CB518503);國家自然科學基金面上項目(編號:81273674)
1.中國中醫科學院廣安門醫院,北京100053
方繼良, E-mail:fangmgh@163. com;榮培晶,E-mail:drrongpj@ 163.com
2016-08-08
R445.2;R-332
A
10.12015/issn.1674-8034.2017.02.011
2.中國中醫科學院針灸研究所,北京100700
3.首都醫科大學附屬安貞醫院,北京100029
接受日期:2016-10-23