動脈導管未閉合并主動脈縮窄同期介入治療1例
楊太 張萍 劉曉橋(通信作者)(.貴州醫科大學,貴州貴陽550004;.貴州省人民醫院心內科,貴州貴陽55000)
動脈導管未閉合并主動脈縮窄同期介入治療1例
楊太1張萍2劉曉橋2(通信作者)
(1.貴州醫科大學,貴州貴陽550004;2.貴州省人民醫院心內科,貴州貴陽550002)
1 病例介紹
患者,女,14歲,因“發現心臟雜音10余年,勞力性氣促1年”入院。查體:發育欠佳,體重36 kg,血壓130/72 mmHg,胸廓前突畸形,脊柱側彎畸形,雙肺呼吸音稍粗,未聞及干濕性啰音。心界左下擴大,律齊,心率94次/分,P2亢進,胸骨左緣第二肋間可聞及連續的機械樣雜音,雙下肢皮溫低,無杵狀指(趾)。超聲心動圖提示:先天性心臟病動脈導管未閉(管型內徑約7.5 mm)大血管水平連續性左向右分流;二尖瓣、三尖瓣、主動脈瓣輕度返流;中度肺動脈高壓;左室、左房增大(左房內徑38 mm,左室內徑54 mm)。心電圖提示:左室高電壓。血常規提示紅細胞計數、血紅蛋白、血小板計數均正常,白細胞計數10.23×109/L,中性粒細胞百分比78.8%,胸片示:右肺中下葉、左肺下葉滲出性病變,考慮肺部感染,予以青霉素靜滴抗感染治療1周后,復查胸片示:心影改變;雙肺充血征象。臨床診斷:①先天性心臟病動脈導管未閉中度肺動脈高壓左室、左房增大心功能Ⅱ級(NYHA分級);②先天性脊柱側彎畸形;③雙肺肺炎。
完善術前準備,取得患者及其監護人的充分知情同意。局麻下穿刺右股動、靜脈并建鞘。注入肝素3600 U,6F豬尾導管行降主動脈大血管造影示:動脈導管未閉管型最窄處直徑約8.0 mm,大血管水平左向右分流。測肺動脈壓力為88/61/48 mmHg。分別取降主動脈、右心室及肺動脈血約2 mL行血氣分析,測血氧飽和度分別為92%、60%以及82%。估測肺血管阻力為10.58Wood單位,QP/QS為2.06,擬試行封堵。建立右股靜脈、右心室、肺動脈、動脈導管、降主動脈軌道,選用10F輸送鞘及16~18 mm PDA封堵器封堵成功,術后即刻復測肺動脈壓力47/27/18 mmHg,監測數分鐘患者無胸痛,心率和血壓等生命體征平穩,常規復查降主動脈造影提示封堵器位置好,同時發現患者可疑主動脈縮窄,再次行升主動脈造影示:主動脈縮窄導管前型(局限型)最窄處直徑約為6.8 mm。保持PDA封堵器于原位暫不釋放,測升主動脈壓力148/110/92 mmHg,降主動脈壓力105/70/53 mmHg,縮窄部位壓力階差為43 mmHg,有行主動脈縮窄球囊擴張術指征。選用15 mm球囊擴張導管并送至主動脈縮窄處,反復擴張3次,直至球囊腰征消失。術后造影示主動脈最窄處直徑約16.8 mm,升主動脈壓128/100/87 mmHg,降主動脈壓109/90/82 mmHg,動脈壓差為19 mmHg。完成以上操作后最后釋放動脈導管未閉封堵器。術后第二天復測血常規示血小板無明顯下降,無血紅蛋白尿,超聲提示封堵器無移位、變形,主動脈峽部前向血流流速約為2.03 m/s。術后1、3、6月復查超聲心動圖提示左房、左室內徑較前縮小,封堵器位置好,血壓正常,患者臨床癥狀持續改善,可耐受一般體力活動。
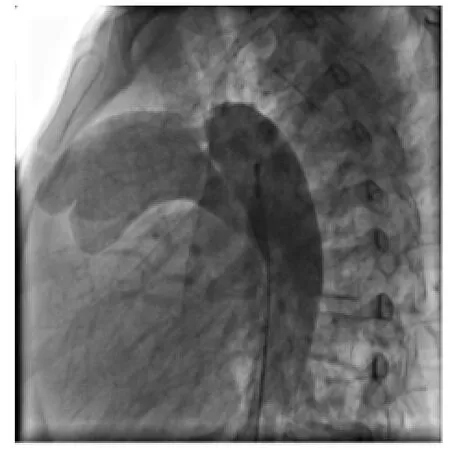
圖1 術前降主動脈造影

圖2 PDA封堵后降主動脈造影
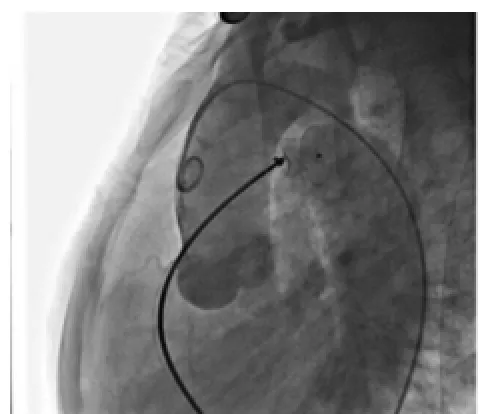
圖3 升主動脈造影
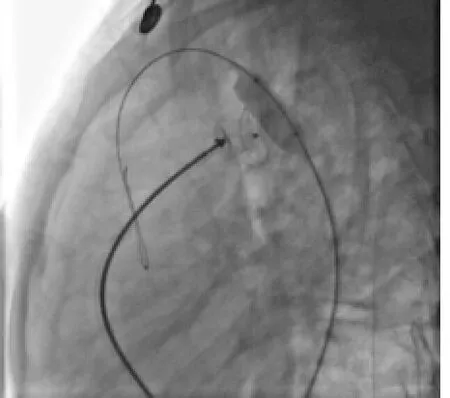
圖4 主動脈縮窄球囊擴張
2 討論
動脈導管未閉(Patent ductus arteriosus,PDA)合并主動脈縮窄(Coarctation of aorta,COA)約占先天性心臟病的0.3%,初步診斷主要依賴經胸超聲心動圖(Transthoracic echocardiography,TTE)。由于TTE對血管分支走行顯示效果差,聲窗范圍小,且部分患者癥狀不典型,易遺漏胸骨上窩切面檢查,故極易漏診[1]。COA患者預后差,較難控制的高血壓、早發冠心病、卒中、充血性心力衰竭等是常見并發癥。故COA患者一經診斷明確,均需考慮手術緩解跨縮窄部位壓力階差。美國心臟病學會(AHA)指南建議[2]:COA峰值壓差大于20 mmHg或雖小于20 mmHg但具有明顯的影像學證據及存在豐富側支血流的患者需進行干預。
PDA合并COA治療策略的選擇,應結合患者年齡、主動脈縮窄與動脈導管未閉解剖特點、肺動脈壓力程度等綜合考慮,采取個體化的治療方案。近年來,隨著介入器材的革新,經皮介入治療因其手術創傷小、術后并發癥少,已成為青少年患者中容易讓人接受的治療模式。目前,PDA合并COA介入治療方式主要有兩種[3]:一是覆膜支架置入,既解決主動脈縮窄跨狹窄部位壓差,又能封堵動脈導管未閉內的異常血流,還可以有效防止主動脈彈性回縮,相對于球囊血管成形術而言再狹窄發生率低,對主動脈壁損傷小,主動脈瘤發生率低[4]。青少年主動脈發育接近成人水平,覆膜支架的應用能夠避免隨著血管發育而造成的相對性狹窄,可作為優先選擇。但對于PDA直徑較大且合并有重度肺動脈高壓的患者來說,使用覆膜支架同時解決PDA及COA的安全性還有待研究。二是分期手術,即先行主動脈球囊擴張術,再擇期行動脈導管未閉封堵。由于主動脈縮窄球囊擴張過程中可能導致動脈內膜及部分動脈中層的撕裂,隨后進行封堵操作可能會增加主動脈縮窄部位出現動脈夾層及動脈瘤的風險;而動脈導管未閉封堵后隨即進行主動脈縮窄球囊擴張,是否會增加封堵器脫落形成血栓風險尚不明確[5]。有報道稱球囊擴張術對主動脈縮窄外科手術后再狹窄、年長兒局限或隔膜型主動脈縮窄者效果良好,對處于危重狀態主動脈縮窄合并其他心血管畸形的嬰幼兒患者能暫時緩解心衰癥狀,為進一步手術提供機會[6-7]。關于同期行主動脈球囊擴張術及PDA封堵術,張曦等[8]曾報道了相關病例,但其治療的療效仍存在爭議,主要集中在術后并發癥方面,如封堵器變形、移位及脫落,術后主動脈再狹窄及主動脈壁損傷繼而導致的主動脈瘤形成等[4]。
本例為青少年女性,因經胸超聲心動圖遺漏胸骨上窩切面致主動脈縮窄漏診,術中降主動脈造影未發現合并主動脈縮窄,考慮與PDA直徑大、豬尾導管位置及跨縮窄部位壓差等因素使造影劑向動脈導管內分流有關。患者心導管檢查提示重度肺動脈高壓,心導管檢查QP/QS為2.06,肺血管阻力值為10.58 Wood單位,故試行PDA封堵,暫不釋放封堵器,嚴密監測肺動脈壓和生命體征變化。再行主動脈逆行脈造影提示合并有導管前型主動脈縮窄,且為局限型狹窄。考慮該患者發育欠佳,超聲心動圖提示已有左房、左室增大,且合并有肺動脈高壓及心功能不全表現,決定同期治療COA及PDA。患者縮窄類型為局限型縮窄,故我們選用球囊血管擴張術以緩解主動脈壓差,保持PDA封堵器于原位暫不釋放,確認封堵器無變形、移位及脫落后決定是否釋放封堵器,從而避免了球囊操作對PDA封堵器位置及形態的影響。該患者為導管前型主動脈縮窄,在封堵過程中導絲及導管操作并未過多觸及縮窄部位,避免了與操作相關的主動脈內膜損傷,同時,由于選擇的封堵器直徑偏大,其頭端可能會對主動脈壁形成支撐作用,從而減少術后再狹窄的機會,這就增加了治療的安全性。
該患者術后短期隨訪臨床癥狀持續緩解,經胸超聲心動圖提示各房室內徑較前縮小,無不良并發癥,療效顯著。這表明同期行動脈導管未閉封堵及主動脈球囊擴張術,只要指征選擇恰當,對部分患者來說是安全、有效的。
[1]吳開元,李斌,范太兵,等.先天性心臟病漏診及誤診分析[J].中華實用診斷與治療雜志,2016,23(2):207-208.
[2]Feltes TF,Bacha E,Beekman RH,et al.American heart association congenital cardiac defects committee of the councilon cardiovascular disease in the young[J].Circulation,2011,123(2):2607-2652.
[3]中國醫師協會心血管內科分會先心病工作委員會.常見先天性心臟病介入治療中國專家共識五、先天性心臟病復合畸形的介入治療[J].介入放射學雜志,2011,20(5):345-351.
[4]張端珍.主動脈縮窄介入治療的現狀和進展[J].血管病學進展,2009,30(5):780-783.
[5]Celebi A,Yalcin Y,Erdem A,et al.Successful transcatheter balloon dilatation of coarctation of aorta and coil occlusion of patent ductus arteriosus in a single catheterization procedure[J].Turk J Pediatr,2007,49(1):94-97.
[6]余志慶,周愛卿,王榮發,等.先天性主動脈縮窄的診斷與治療:附75例報告[J].臨床兒科雜志,2000,18(1):44-46.
[7]李江林,李虹,潘微,等.嬰兒主動脈縮窄經皮球囊成形術1例[J].嶺南心血管病雜志,2003,9(3):213-215.
[8]張曦,潘志濤,曹海偉,等.嬰幼兒主動脈縮窄合并動脈導管未閉同時介入治療成功1例[J].疑難病雜志,2011,22(2):149-150.
R541
B學科分類代碼:32024
1001-8131(2017)02-0183-02
2016-09-26
貴州省科技合作計劃項目(黔科合LH字【2015】7160號);貴陽市科技計劃項目(筑科合同【20151001】社53號)

