日本、德國特殊醫學用途配方食品安全監管比較研究
王 丹,戴 岳,劉 鵬,李 強
(1 中國標準化研究院食品與農業標準化研究所,北京 100191; 2商丘出入境檢驗檢疫局,河南商丘 476100)
日本、德國特殊醫學用途配方食品安全監管比較研究
王 丹1,2,戴 岳1,劉 鵬1,李 強1
(1中國標準化研究院食品與農業標準化研究所,北京 100191;2商丘出入境檢驗檢疫局,河南商丘 476100)
特殊醫學用途配方食品是指需要在醫生指導下進行服用的一類具有特殊食物用途的食品。通過比較研究日本、德國的特殊醫學用途配方食品安全監管的先進經驗,為我國特殊醫學用途配方食品安全監管起到借鑒意義。
特殊醫學用途配方食品;監管;比較研究
1 日本特殊醫學用途配方食品管理
1.1 日本特殊用途食品相關法律法規分類及申請程序
日本健康增進法(2002年法律第103號)第26條確定了特醫食的法律地位。日本的特醫食屬于特殊用途食品,特殊用途食品的分類見圖1。特醫食申請企業將待銷售的產品認可申請書通過地方保健所交至消費者廳食品標簽策劃部,消費者廳食品標簽策劃部通知厚生勞動省醫藥食品局,依據厚生勞動省醫藥食品局的答復,消費者廳食品標簽策劃部轉告申請企業,申請企業將產品樣品送至日本國立健康營養研究所或注冊檢驗機構研究所提出分析請求,待拿到分析結果后,申請企業將其提交到消費者廳食品標簽策劃部,待審核通過后,消費者廳食品標簽策劃部允許向企業發放許可證,主要流程見圖2。提出特殊用途食品上市許可的申請人,需按照政令所規定的金額(進行許可試驗的費用除外),向國家繳納一定的手續費;申請許可試驗,也要向研究所或注冊測試機關所繳納政令規定的手續費和許可測試費用,生產、進口或者銷售特殊用途食品的企業需要食品營業者注冊登記的許可。注冊申請人屬于股份公司或有限公司時,特殊用途食品營業者須為其總公司;注冊申請人的董事中,特殊用途食品營業者的董事或職員的比例超過二分之一;具有注冊申請人代表權的董事為特殊用途食品經營者的董事或職員等[2]。具體見《健康增進法》第六章第二十六條四。
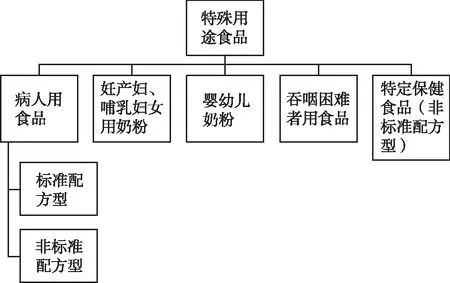
圖1 日本特殊用途食品分類
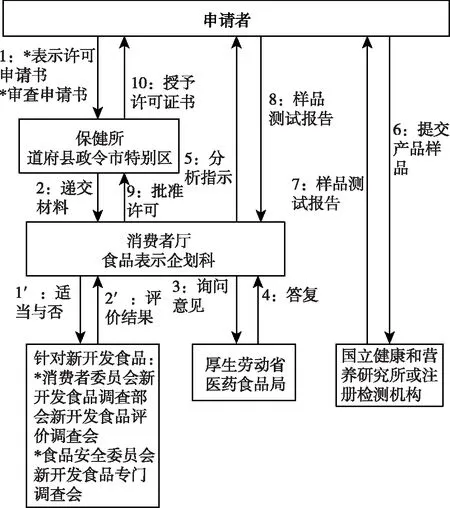
圖2 日本對于(除食品特定保健用)特殊用途食品的申請程序
1.2 注冊檢驗機構的管理
對特殊用途食品進行許可試驗的注冊檢驗機構,《健康增進法》也有相關規定。注冊檢驗機構的申請者需按照厚生勞動省法令所規定的手續,繳納政令規定的手續費后,向厚生勞動省大臣提出注冊申請。厚生勞動省再根據相關規定和要求對檢驗機構的注冊資格、包括人員、設備等執行許可試驗所必備的注冊條件進行審查。注冊機構每5年以上或10年以內注冊更新,逾期未更新者,其許可資格失效。如有違反相關規定,厚生勞動省大臣有權取消其注冊,或命令該機關在一定期限內暫停整頓或停止全部或一部分許可試驗業務。注冊檢驗機構在接受許可試驗的委托時,應立即進行,具有正當理由除外。注冊檢驗機構進行許可試驗的辦事處所在地有變更時,應在變更2周前,向厚生勞動省大臣提出申請變更。在未得到厚生勞動省大臣許可的情況下,注冊檢驗機構不可自行暫定或停止全部或部分許可試驗業務。同時厚生勞動省大臣有權安排其職業進入注冊檢驗機構,對其業務狀況、賬簿、其他資料等進行檢查。
1.3 特殊醫學配方食品管理
根據《健康增進法》,日本制定病人用特殊食品的審評標準,并分為2種類型[3]:標準配方型:包括了全營養食品、低蛋白質食品、無乳糖食品、除過敏原食品4類,針對每類產品,制定相應的許可標準,許可標準中規定了各類產品的營養素含量、說明書、標簽。日本厚生省根據該標準對所申報產品繼續審核批準,時間短、程序簡單。非標準配方型:為需要個別審批的食品,如所生產的產品不是標準配方食品,不符合第一類許可標準的要求,則需要對該類產品的技術指標進行全面的技術審評和批準,時間長,審評流程復雜。
2 德國特殊醫學用途配方食品管理
2.1 法律法規
歐盟于2013年6月發布(EU)No 609/2013《關于嬰幼兒食品、特殊醫療用途食品和控制體重代餐的條例》,2016年7月生效。本法規就嬰幼兒配方食品及較大嬰兒配方食品、加工谷物基食品及嬰兒食品、特殊醫療用途食品和控制體重代餐等食品類別的組成及信息要求建立了通用規定,并就可添加至這些食品類別中的物質建立了一份聯合目錄及其更新規則[4]。同時廢止1999/21/EC《特殊醫療作用膳食食品》。
長子曾經的貢獻,共和國不會忘記。進入21世紀以來,中共中央、國務院陸續發布若干 《關于實施東北地區等老工業基地振興戰略的若干意見》,明確了實施振興戰略的指導思想、方針任務和政策措施。這既是國家總體發展戰略的部署,也是國家對東北、對遼寧 “長子”勇于奉獻、甘于犧牲精神的補償與回饋。2013年和2016年,習近平總書記先后兩次指出:遼寧作為 “共和國的長子”,有過輝煌,也有過低迷,現在又扛起國家重擔、煥發青春。展望未來,遼寧正在抓住改革的關鍵時期,繼續以良好的工業基礎和突出的產業優勢為國家建設發揮著重要作用。
德國在很大程度上在歐盟共同體法律基礎上制定了特殊膳食食品的規則,聯邦食品與農業部(BMEL)內設的2司負責食品安全與新技術,其下屬的214處負責特殊食品,膳食補充劑,食品添加劑等立法的相關工作。與特殊食品相關的法律法規包括:
(1)聯邦法律公報第1部分Nr.49/2010第十六條修改飲食規定。如在最近一次修訂條例中糖尿病患者的膳食規定被刪除,理由是因為根據研究,對糖尿病人提供的健康飲食建議同樣適用于一般人群,不需要另外規定糖尿病患者的膳食。(2)《膳食食品條例》包括一般規定、添加劑等物質在特殊膳食食品使用、某些食物的特殊要求、識別標簽和廣告、違法行為、相關條款等六個方面,如條例§4a對膳食食品的廣告顯示及產品測試做出規定[5]。條例中對特殊營養用途食品的定義、標簽標識為“特殊膳食類”的食品,必須與普通食品有顯著區別、添加劑在特殊膳食食品中的使用等有所要求。
2.2 特殊醫學用途配方食品許可
特殊醫學用途配方食品(Food for Special Medical Purpose,FSMP)生產商需要官方正式許可,由相關聯邦州政府的主管部門簽發,有效期無期限,但可隨時撤銷。要求生產商有相關專業人員,如藥劑師,食品化學家等,無違法食品相關法律記錄,且有適合的設備進行生產前的準備工作,尤其是精確的劑量和混合均勻。
特殊醫學用途配方食品進口商需要提供原產國當地主管機構出具符合膳食食品法的證明。FSMP生產機構針對有意觸犯條例,獲一年監禁或是罰款。過失性觸犯,罰款2萬歐元。
2.3 FSMP申請上市
制造商或進口商在FSMP上市前,必須通知聯邦消費者保護和食品安全局,并遞交未加貼標簽的成品樣品。聯邦消費者保護和食品安全局將申請通知聯邦食品與農業部。經銷商需提交產品標簽和通報單,通報單需包含生產商和公司詳情。通報體系由聯邦政府負責實施,為各州服務,僅官方內部使用,不向公眾開發,需要密碼登陸。使用FSMP通報程序可以有效監控FSMP,企業的行政負擔非常小,且通報程序靈活,不阻礙創新。但同時也存在一些缺點,由于食品監測機構缺少專業醫學人員,存在無法監管風險;在德國之外銷售(歐盟成員國/第三國)時官方采用存在法律困難。
聯邦消費者保護和食品安全局檢查申請樣品是否屬于《膳食食品條例》附件8中列出的范圍,同時符合第1條第2款的要求等,并將測試結果通知有關當局。不符合聯邦消費者和食品安全局相關條款要求的產品銷售將被暫時禁止或限制。
2.4 FSMP未來監管
EU指南文件是為了確保歐盟國家統一實施。從2016年開始,德國重新修訂歐盟FSMP法規條款,對歐盟特殊食品(FSG)法規No.609/2013第三條的解釋性決議,并討論在使用植物性食品補充劑的聲稱時,減少科學驗證的要求。
3 我國特醫食監管的現狀及對策
3.1 我國特醫食研究及技術標準
20世紀80年代末開始,特醫食以腸內營養制劑的形式進入我國,經藥品注冊后上市銷售。2015年頒布實施的新《食品安全法》第七十四條規定:國家對保健食品、特殊醫學用途配方食品和嬰幼兒配方食品等特殊食品實行嚴格監管管理,進一步明確了特醫食的食品屬性。與之相關的國家配套標準包括國務院衛生行政部門分別于2010年、2013年公布了GB 25596-2010《食品安全國家標準特殊醫學用途嬰兒配方食品通則》、GB 29922-2013《食品安全國家標準特殊醫學用途配方食品通則》、GB 29923-2013《食品安全國家標準特殊醫學用途配方食品良好生產規范》、GB 13432-2013《食品安全國家標準預包裝特殊膳食用食品標簽》等食品安全國家標準。這些國家配套標準不僅對特殊醫學用途配方食品的定義、類別、營養要求、技術要求做出規定,還針對特醫食的標簽標識、生產規范等作出了進一步要求。
3.2 建議
目前我國特醫食標準框架體系已經基本完成,與特醫食注冊管理辦法相關配套文件已公開征求意見[6],特醫食監管工作進一步細化。目前我國從法律層面上涉及特醫食的只有《食品安全法》。日本除了有《食品安全法》、《食品衛生法》之外,有專門的《健康增進法》來對特殊用途食品標識的許可、對特殊用途食品進行試驗機關的注冊及管理、特殊用途食品的檢查等做出法律規定。德國也有專門的《膳食食品條例》。另外,德國的FSMP不需要上市許可,但食品經銷商須提交產品標簽、生產商等詳細信息[5],減少企業行政負擔,方便企業靈活創新,開發新產品。
特醫食在我國尚處在產業發展的起步階段,在國內市場90%以上被幾家跨國公司壟斷的背景下[7],國內企業面臨著種種困難,大部分企業處于觀望階段。在特醫食產業發展的起步階段,只有建立健全配套的法律體系,規章制度,探索科學有效的監管模式,既要保障特醫食的消費安全,又充分調動特醫食產業生產、創新積極性,積極推動特醫食產業的健康發展。◇
[1]中華人民共和國國家衛生和計劃生育委員會.GB 29922-2013食品安全國家標準特殊醫學用途配方食品通則[S].
[2]日本《健康增進法》[Z].http://wwwhourei.mhlw.go.jp
[3]梁棟,韓軍花.特殊醫學用途配方食品—標準與管理[J]. 衛生研究,2014,43(3):524-527.
[4]歐盟No 609/2013《關于嬰幼兒食品、特殊醫療用途食品和控制體重代餐的條例》[Z].http://www.efsa.europa.eu/sites/default/files/consultation/150717a.pdf.
[5]德國《膳食食品條例》[Z].http://www.gesetze-im-internet.de/di_tv/BJNR004150963.html
[6]http://www.sda.gov.cn/WS01/CL0782/150540.html.
[7]索思卓,胡豪,王一濤.特殊醫學用途配方食品在中國的發展概況[J].中國食品衛生雜志,2016,28(2):182-186.
(責任編輯 李婷婷)
Comparative Study on Food Safety Regulation of Special Medical Use Formulas in Japan and Germany
WANG Dan1,2,DAI Yue1,LIU Peng1,LI Qiang1
(1Food and Agricultural Standardization Department,China National Institute of Standardization,Beijing 100191,China;2Shangqiu Entry-Exit Inspection and Quarantine Bureau,Shangqiu 476100,China)
Food for special medical purpose is a kind of special food that needs to be taken under the guidance of doctors.Through comparative study on advanced regulatory experience in Japan and Germany,this paper provided some references for China’s food safety supervision for special medical purpose.
Food for Special Medical Purpose(FSMP);supervision;comparative study
國家食品藥品監督管理總局委托課題“特殊醫學用途配方食品注冊審評審批制度研究”。
王丹(1985— ),女,碩士,中級工程師,研究方向:食品安全與檢測。
李強(1980— ),男,博士,副研究員,研究方向:食品監測與控制、食品標準化。

