福建水生植物浮萍的形態學和分子系統學鑒定及遺傳多樣性研究
葉松建 韓冰瑩 張家明

摘 要 在福建53個市縣(區)收集獲得119份浮萍種質。通過葉片大小、根系和葉脈數等形態性狀初步鑒定為4個屬:少根紫萍屬(Landoltia)、多根紫萍屬(Spirodela)、無根萍屬(Wolffia)、浮萍屬(Lemna)。利用葉綠體atpF-atpH間隔序列和rpS16內含子序列進行系統發育分析。結果表明,119份浮萍種質分別屬于4個種Landoltia punctata,Spirodela polyrhiza,Wolffia globosa,Lemna aequinoctialis。利用DnaSP 5.10.01軟件分析結果顯示,福建浮萍種質存在豐富的遺傳多樣性,且rpS16比atpF-atpH多樣性大,兩者的核苷酸多態性指數分別為0.051 23和0.031 53,每kb平均核苷酸差異數為44.675和20.374,群體突變率分別為0.051 64和0.036 40,單倍型多態性指數分別為0.617和0.577。稀脈萍、無根萍和多根紫萍基于atpF-atpH和rpS16序列的單倍型數為4、2、2。另外,閩南地區浮萍遺傳多樣性高于閩北地區,其核苷酸多態性指數、每kb核苷酸變異數以及群體突變率分別是閩北地區的2倍以上。
關鍵詞 浮萍;形態學;分子系統學;遺傳多樣性;發育樹
中圖分類號 Q94 文獻標識碼 A
Abstract 119 duckweed germplasms were collected in 53 cities or countries in Fujian Province. They were classified into four genera: Landoltia, Spirodela, Wolffia, and Lemna using morphological analysis based on leaf size, root and leaf number. The chloroplast atpF-atpH internal sequence and the rpS16 intron sequence were obtained by PCR amplification and sequencing. Phylogenetic analysis indicated that these germplams belong to four species: Landoltia punctata, Spirodela polyrhiza, Wolffia globosa, and Lemna aequinoctialis. Genetic diversity analysis using DnaSP 5.10.01 software showed that germplasms had rich diversity, and rpS16 presented more diversity than atpF-atpH. The nucleotide diversity of atpF-atpH and rpS16 was 0.031 53 and 0.051 23,respectively; the distinct nucleotide number per kb was 20.374 and 44.675, respectively; the population mutation rate was 0.036 40 and 0.051 64, respectively, and the haplotype diversity was 0.577 and 0.617, respectively. The haplotype numbers of atpF-atpH and rpS16 were 4, 2, and 2, respectively. The genetic diversity in South Fujian was higher than that in North Fujian, and the nucleotide diversity, different nucleotide number and the population mutation rate of atpF-atpH in South Fujian were twice as high as those in the North.
Key words duckweed; morphology; molecular systematics; genetic diversity; phylogenetic tree
doi 10.3969/j.issn.1000-2561.2017.04.015
浮萍科(Lemnaceae)植物包括5個屬:浮萍(綠萍)(Lemna)、少根紫萍(Landoltia)、多根紫萍(Spirodela)、無根萍(Wolffia)、扁平無根萍(Wolfiella),共37個種[1-3]。由于浮萍在自然界中易受環境因素的影響,而使得浮萍的形態發生改變,少數浮萍可通過外形及其他特征鑒定到種,故浮萍形態學的鑒定相對困難。浮萍是一種最小的被子植物,分布極為廣泛,它是漂浮在水體表面,如湖泊、稻田、廢水池塘、小溝渠等[4]。浮萍具有高含量的蛋白質,可作為水禽類的重要食料[5-8]。不僅是禽類喜吃浮萍,在人類的世界中,也有一些地區以浮萍為菜蔬。浮萍已經被證明具有處理農業廢水的功能,它們具有生長速度快,吸收氮、磷等特點[9-10]。近年來,浮萍在生物燃料中的應用前景受到廣泛關注。浮萍在特定生長條件下葉片中淀粉含量高,且木質素含量較低[11],利用浮萍的淀粉發酵生產燃料乙醇,產率高達97.8%[12-14]。目前有關浮萍DNA分子標記技術鑒定物種研究報道較少,故而本研究利用atpF-atpH條形碼序列與rpS16內含子序列進行分子標記遺傳分析,并對浮萍遺傳多樣性進行初步性的研究。不同來源、不同種類的浮萍,生物學特性及應用領域差異很大,因此廣泛收集浮萍種質資源并進行遺傳多樣性研究和篩選具有重要價值。
1 材料與方法
1.1 材料
1.1.1 植物材料 本研究所用的119份浮萍種質分別收集于福建53個市縣(區),采集地點見圖1。
1.1.2 無菌株系的制備 將野外采集的浮萍用自來水沖洗3~5遍,用Hoagland全營養液培養數天。每份材料取其中5株,用5%漂白液(藍月亮)在超凈工作臺上漂洗2 min,轉移至無菌含1%蔗糖的1/2Hoagland營養液中,每瓶營養液1株浮萍,置于24~30 ℃,光照強度為2 000 lx的培養箱中培養。培養一周后,挑選無污染的浮萍大量繁殖培養,并編號保存到浮萍種質資源庫。
1.2 方法
1.2.1 形態學鑒定 對無菌培養的浮萍進行形態學鑒定,測量葉狀體大小,觀察根的數量和葉脈的數量等。如圖2所示,A1為浮萍(綠萍),B1為多根紫萍,C1為少根紫萍,D1為無根萍;A2、B2、C2、D2分別為浮萍(綠萍)、多根紫萍、少根紫萍、無根萍的單個克隆的正面形態,用體視顯微鏡拍照;A3、B3、C3、D3分別為浮萍、多根紫萍和少根紫萍、無根萍的背面;A3的多根紫萍中背面紫色不多,可能是因為光照強度不夠或是培養時間較短(藍色箭頭標示葉片葉脈,橘黃箭頭標示植株根部及根長,紅色箭頭標示呈現紫色的部位)。
1.2.2 DNA提取、PCR擴增及測序 以無菌浮萍為材料,使用DNA提取試劑盒(TIAN GEN新型植物基因組DNA提取試劑盒DP320-02)提取浮萍總DNA(按試劑盒說明書步驟進行)。葉綠體atpF-atpH間隔序列用引物HNP307(5' ACTCGCACACACTCC CTTTCC 3')和HNP308(5' GCTTTTATGGAAGCTTA AACAAT 3')擴增。葉綠體rpS16內含子序列用引物rpS16F(5' GGTTTAGACATTACTTCGGTG 3')和rpS16R(5' TAATGTCTAAACCCAAGGA 3')擴增。反應體系為:1 μL的DNA模板、1 μL的引物、4 μL的10× dNTP Mix、5 μL的10× La PCR buffer、0.5 μL的LaDNA聚合酶,37.5 μL的去離子水。PCR擴增反應程序為:94 ℃預熱變性4 min;94 ℃變性30s,50 ℃降溫30 s,72 ℃延伸1 min,34個循環;72 ℃延伸7 min后,將擴增產物進行凝膠電泳檢測。擴增產物由華大基因公司測序。
1.2.3 分子系統學及遺傳多樣性分析 DNA序列測序結果用MacVector15組裝成完整序列。通過NCBI數據庫BLAST分析,篩選出可靠的37個浮萍科物種的代表性序列,與福建浮萍序列一起,進行分子系統學分析。先用MacVector進行序列比對,然后用Mega6.0軟件構建系統發育樹,確定浮萍分類地位。將福建浮萍序列比對結果輸入DnaSP5.10.01軟件,分析福建不同地區浮萍種的遺傳多樣性,其中包括單倍型數、單倍型多態性指數(Hd)、核苷酸多態性指數(Pi)、群體突變率(沃特森估計量θw)和平均每kb核苷酸差異數。
2 結果與分析
2.1 通過形態學性狀對福建浮萍種質進行分類鑒定
用肉眼或者顯微鏡觀察浮萍種質的葉狀體大小、顏色、葉片成簇數、葉脈數、根數等形態學性狀,對浮萍種質進行分類,結果表明福建119個浮萍種質分別屬于4個屬:少根紫萍屬(Landoltia)、多根紫萍屬(Spirodela)、無根萍屬(Wolffia)、浮萍屬(Lemna)(表1)。浮萍屬(Lemna species)數量最多,有91份;多根紫萍屬(Spirodela)次之,有15份;少根紫萍屬(Landoltia)只有7份種質;無根萍屬(Wolffia)最少,有6份種質。
2.2 atpF-atpH和rpS16 DNA片段的擴增
圖3是部分浮萍株系的葉綠體atpF-atpH間隔序列和rpS16內含子序列PCR擴增結果。所有119份種質都擴增到了atpF-atpH和rpS16的DNA片段,其中atpF-atpH片段長度約為650 bp,rpS16片段長度約為1 000 bp。
2.3 分子系統發育分析
利用葉綠體atpF-atpH間隔序列與rpS16內含子序列進行分子聚類分析,結果表明,119份浮萍種質聚類到4個種(圖4),分別是Lemna aequinoctialis,Spirodela polyrhiza,Landoltia punctata,Wolffia globosa。用兩種序列所得出的結果完全吻合,并且與形態學分類結果(圖2)一致。其中,Lemna aequinoctialis種質數量最多,有91份種質屬于該種,15份種質屬于Spirodela polyrhiza。7份種質屬于Landoltia punctata。6份種質屬于Wolffia globosa。atpF-atpH序列(A)和rpS16序列(B)分別用MacVector軟件比對后,用MEGA6軟件構建分子系統發育樹。完全相同的序列用1條序列做代表,相同序列的數量在括號中標出。參考序列來自GenBank。
2.4 遺傳多樣性分析
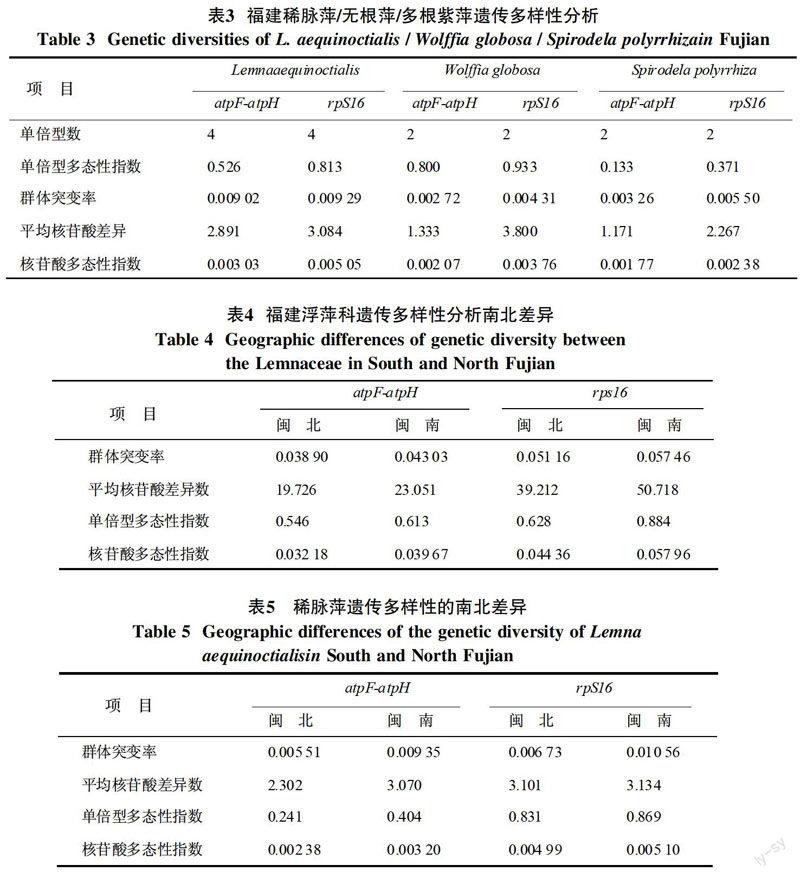
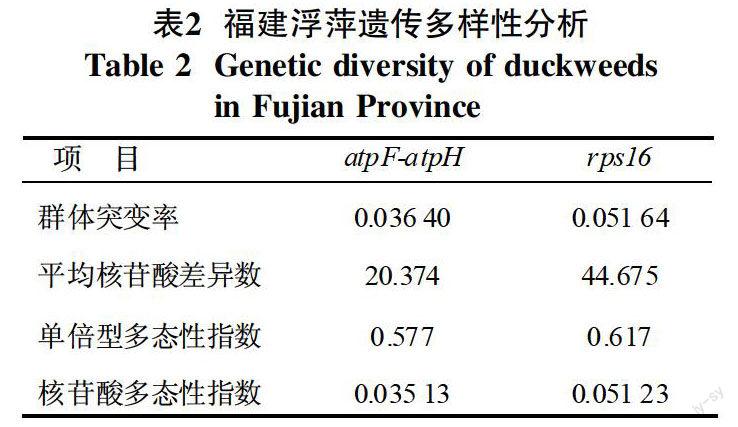
利用DnaSP5軟件分析福建浮萍種質的遺傳多樣性。結果表明福建浮萍種質的遺傳多樣性非常豐富,而且rpS16比atpF-atpH序列的多樣性更大。基于atpF-atpH和rpS16的核苷酸多態性指數分別為0.035 13和0.051 23,每kb平均核苷酸差異數為20.374和44.675,群體突變率分別為0.036 40和0.051 64,單倍型多態性指數分別為0.577和0.617(表2)。稀脈萍、無根萍、多根紫萍基于atpF-atpH和rpS16的單倍型數分別為4、2、2(表3),這些多樣性參數都高于海南島浮萍的遺傳多樣性,且海南單倍型數分別為3、2、1、1[16]。地區之間的遺傳多樣性也存在差異,閩南地區浮萍遺傳多樣性高于閩北地區(表4、5)。閩南地區基于葉綠體atpF-atpH間隔序列的核苷酸多態性指數、每kb核苷酸變異數以及群體突變率分別是閩北地區的2倍以上。以科為單位和以單一浮萍(稀脈萍)屬為單位進行遺傳多樣性分析的結果都支持閩南地區的遺傳多樣性高與閩北地區的結論(表4、5)。
3 討論
全世界浮萍科植物有5屬37種[1-3],中國浮萍科植物可能有4屬10種[15],其中相關文獻報道海南地區浮萍科發現4屬4種,分別為浮萍屬(Lemna):稀脈萍(Lemna aequinoctialis),多根紫萍屬(Spirodela):多根紫萍(Spirodela polyrrhiza),少根紫萍屬(Landoltia):少根紫萍(Landoltia punctata),無根萍屬(Wolffia):無根萍(Wolffia globosa)[16-18]。江蘇地區發現4屬4種分別為浮萍屬(Lemna)的青萍(Lemna perpusilla);無根萍屬(Wolffia)的無根萍(Wolffia globosa);多根紫萍屬(Spirodela)的多根紫萍(Spirodela polyrrhiza);少根紫萍屬(Landoltia)的少根紫萍(Landoltia punctata)[22]。浙江地區浮萍科發現3屬5種分別為浮萍屬:浮萍、品萍、稀脈萍;多根紫萍屬:紫萍;無根萍屬:無根萍[23]。本研究所發現的福建地區浮萍科種類與海南地區的相似。文獻比較發現沿海地區浮萍屬中都有稀脈萍,且浙江地區浮萍屬中還發現浮萍和品萍,而其他幾個沿海地區沒有發現。
本研究根據6個形態學數量性狀初步將福建浮萍種質分類到屬,其中包括浮萍葉片大小、成簇葉片數、葉脈數、根數、根長、葉片顏色[16],采用葉綠體atpF-atpH間隔序列以及rpS16內含子序列進行分子系統學鑒定,與GenBank數據庫下載浮萍的參考序列進行分析比對,構建發育樹[17],將福建119份浮萍種質鑒定到種。其中,91個浮萍種質為稀脈萍(Lemna aequinoctialis),15個種質為多根紫萍(Spirodela polyrrhiza);6個種質為無根萍(Wolffia globosa);7個種質為少根紫萍(Landoltia punctata)。
DnaSP5.10.01軟件是一個廣泛使用的進行遺傳多樣性分析的軟件。筆者用該軟件對福建119個浮萍種質材料的DNA序列進行遺傳多樣性分析,其中主要分析群體突變率(θw)、平均核苷酸差異數(Kb)、單倍型多態性指數(Hd)以及核苷酸多態性指數(Pi)。結果表明,福建的浮萍種質存在豐富的遺傳多樣性,其結果如表2~5所示。其中rpS16比atpF-atpH序列的多樣性更大。閩北與閩南地區浮萍科基于atpF-atpH和rpS16的核苷酸多態性指數分別為0.035 13和0.051 23,每kb平均核苷酸差異數為20.374和44.675,群體突變率分別為0.036 40和0.051 64,單倍型多態性指數分別為0.577和0.617(表2)。其中稀脈萍、無根萍和多根紫萍基于atpF-atpH和rpS16的單倍型數分別為4、2、2(表3)。這些多樣性參數都明顯高于海南島浮萍的遺傳多樣性[17]。福建浮萍種質各項指標均高于海南島浮萍的遺傳多樣性的原因在于多方面的因素,如氣候、溫度,地形等。福建氣候屬于亞熱帶濕潤季風氣候,主要特征為濕潤溫暖;受氣候影響,光照充足,熱量豐富,雨量也非常充沛,且全年平均氣溫在19.5~21.2 ℃左右。福建地形主要以山地丘陵為主,多山地少平原,多斷層地貌,多河谷盆地典型特征,且受地質構造控制,形成了閩西大山和閩中大山相互平行帶[19]。海南島氣候屬于熱帶海洋季風氣候,其主要特征為光熱充足,降水豐富,且水熱同期,全年平均氣溫在22.4~25.5 ℃左右。海南島地形主要也是以山地丘陵為主,與臺地、平原構成環形層狀地貌,階梯結構明顯[20-21]。福建閩南遺傳多樣性大于閩北,兩者相比較,地形變化不大,唯有影響兩省浮萍種質遺傳變異的因素可能為氣候與溫度的不同,并且可能還存在一些水質或者土質方面的因素,福建的土壤指標由于受不同的地理位置分為“熱性”與“溫性”,南部較北部土壤中所富含的鋁特性較強,鹽基不飽和[24]。由于浮萍容易受到自然環境因素的影響而改變自身的形態,并且發生基因的改變,故而綜上所述福建閩南浮萍的遺傳多樣性大于閩北,可能性最大的因素是溫度、氣候、地理位置以及關照強度所導致浮萍遺傳多樣性變化。
福建119份浮萍種質中浮萍屬分布最多,最廣泛,故遺傳多樣性也相對其他屬類要豐富。不同的種類,不同地區的浮萍,生物學特性也存在差異性。隨著全球能源的需求量不斷上漲,以往能源乙醇燃料開發均采用糧食作物來生產,造成人類糧食的短缺。浮萍有生長快,不爭糧等特點,是一種優質的能源水生植物,近年來已經有研究人員研究浮萍提煉乙醇[12-14]。不同浮萍的種質有不同的性狀,對福建浮萍種質的遺傳多樣性研究和篩選有著重要的理論和應用價值,為今后的生物能源研究奠定基礎。
參考文獻
[1] 李志蘭,連彥峰. 浮萍污水脫氮處理的研究進展及應用展望[J]. 浙江農業科學, 2015, 56(2): 163-166.
[2] Klaus J Appenroth, Nikolai Borisjuk, Eric Lam. Telling duckweed apart: genotyping technologies for the Lemnaceac[J]. Chin J Appl Environ Biol, 2013, 19(1): 1-10.
[3] 黃 猛, 許亞良, Kanjana Khaeso, 等. 水楊酸誘導膨脹浮萍(Lemna gibba SH0204)開花[J]. 植物生理學報, 2015, 51(4): 559-565.
[4] K Sowjanya Sree, Satish C Maheshwari, Karoly Boka, et al. The duckweed Wolffia microscopica: a unique aquatic monocot[J]. Flora-Morphology, Distribution, Functional Ecology of Plants, 2015, 210: 31-39.
[5] Kelly A Collins, Timothy J Lawrence, Emilie K Stander. The duckweed Wolffia micros. Opportunities and challenges for managing nitrogen in urban stormwater: a review and synthesis[J]. Ecological Engineering, 2010, 36(11): 1 507-1 519.
[6] Cheng J Y, Bergmann B A, Classen J J, et al. Nutrient recovery from swine lagoon water by Spirodela punctata[J]. Bioresource Technology, 2002, 81(1): 81-85.
[7] Lamdesman L, Chang J, Yamamoto Y, et al. Nutritional value of wastewater-growmn duckweed for fish and shrimp feed[J].Bioresource Technology, 2002, 33(4): 39-40.
[8] Huque K S, Chowdhury S A, Kibria S S. Study on the potentiality of duckweeds as a feed for cattle[J]. Asuab Austr J Anim Sci, 1996, 9: 133-138.
[9] 張 浩, 方 揚, 靳艷玲, 等. 耐高氨氮浮萍的篩選及優勢品種的生長特性[J]. 應用與環境生物學報, 2014, 20(1): 63-68.
[10] Xu J, Shen G. Growing duckweed in swine wastewater for nutrient recovery and biomass production[J]. Bioresour Techonl,2011, 102(2): 848-853.
[11] Rolfe S A, Tobin E M. Deletion analysis of a phytochrome regulated monocot rbcS promoter in a transient assay system[J]. Proc Nat Acad Sci USA, 1991, 88(7): 2 683-2 686.
[12] Richard C Baliban, Josephine A Elia, Christodoulos A Floudas, et al. Thermochemical conversion of duckweed biomass to gasoline, diesel, and jet fuel: process synthesis and global optimization[J]. Ind Eng Chem Res, 2013, 52(33): 11 436-11 450.
[13] Xu J, Cui W, Cheng J J, et al. Production of high-starch duckweed and its conversion to bioethanol[J]. Biosystems Eng,2011, 110(2): 67-72.
[14] 于昌江, 朱 明, 馬玉彬, 等. 新型能源植物浮萍的研究進展[J]. 生命科學, 2014, 26(5): 458-464.
[15] Ronald A Leng. 稻田浮萍: 農業綜合體系中多功能小型水生植物[M]. 黃世文, 王 玲, 劉聯盟, 編譯. 北京: 中國農業科學技術出版社, 2010.
[16] 許亞良. 海南島浮萍種質資源收集、遺傳多樣性及應用前景分析[D]. 武漢: 華中農業大學, 2014.
[17] Xu Yaliang, Ma Shuai, Huang Meng, et al. Species distribution, genetic diversity and barcoding in the duckweed family(Lemnaceae)[J]. Hydrobiogia, 2015, 743: 75-87.
[18] 許亞良, 張家明. 海南島浮萍群落的分別及影響群落結果的因素[J]. 熱帶生物學報, 2015, 36(3): 304-309.
[19] 陳 星. 福建山地生物多樣性資源綜合開發研究[D]. 福州: 福建農林大學, 2005.
[20] 唐少霞, 趙志忠, 畢 華, 等. 海南島氣候資源特征及其開發利用[J]. 海南師范大學學報(自然科學報), 2008, 21(3): 343-346.
[21] 王 博. 基于Aater+G-Dem的海南地形地貌信息提取與土地利用景觀格局分析[D]. 海口: 海南大學, 2010.
[22] 吳雪飛,劉璐嘉, 馬 晗, 等. 江蘇省夏季浮萍種類及其生長水環境調查[J]. 生態與農村環境學報, 2012, 28(5): 554-558.
[23] 王敏雅,陸 菲, 毛杉杉, 等. 利用分子遺傳標記分析浙江地區浮萍多樣性[J]. 安徽農業科學, 2012, 40(31):15 127-15 128.
[24] 陳健飛. 福建山地土壤的系統分類及其分布規律[J]. 山地學報,2001, 19(1): 1-8.

