介導細胞凋亡的caspase- 3在卵巢癌中的表達和放療敏感性的關聯性研究
張春年,王建中
(贛州市人民醫院,江西 贛州 341400)
·論 著·
介導細胞凋亡的caspase- 3在卵巢癌中的表達和放療敏感性的關聯性研究
張春年,王建中
(贛州市人民醫院,江西 贛州 341400)
目的:研究介導細胞凋亡的caspase- 3在卵巢癌中的表達和放療敏感性的關系。方法:通過對臨床不同時期卵巢組織樣本的收集及凋亡相關因子mRNA和蛋白的檢測,以及免疫組化法定位、定量caspase- 3在不同時期卵巢癌中的變化來研究不同時期卵巢癌細胞凋亡情況。通過射線照射細胞然后對細胞進行計數統計,以研究不同種類卵巢癌細胞的放射敏感性。結果:免疫組化、PCR、Western Blot結果顯示,隨著卵巢細胞的癌變,凋亡的存活基因bcl2被激活,凋亡致死基因bax被抑制,凋亡執行蛋白caspase- 3數量下降。同時射線照射和細胞統計結果顯示,不同類型卵巢癌細胞對放射敏感性不同。結論:caspase- 3蛋白數量隨著卵巢癌變而下降,而對于卵巢癌變細胞來說,caspase- 3蛋白含量越多,放射敏感性越強。
卵巢癌; 細胞凋亡; caspase- 3; 放射敏感性
卵巢惡性腫瘤是女性生殖器官最常見的腫瘤之一,僅次于宮頸癌和子宮體癌[1],其死亡率排在婦科腫瘤首位,加之早期癥狀不典型,對婦女造成嚴重的危害[2]。卵巢癌以腺癌為主,包括三大類:一是漿液性腺癌,最常見的原發性卵巢惡性腫瘤,占所有卵巢惡性腫瘤的40%~60%;二是黏液性腺癌,發病率占惡性腫瘤的10%~20%;三是透明細胞癌,原發性卵巢惡性腫瘤中發生率約為6%。不同分類的卵巢癌放療敏感性差別較大[3],因此研究了解不同種類卵巢癌對放療敏感性的差異尤為重要[4]。
細胞死亡的方式有凋亡和壞死兩種[5]。凋亡是細胞編程性死亡,正常存在于細胞生長和衰老過程中,是平衡組織內細胞數量的重要機制[6]。惡性腫瘤細胞一旦形成,凋亡機制受到破壞,癌細胞無限增殖與轉移到各個組織和器官,給人體帶來毀滅性影響。放療是治療癌癥的常用手段,是通過放射誘導癌細胞凋亡實現腫瘤細胞的清除和抑制腫瘤細胞增殖的,但是不同的癌變器官、不同組織類型對放射敏感性差異較大[7]。利用放療治療卵巢癌的同時,首先要了解不同類型卵巢癌對放療的敏感性[8]。大量資料顯示,在腫瘤細胞凋亡中casepase被激活[9]。caspase- 3作為caspase級聯反應下游最關鍵的凋亡執行者,在腫瘤細胞治療中發揮重要作用[10]。本研究主要探討卵巢癌細胞中caspase- 3的表達情況與放射敏感性的關系。
1 材料與方法
1.1 試劑與儀器
1.1.1 試劑 RNA抽提試劑Trizol和M- MLV反轉錄試劑盒購自Sigma公司;NC膜購自Millipore公司;配制蛋白染色液的麗春紅、三氯乙酸和磺基水楊酸均購自Invitrogen公司;蛋白印跡化學發光試劑SuperSignal? West Pico Chemiluminescent Substrate購自Thermo Scientific公司;X- Omat光片購自Kodak公司。DMEM培養基購自Yazyme公司;胎牛血清(FBS, Fetal Bovine Serum)購自GIBCO公司;Trypin、青鏈霉素(penicillin- streptomycin)和L- Glutamine均購自Sigma公司;細胞培養皿、凍存管和離心管購自Corning公司。
1.1.2 儀器 微量移液器購自Eppendorf公司;高速離心機購自Beckman公司;PCR儀購自Bio- Rad;精密天平購自Mettler Toledo公司;熒光顯微鏡Olympus IX71購自日本Olympus公司;實時熒光定量PCR系統購自Applied Biosystems公司;4/-20 ℃冰箱購自海爾公司;垂直電泳槽、濕轉轉膜儀和配套電源均為國內公司產品,X光片洗片機購自Kodak公司;熒光顯微鏡為Olympus公司產品。
1.2 方法
1.2.1 樣本收集 收集本院患者正常卵巢組織14例、卵巢癌前組織17例、卵巢癌變組織21例。每例均取兩塊組織,一塊用甲醛固定,備于制作蠟塊;另一塊立即保存于-180 ℃的液氮中,備于提取mRNA和蛋白。
1.2.2 免疫組化法檢測 脫蠟、水化組織切片,根據所應用的一抗的特殊要求對組織抗原進行修復。3%H2O2去離子水孵育10 min,以阻斷內源性過氧化物酶。緩沖液PBS沖洗,2 min 3次。滴加一抗,37 ℃孵育2 h,PBS沖洗,2 min 3次。滴加試劑1,室溫孵育20 min,PBS沖洗,2 min 3次。滴加試劑2,室溫孵育25 min,PBS沖洗,2 min 3次。最后一步,應用DAB溶液顯色。
1.2.3 細胞培養 3AO為人黏液性卵巢癌細胞系,skov3為人漿液性卵巢癌細胞系,ES- 2為人卵巢透明細胞癌細胞系,購自上海賽齊生物工程有限公司。使用含10%胎牛血清的DMEM培養液靜置培養于保持37 ℃、含5%CO2的細胞培養箱,DMEM完全培養液中含有100 U·ml-1的青霉素及100 μg·ml-1的鏈霉素。
1.2.4 Trizol一步法提取mRNA 先取50~100 mg卵巢組織加入1 ml Trizol液,研磨成液體后室溫放置5 min,再以每1 ml Trizol液加入0.2 ml氯仿,注意要蓋緊離心管,用手劇烈搖蕩離心管15 s。等到分層后取最上層水相轉移至新的離心管,然后按每1 ml Trizol液加0.5 ml異丙醇,再室溫放置10 min,然后離心機中12 000 g離心10 min。丟棄上清液,按每1 ml Trizol液加入1 ml 75%乙醇,振蕩混勻,樣品4 ℃下7 500 g離心5 min。再次棄去上清液,真空干燥5~10 min。最后計算濃度與純度,用75%乙醇溶解mRNA,置于-80 ℃ 冰箱中保存備用,行RT- PCR檢測。
1.2.5 免疫印跡法檢測 用RIPA裂解細胞后進行蛋白濃度測定,再用6 XLoading制樣,高溫蛋白變性。用10%的SDS- PAGE膠上樣電泳,80 V恒壓先跑30 min左右,待蛋白進入分離膠后改120 V恒壓再跑直至得到想要的蛋白條帶。電泳結束后進行濕轉,以300 mA恒流將蛋白電轉到NC膜上,用含5%脫脂奶粉的TBST溶液封閉NC膜2 h。封閉結束后加入配制在含5%BSA的TBST中的一抗,4 ℃過夜。第2天在含5%脫脂奶粉的TBST的二抗(1∶2 000~1∶3 000)中孵育,室溫結合3h,再用TBST洗膜3次。加入顯色底物反應3min,用保鮮膜包好壓片,曝光顯影,可以根據結果調整曝光時間。
1.3 統計學處理
定量數據都以均數±標準差表示,使用GraphpadPrism4.0軟件進行One-wayAnouva統計分析,當P<0.05時認為差異具有統計學意義。
2 結 果
2.1 檢測不同時期卵巢組織中凋亡相關因子mRNA表達情況
凋亡是放療調節細胞的主要機制,所以我們首先檢測不同時期卵巢組織中凋亡的情況。細胞凋亡發生的原因和途徑是復雜多樣的,許多基因參與細胞凋亡的基因調控,包括致死基因和存活基因。bcl- 2家族成員在細胞凋亡的基因調控過程中起著至關重要的作用[9],是一類抗細胞凋亡基因,代表基因是bcl- 2基因[11];另一類是促細胞凋亡基因,代表基因是bax基因[12],他們通過激活一系列下游基因發揮調節凋亡作用[13]。caspase- 3是caspase級聯反應下游最關鍵的凋亡執行者,它的表達情況也非常重要。因此,我們主要檢測了bcl- 2[9]、bax、caspase- 3三者不同時期卵巢組織中mRNA表達情況。結果發現,隨著卵巢組織癌變致死基因bax的mRNA表達量顯著下調,同時存活基因bcl- 2的mRNA表達量顯著上調,caspase- 3的mRNA表達情況與bax相同,顯著下調,說明凋亡通路被抑制(圖1)。

*P<0.05;**P<0.01
圖1 不同時期卵巢組織中凋亡相關因子mRNA表達情況
Fig 1 Expression of apoptosis related factor mRNA in ovarian tissues at different stages
2.2 檢測不同時期卵巢組織中凋亡相關因子蛋白的表達情況
為了驗證以上結果,我們檢測了bcl2、bax、caspase- 3三者不同時期卵巢組織中蛋白表達情況。結果發現,卵巢組織癌變致死基因bax的蛋白表達量顯著下調,同時存活基因bcl2的蛋白表達顯著上調,caspase- 3的蛋白表達情況與bax相同,顯著下調,證明卵巢癌中凋亡通路確實被抑制,癌細胞進入無限增殖狀態(圖2)。
2.3 用免疫組化方法定量不同時期卵巢組織中caspase- 3表達
將正常卵巢組織、卵巢癌前組織、卵巢癌變組織甲醛固定,制作成蠟塊,用于免疫組化檢測。在正常卵巢組織中caspase- 3表達量高,主要分布在細胞核周圍,卵巢組織排列和細胞的形態相對整齊(圖3A)。在卵巢癌變前組織中,caspase- 3表達量明顯下降,且卵巢組織多空泡化,結構不完整(圖3B)。在卵巢癌變組織中caspase- 3幾乎不表達,且卵巢組織結構被破壞,細胞結構被破壞,全部為細胞核(圖3C)。統計不同時期卵巢癌病理中caspase- 3陽性率,正常卵巢組織caspase- 3表達陽性率高,卵巢癌前組織、卵巢癌變組織病例caspase- 3表達陽性率低(表1)。

圖2 不同時期卵巢組織中凋亡相關因子蛋白的表達情況
Fig 2 Expression of apoptosis related factors in ovarian tissues at different stages

A.正常卵巢組織;B.卵巢癌變前組織;C.卵巢癌變組織
A.Normal ovarian tissue; B.Ovarian precancerous tissue; C.Ovarian cancer tissue
圖3 caspase- 3在卵巢組織中的表達
Fig 3 Expression of caspase- 3 in ovarian tissue
表1 caspase- 3在不同期卵巢組織中表達結果
Tab 1 Statistical results of caspase- 3 expression in different stages of ovarian tissue

時 期ncaspase?3表達量/例-+陽性率/%正常卵巢組織1411392.8卵巢癌變前組織1714321.4卵巢癌變組織2117423.5
2.4 不同類型卵巢癌細胞中caspase- 3表達情況
人黏液性卵巢癌細胞3AO中caspase- 3蛋白表達量最高,人卵巢透明細胞癌細胞skov3中caspase- 3蛋白表達量最低,人卵巢透明細胞癌細胞ES- 2中的表達量居中(圖4)。
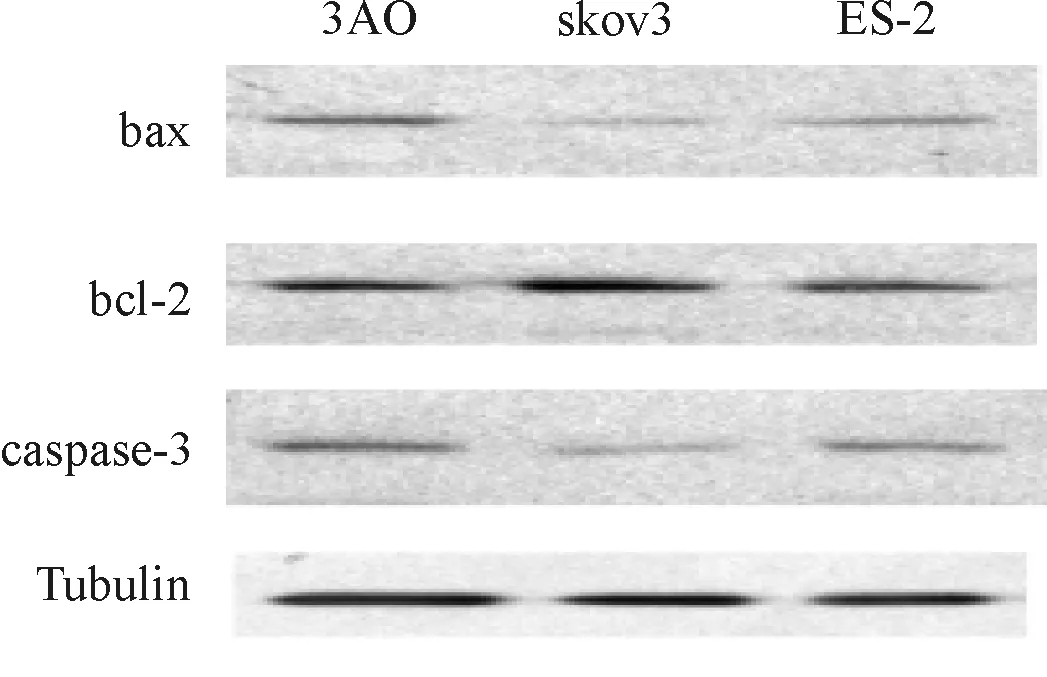
圖4 不同類型卵巢細胞中凋亡相關因子蛋白的表達情況
Fig 4 Expression of apoptosis related factors in different types of ovarian cells
2.5 不同類型卵巢癌細胞對放療的敏感性
用6Galxy照射細胞12、24 h后檢測細胞的數量,結果發現24 h后人黏液性卵巢癌細胞3AO 數量下降最顯著(圖5)。

*P<0.05;**P<0.01
圖5 6Galxy照射細胞12、24 h后不同類型卵巢細胞數量
Fig 5 Different types of ovarian cell number after 6Galxy irradiated cells 12,24 h
2.6 卵巢癌細胞過表達caspase- 3對放射敏感性的影響
caspase- 3過表達后bcl2蛋白量減少,bax蛋白量增加,說明凋亡被再次激活(圖6)。檢測人黏液性卵巢癌細胞3AO照射6Galxy 12、24 h后細胞的數量,結果發現caspase- 3過表達后凋亡通路加強,癌細胞對放射線敏感性變強(圖7)。
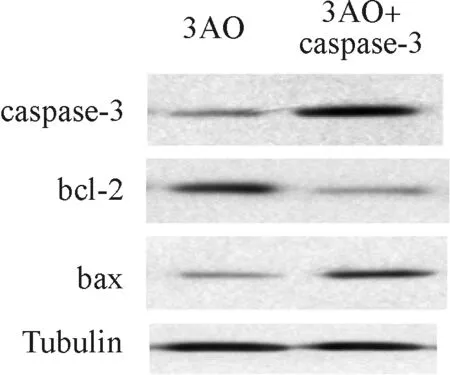
圖6 人黏液性卵巢癌細胞3AO過表達caspase- 3后凋亡因子變化
Fig 6 Changes of apoptosis factor after caspase- 3 overexpression of 3AO in human mucinous ovarian cancer cells
3 討 論
在2015年,估計有21 290例卵巢癌發生在美國,大多數卵巢癌女性發現時已為晚期[14]。只有45.6%的女性在與卵巢癌的斗爭中能存活疾下來,預計2015年,就有14 180人死于卵巢癌[15]。美國黑人女性因不容易診斷卵巢相關疾病而最后大多死于卵巢癌,因此美國黑人女性的生存時間比白人女性短,即使發病階段和時期相同。大多數卵巢癌被認為是散發病例,他們發生在沒有明顯的卵巢癌家族史的婦女,沒有找一個能增強卵巢癌易感性的遺傳突變基因[4]。因此,關于卵巢癌的研究與治療一直比較局限,能在原有治療上增強和完善治療效果尤為重要。
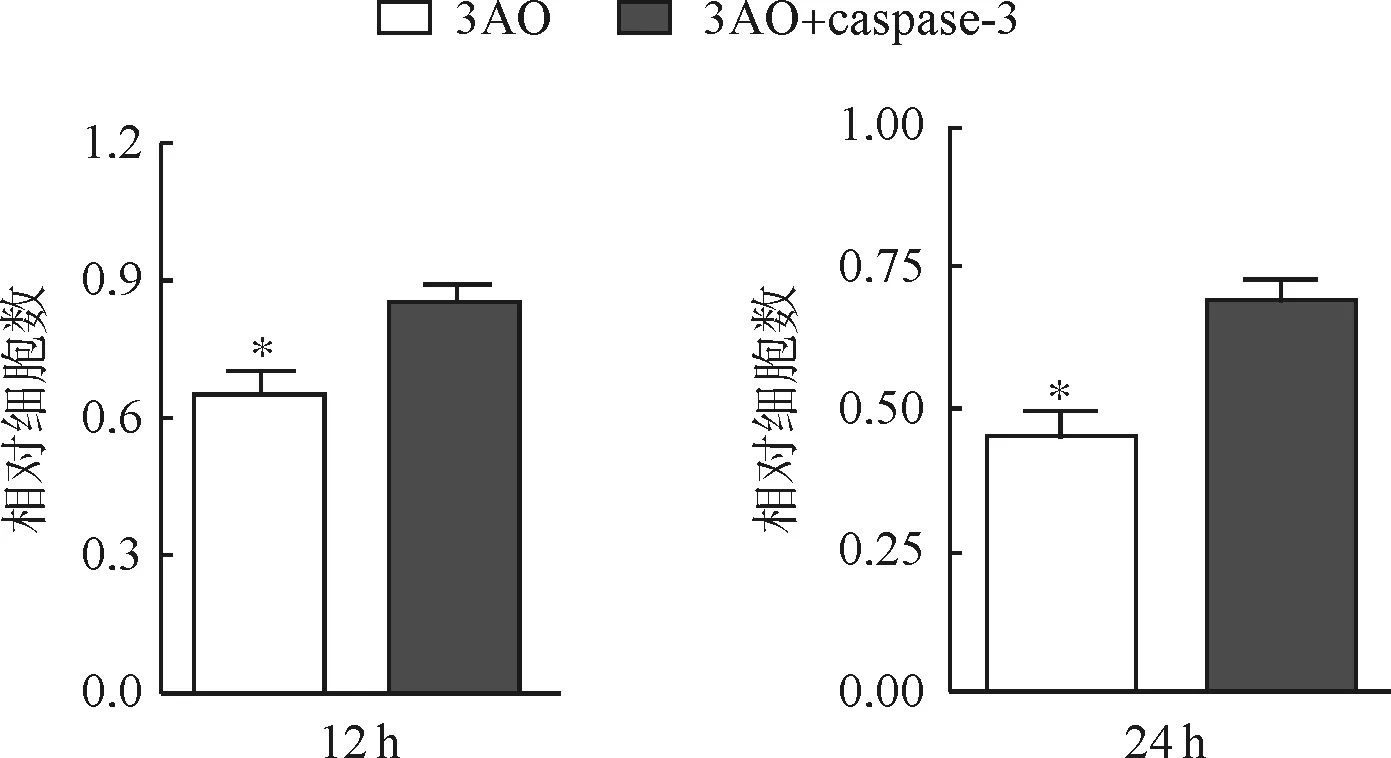
*P<0.05
圖7 人黏液性卵巢癌細胞3AO過表達caspase- 3后對放射的敏感性
Fig 7 The radiation sensitivity of human mucinous ovarian cancer cell line 3AO after caspase- 3 overexpression
放療是比較傳統的治療卵巢疾病的方法,但是因為不同的卵巢癌變類型對放療的敏感性不同,因此作者主要研究不同類型卵巢癌對放療敏感性的問題。結果發現,黏液性卵巢癌比漿液性卵巢癌細胞和卵巢透明細胞癌對放射敏感性要強,并且放射敏感性與凋亡執行蛋白caspase- 3的含量相關[16]。
細胞凋亡的調節是非常復雜的,參與的分子非常多,還有很多需要我們進一步的探索[17]。caspase- 3一直被認為是介導細胞凋亡的關鍵性蛋白酶,也存在一些研究證明caspase- 3能調節細胞內信號轉導[9]。caspase- 3蛋白是普遍存在的,隨著從癌前病變發展至癌caspase- 3蛋白表達量基本呈遞減趨勢[18]。近期,研究表明caspase- 3不但可以直接誘導腫瘤細胞的凋亡,而且可以提高腫瘤細胞的放射敏感性,但其早期診斷和治療仍處于摸索階段。建立快速、靈敏、準確預測癌細胞輻射敏感性的方法,實現腫瘤放射治療的個體化,使用不同生物標志單獨或聯合進行研究,為今后人類治愈卵巢癌提供了基礎。雖然結果與臨床應用還有一定距離,但隨著對卵巢癌發生機制認識的不斷深入,放療前后聯合檢測凋亡相關蛋白在患者癌組織的表達水平和癌細胞凋亡水平的變化[19- 21],篩選判斷腫瘤細胞放療敏感性的指標,最終可使生物標志用于臨床輻射敏感性的預測,針對不同的患者采取個體化的放射治療模式(包括放療的劑量、分割方案的制定、放射增敏藥物的應用等),從而提高卵巢癌放療的治愈率。casepase- 3含量多,凋亡通路更能響應放療,這對臨床放射治療不同類型的卵巢癌細胞具有指導意義。
[1] TROSO- SANDOVAL T A,LICHTMAN S M.Chemotherapy of ovarian cancer in elderly patients[J].Cancer Biology and Medicine,2015,12(4):292- 301.
[2] FELLOW M L J C,ONCOLOGIST B S M.Olaparib for the treatment of epithelial ovarian cancer[J].Expert Opinion on Pharmacotherapy,2016,52(1):995- 1003.
[3] STANLEY S E,RAO A D,GABLE D L,et al.Radiation sensitivity and radiation necrosis in the short telomere syndromes.[J].International Journal of Radiation Oncology Biology Physics,2015,93(5):1115- 1117.
[4] GOH J,MOHAN G R,LADWA R,et al.Frontline treatment of epithelial ovarian cancer[J].Asia- Pacific Journal of Clinical Oncology,2015,11(6):1- 16.
[5] YING T H,YANG S F,TSAI S J,et al.Fisetin induces apoptosis in human cervical cancer HeLa cells through ERK1/2- mediated activation of caspase- 8- /caspase- 3- dependent pathway[J].Archives of Toxicology,2012,86(2):263- 273.
[6] GOSENS M J E M,DRESEN R C,RUTTEN H J T,et al.preoperative radiochemotherapy is successful also in patients with locally advanced rectal cancer who have intrinsically high apoptotic tumours[J].Annals of Oncology,2008,19(12):2026- 2032.
[7] CHIEN W S,CHEN Y H,CHIANG P C,et al.Suppression of autophagy in rat liver at late stage of polymicrobial sepsis[J].Shock,2011,35(5):506- 511.
[8] DURKO A,PLANETA- MALECKA I,KULING A,et al.Is apotosis activity a marker of the imbalances of gastric epithelial proliferation in theH.pylori- associated gastritis in children?[J].Helicobacter,2009,14(4):315.
[9] ZHAO G.Inhibition of caspase- 3,- 6,- 8 and - 9 expression in rats with acute spinal cord injury by cantharidin treatment[J].Tropical Journal of Pharmaceutical Research,2016,15(3):577- 581.
[10] RONSISVALLE S,ARICO G,COVA A M,et al.Caspase- 3 activation in human melanoma A375 cell line by a novel selective sigma- 2 agonist[J].Pharmazie,2016,71(3):146- 151.
[11] ALLEN J E,PRABHU V V,TALEKAR M,et al.Genetic and pharmacological screens converge in identifying FLIP,BCL2,and IAP proteins as key regulators of sensitivity to the TRAIL- inducing anticancer agent ONC201/TIC10[J].Cancer Research,2015,75(8):1668- 1674.
[12] ZHANG S,LIU K,CHENG B,et al.TRAIL inhibits proliferation and promotes apoptosis of 3AO ovarian cancer cells[J].Chinese Journal of Cellular & Molecular Immunology,2014,30(5):453- 457.
[13] LEE G H,YAN C,SHIN S J,et al.BAX inhibitor- 1 enhances cancer metastasis by altering glucose metabolism and activating the sodium- hydrogen exchanger:the alteration of mitochondrial function[J].Oncogene,2010,29(14):2130- 2141.
[14] GASPARRI M L,GRANDI G,BOLLA D,et al.Hepatic resection during cytoreductive surgery for primary or recurrent epithelial ovarian cancer[J].Journal of Cancer Research and Clinical Oncology,2016,142(7):1- 12.
[15] KAJIYAMA H,SHIBATA K,KIKKAWA F.Fertility- sparing surgery in epithelial ovarian cancer[J].Nihon Rinsho Japanese Journal of Clinical Medicine,2012,70:589- 593.
[16] YING T H,YANG S F,TSAI S J,et al.Fisetin induces apoptosis in human cervical cancer HeLa cells through ERK1/2- mediated activation of caspase- 8- /caspase- 3- dependent pathway[J].Archives of Toxicology,2012,86(2):263- 273.
[17] ZHANG Y B,GONG J L,XING T Y,et al.Autophagy protein p62/SQSTM1 is involved in HAMLET- induced cell death by modulating apotosis in U87MG cells[J].Cell Death & Disease,2013,4(3):550.
[18] AISAFADI S,TOURPIN S,BESSOLTANE N,et al.Nuclear localization of the caspase- 3- cleaved form of p73 in anoikis[J].Oncotarget,2015,7(6):8.
[19] COKERGURKAN A,ARISAN E D,OBAKAN P,et al.Inhibition of autophagy by 3- MA potentiates purvalanol- induced apoptosis in Bax deficient HCT 116 colon cancer cells[J].Experimental Cell Research,2014,328(1):87- 98.
[20] 許芙蓉,王海燕,劉韻.卵巢癌SKOV3細胞凋亡的ERK通路介導機制及白藜蘆醇的參與作用研究[J].現代醫學,2016,44(4):469- 473.
[21] 李偉宏.MicroRNA- 200b在卵巢癌組織及血漿中的表達及其對癌細胞侵襲遷移的影響[J].中國現代醫學雜志,2016,26(20):40- 43.
(本文編輯:周蘭波)
The correlation between caspase- 3 mediated apoptosis and radiation sensitivity in ovarian cancer
ZHANG Chun- nian,WANG Jian- zhong
(GanzhouPeople’sHospital,Ganzhou341400,China)
Objective: To study the caspase- 3 mediated apoptosis in ovarian cancer, and the relationship between the caspase- 3 expression and radiation sensitivity. Methods: Through the clinical ovarian tissue samples collected at different periods and apoptosis related gene mRNA and protein detection, and immunohistochemical legal, quantitative caspase- 3 protein changes in ovarian cancer in different periods, the apoptosis in ovarian cancer in different periods was studied. By rays irradiation, and then the number of cells was counted, in order to study different types of ovarian cancer cells radiation sensitivity. Results: Immunohistochemistry, PCR, Western Blot, results with ovarian cells canceration showed that survival bcl- 2 genes of apoptosis was activated, lethal gene bax of apoptosis was inhibited, the apoptosis protein caspase- 3 declined. At the same time, rays irradiation and statistical results showed that the different types of ovarian cancer cells to radiation sensitivity were different. Conclusion: Caspase- 3 protein quantitied with ovarian canceration is declining, but for ovarian cancer cells, the more caspase- 3 protein is, the stronger radiation sensitivity is.
ovarian cancer; apoptosis; caspase 3; radiation sensitivity
2016- 09- 27
2016- 12- 17
江西省自然科學基金資助項目(2010JX02228)
張春年(1978-),女,江西南康人,主治醫師,醫學碩士。E- mail:hex518000@126.com
張春年,王建中.介導細胞凋亡的caspase- 3在卵巢癌中的表達和放療敏感性的關聯性研究[J].東南大學學報:醫學版,2017,36(2):176- 181.
R737.31
A
1671- 6264(2017)02- 0176- 06
10.3969/j.issn.1671- 6264.2017.02.009

