結締組織生長因子CT結構域的原核表達及分離純化
薛秀蕾,范小波,吳國球
(1.東南大學醫學院,江蘇 南京 210009; 2. 東南大學附屬中大醫院,江蘇 南京 210009)
·論 著·
結締組織生長因子CT結構域的原核表達及分離純化
薛秀蕾1,范小波1,吳國球2
(1.東南大學醫學院,江蘇 南京 210009; 2. 東南大學附屬中大醫院,江蘇 南京 210009)
目的:構建pET32a- TrxA- His- CTGF- CT原核表達載體,實現重組CTGF- CT的可溶性表達及分離純化,以用于制備CTGF- CT抗體。方法:基因合成CTGF- CT序列,利用NcoI和XhoI限制性內切酶雙酶切后插入pET32a載體,構建pET32a- TrxA- His- CTGF- CT重組質粒,陽性質粒轉化E.colistrain BL21(DE3)細胞,通過異丙基β- D- 硫代半乳糖苷(IPTG)誘導獲得重組融合蛋白,利用鎳柱親和純化及腸激酶酶切純化獲得目的蛋白CTGF- CT,SDS- PAGE鑒定蛋白純度并進行Western blotting分析。結果:所構建pET32a- TrxA- His- CTGF- CT重組質粒驗證正確。經誘導表達獲得了與預期分子量(28 kD)一致的融合蛋白,融合蛋白經腸激酶切割及兩次鎳柱親和純化獲得目的蛋白CTGF- CT,純化后純度約95%,Western blotting分析表明純化目的蛋白為CTGF- CT。結論:通過構建原核pET32a- TrxA- His- CTGF- CT表達載體實現了重組CTGF- CT蛋白的表達及分離純化,為CTGF- CT抗體的制備和CTGF- CT功能的深入研究打下了基礎。
結締組織生長因子; 原核表達; 蛋白純化
結締組織生長因子(connective tissue growth factor, CTGF)是高度保守的即刻早期基因(CCN)多肽家族成員之一,在細胞增殖、合成膠原、介導細胞黏附和趨化、誘導細胞凋亡、促進血管和肉芽組織形成等多方面均發揮著重要作用[1]。CTGF蛋白有4個功能結構域[2],依次為胰島素樣生長因子結合蛋白區(IGFBP)、VWF(von willebrand factor)因子的C型重復區(VWC)、血小板反應蛋白I型(TSP- 1)重復區和富含半胱氨酸的C末端(CT區)。其中,CT結構域和受體結合相關[2]。越來越多的研究表明,CT結構域在誘導細胞黏附[3]、調節轉錄[4]、信號通路激活[5- 6]等方面發揮重要的生物學作用。
本研究目的主要是利用基因工程技術構建CTGF- CT原核表達載體表達純化融合蛋白,并經過鎳親和層析純化融合蛋白、腸激酶酶切回收等步驟制備目的蛋白CTGF- CT,經SDS- PAGE、ELISA和Western blotting等分析鑒定所制備的重組CTGF- CT蛋白,為CTGF- CT抗體的制備提供良好的抗原,同時為CTGF- CT的功能研究打下基礎。
1 實驗材料
1.1 載體和菌株
E.colistrain BL21(DE3)菌株購自New England Biolabs公司(Beverly MA,USA),pET32a質粒載體購自Novagen公司(Madison Wisconsin,USA),pET32a- TrxA- His- CTGF- CT載體由本實驗室構建。
1.2 主要試劑
限制性內切酶(NcoI和XhoI等)及T4 DNA連接酶購自New England Biolabs公司;抗- CTGF單克隆抗體購自R&D SYSTEMS;抗鼠HRP- IgG抗體購自Jackson Imm- unoResearch Laboratories;TRYPTONE(胰蛋白胨)、YEAST EXTRACT(酵母提取物)等發酵培養基成分均來源于OXOID公司;異丙基β- D- 硫代半乳糖(IPTG)、腸激酶、氨芐青霉素、質粒快速提取試劑盒和Ni- IDA親和層析介質來源于南京金斯瑞生物科技有限公司;預染蛋白質標準品來源于Thermo Fisher Scientific;透析袋和超濾管購自Millipore公司;BCA蛋白濃度測定試劑盒購自碧云天生物技術研究中心;其他試劑均為國產分析純。
2 實驗方法
2.1 CTGF- CT基因的合成及pET32a- CTGF- CT表達載體的構建
利用GenBank檢索并下載人CTGF基因序列(ACCESSION:CR541734.1),根據其中CTGF- CT序列和大腸桿菌密碼子偏愛性得到cDNA序列,設計PCR引物并基因合成目的CTGF- CT序列,引物F:GATCTGGGTACCGACGACGACGACAAGGCCATGGAAGAGAACATTAAGAAGGGCAAAA;引物R:AGCCGGATCTCAGTGGTGGTGGTGGTGGTGCTCGAGTTATGCCATGTCTCCGTACATCTTC。基因合成產物和pET32a載體用NcoI和XhoI限制內切酶酶切,連接兩個片段組成原核表達載體pET32a- TrxA- His- CTGF- CT。轉化大腸桿菌E.colistrain BL21(DE3),挑選陽性克隆提取質粒并進行測序驗證。pET32a- CTGF- CT表達載體構建示意圖見圖1。
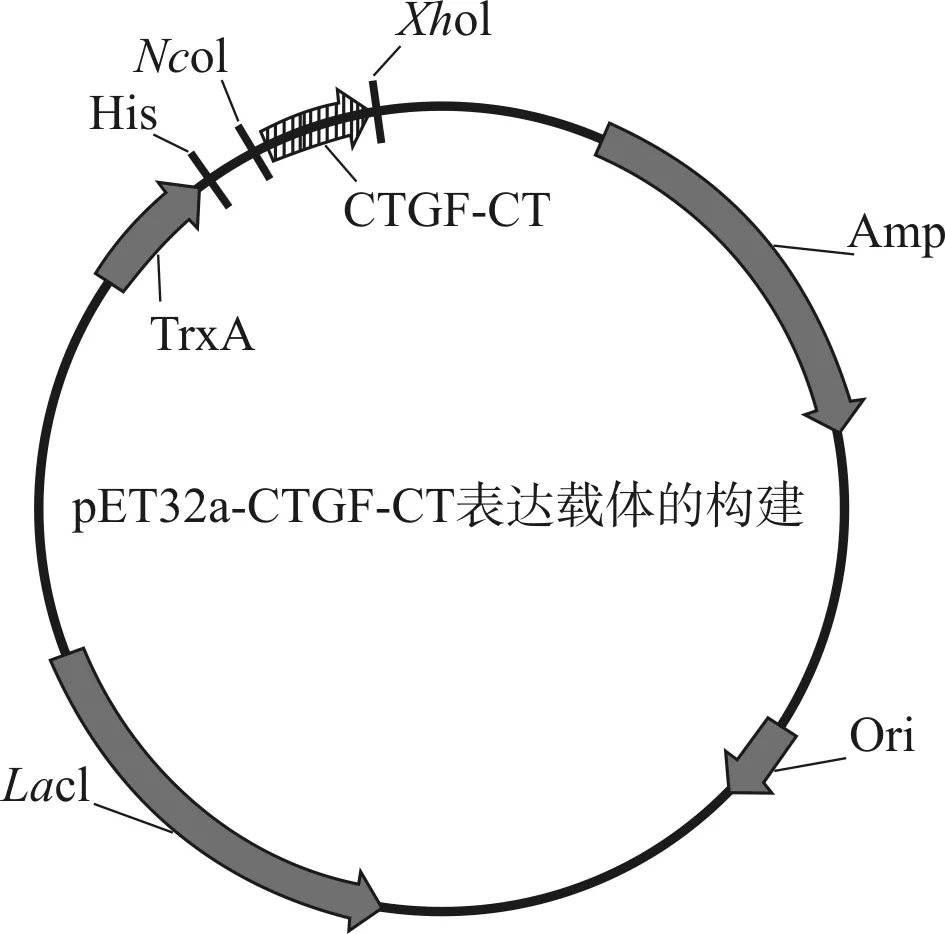
圖1 pET32a- TrxA- His- CTGF- CT表達載體的構建
2.2 CTGF- CT蛋白的表達及純化
將pET32a- TrxA- His- CTGF- CT重組質粒轉化至E.colistrain BL21(DE3)感受態細胞,挑取單克隆至5 ml含100 mg·ml-1Amp的LB液體培養基內,37 ℃ 200 r·min-1振蕩培養12 h作為種子液,次日按照1 ∶100的比例接種于200 ml含Amp(100 mg·ml-1)的LB液體培養基內,37 ℃ 220 r·min-1培養2~3 h至OD600值為0.6~0.8,取1 ml培養物作為誘導前對照樣品;向剩余培養物中加入IPTG至終濃度為0.5 mmol·L-1,20 ℃ 160 r·min-1誘導培養8 h,收集菌體。每克濕重的菌體加入5 ml細菌裂解液(100 mmol·L-1NaH2PO4·2H2O,10 mmol·L-1Tris,2 mmol·L-1EDTA,pH 8.0)進行充分懸浮,冰浴下超聲波破碎菌體后4 ℃ 12 000 r·min-1離心20 min,將收集的上清樣品用Ni- IDA親和層柱進行純化獲得融合蛋白(TrxA- His- CTGF- CT),BCA法對可溶表達的融合蛋白進行定量檢測。透析后融合蛋白樣品加入酶切緩沖液后每1 mg目的蛋白加入2 U腸激酶,4 ℃酶切10 h,利用TrxA- His與CTGF- CT標簽的差異性特點再次利用鎳柱純化并分離獲得目的蛋白(CTGF- CT),BCA法進行定量,收集目的蛋白冷凍干燥后保存。上述原核表達及純化過程中得到的樣品均進行SDS- PAGE分析。
2.3 重組蛋白CTGF- CT的分析
CTGF- CT目的蛋白的Western blotting檢測:根據目的蛋白分子量,采用10%分離膠和5%濃縮膠進行SDS- PAGE凝膠電泳,冰浴下恒流200 mA,電轉移1 h;封閉后加入抗CTGF單克隆抗體(1∶1 500),置振蕩器孵育,4 ℃過夜后PBST漂洗濾膜4次;將PVDF膜置于羊抗鼠HRP-IgG抗體(1∶1 500)溶液中,室溫下搖蕩標記1.5h后PBST漂洗濾膜5次;ECL顯色觀察結果。
3 實驗結果
3.1 pET32a- TrxA- His- CTGF- CT重組質粒的鑒定
利用NcoI和XhoI限制性內切酶對引物F、引物R所合成基因產物和pET32a載體同時進行雙酶切,連接回收后片段構建成重組表達載體pET32a- TrxA- His- CTGF- CT。將陽性轉化克隆中所提取質粒利用NcoI和XhoI雙酶切,結果在圖2中可見大小分別為5 kb和400 bp左右的條帶,其中400 bp左右的條帶為特征性片段。同時,DNA測序證實CTGF- CT閱讀框正確無誤,表明pET32a- TrxA- His- CTGF- CT重組質粒表達載體構建成功。

M.DNA分子量標準; 1. pET32a- TrxA- His- CTGF- CT質粒; 2. pET32a- TrxA- His- CTGF- CT質粒雙酶切
圖2 pET32a- TrxA- His- CTGF- CT表達載體的酶切鑒定
3.2 CTGF- CT蛋白的表達及純化
將IPTG(0.5 mmol·L-1)誘導表達1、2、4、6、8 h后的菌體裂解后超聲破碎,離心后所獲上清和沉淀分別進行SDS- PAGE分析,結果顯示在28 kD左右有目標重組蛋白表達且與融合蛋白理論分子量相符,重組融合蛋白的表達大部分以可溶性形式存在于上清(圖3)。利用BCA法測得融合蛋白在3次洗脫液中的濃度分別為2.63、1.36和1.13 mg·ml-1,3次洗脫液體積分別為500、400和300 μl,計算得出1 L菌液共收獲6.20 mg可溶融合蛋白(TrxA- His- CTGF- CT)。
重組表達載體pET32a- TrxA- His- CTGF- CT的構建是在pET32a(+)載體上利用NcoI和XhoI酶切位點插入目的蛋白CTGF- CT基因,使其以TrxA- His- CTGF- CT融合蛋白的形式表達。利用His- Tag與Ni- IDA親和層析介質的結合進行融合蛋白的純化簡便有效,融合蛋白進行Western blotting分析(圖4 Lane 2)。經腸激酶酶切后融合蛋白被酶切為TrxA- His和CTGF- CT,酶切反應液利用固定金屬親和層析(IMAC)進一步純化,從凝膠層析流出液中收集目的CTGF- CT蛋白(圖5 Lane 2),BCA法蛋白定量檢測計算得出1 L菌液共收獲2.31 mg目的蛋白CTGF- CT。
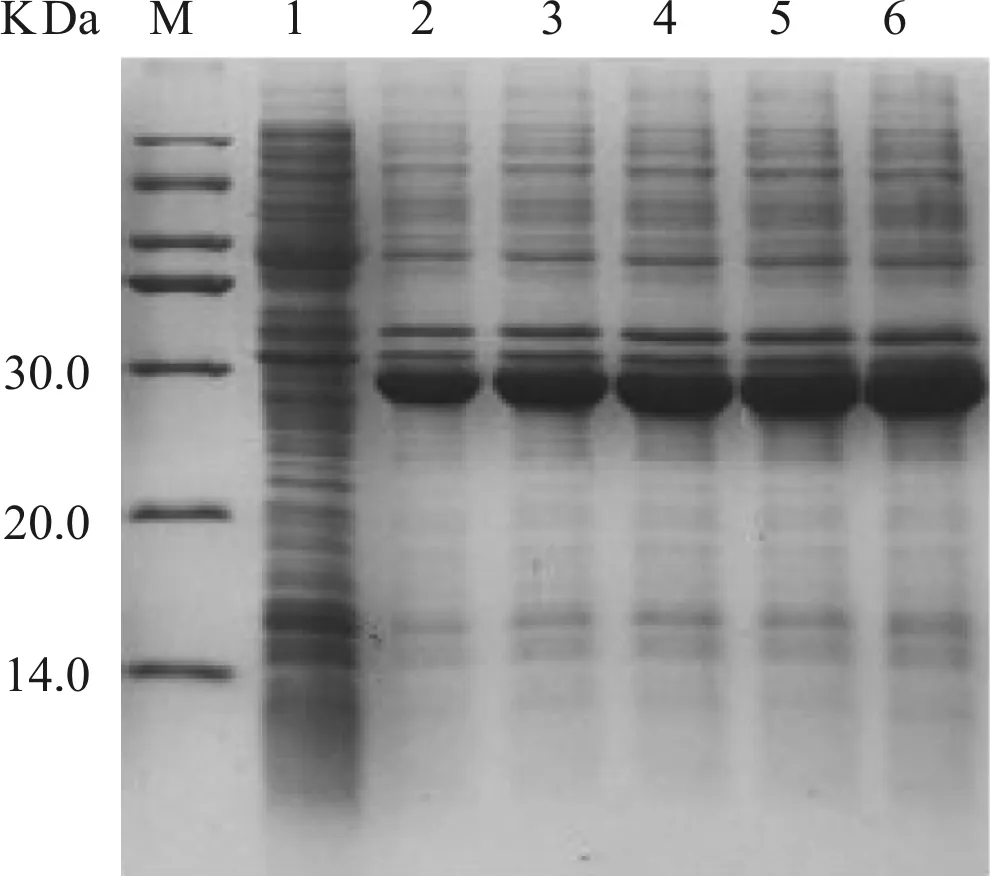
M.蛋白標準品; 1.未加誘導劑菌體對照; 2~6.誘導1、2、4、6和8 h菌體超聲后上清
圖3 重組質粒在大腸桿菌BL21(DE3)中表達的SDS- PAGE分析
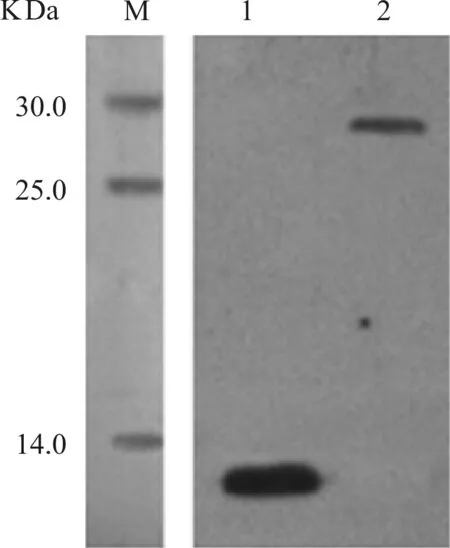
M.蛋白標準品; 1.純化的CTGF- CT; 2.純化的融合蛋白
圖4 融合蛋白及目的蛋白純化后Western blotting分析
3.3 重組蛋白CTGF- CT的分析
利用直接ELISA檢測純化所得CTGF C端CT區即CTGF- CT的活性(圖6),Western blotting鑒定純化所獲蛋白(圖4 Lane 1)。
4 討 論
CTGF(CCN2)是由349個氨基酸殘基組成的分泌性多肽,分子量為36~38 kDa。CTGF可以促進細胞增殖[7- 8]及細胞外基質的形成[2],在介導細胞黏附[1]、遷移[9]、炎癥[10- 11]及促進血管形成中發揮廣泛的作用[1- 2]。CTGF的C端即CT區功能結構域在促進細胞黏附[3,12]、激活促炎癥因子[6]、調節轉錄[4]、激活信號通路[5]、直接介導CTGF與整合素受體之間的結合[13]等方面發揮重要作用。因此,本研究關注CTGF的C端結構域即CT區(CTGF- CT)的表達純化,制備生產足量優質的CTGF- CT重組蛋白,以利于后續相關特異性抗體研究和功能研究。
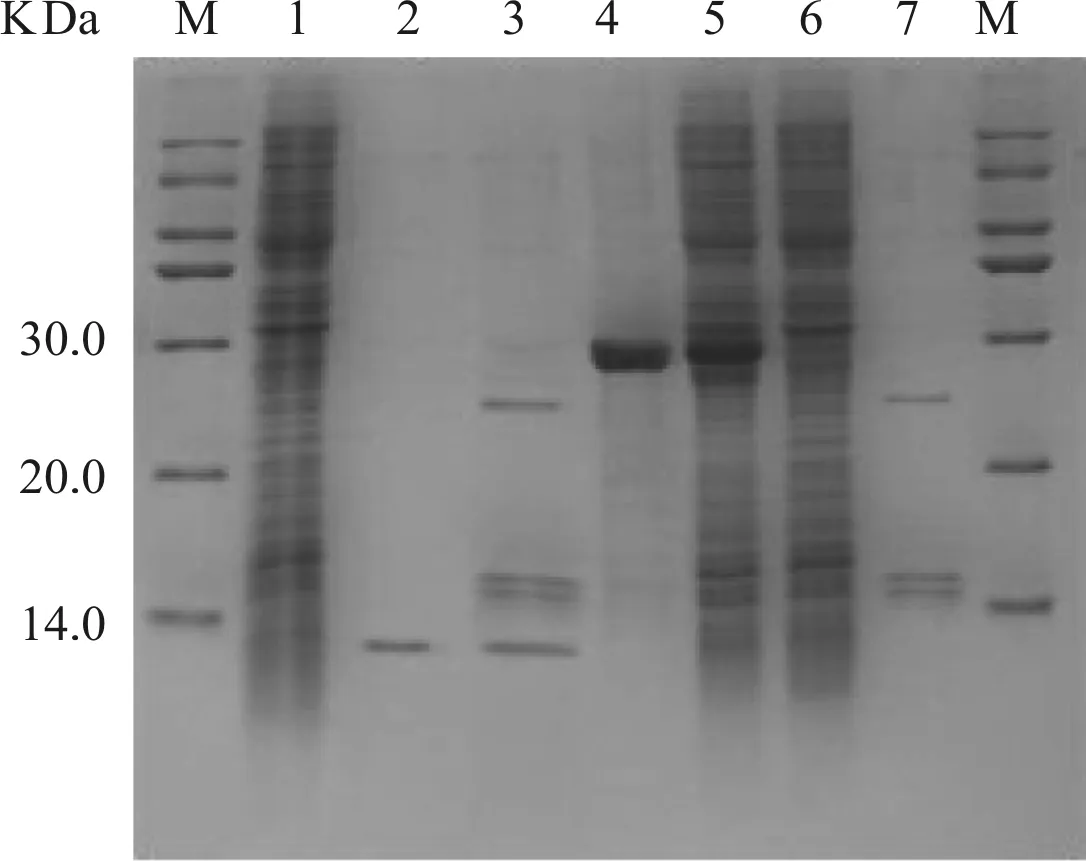
M.蛋白標準品; 1、6.未加誘導劑對照; 2.腸激酶切割液上鎳柱后流出液;3.腸激酶切割液; 4.鎳柱純化的融合蛋白TrxA- His- CTGF- CT; 5.誘導后菌體蛋白; 7.腸激酶切割液上鎳柱后洗脫液
圖5 融合蛋白及目的蛋白純化的SDS- PAGE分析

圖6 ELISA檢測表達蛋白的活性
E.coli系統遺傳圖譜明確、操作簡便易行、生產成本較低,且對許多蛋白質有很強的耐受力,是許多重組蛋白的首選表達系統。在E.coli表達系統中,融合蛋白表達系統可提高目的蛋白的產量、減少蛋白質的錯誤折疊和包涵體的形成、方便后續分離純化。本實驗選用IPTG誘導啟動子表達載體(pET32a),構建pET32a- TrxA- His- CTGF- CT原核表達載體,CTGF- CT目的蛋白N端融合硫氧還蛋白(TrxA)并引入組氨酸標簽,方便進行重組蛋白CTGF- CT的體外表達及純化,以期獲得可溶表達的重組蛋白。分子伴侶TrxA的引入可以幫助外源蛋白成功表達、降低宿主細胞對外源蛋白的降解從而可以大大提高蛋白表達產量、可溶性[14]及穩定性[15];利用組氨酸標簽與Ni2+相互作用進行親和層析純化,簡便有效;pET32a帶有pBR322的大腸菌素E1(colE1)復制區,賦予宿主菌氨芐青霉素抗性,有利于陽性克隆子的篩選;為方便后續純化,pET32a載體中XhoI酶切位點后的His- Tag已去除,僅保留Trx- Tag后的His- Tag。本研究所構建pET32a- TrxA- His- CTGF- CT重組質粒轉化E.coliBL21(DE3)IPTG誘導表達并純化得到純度大于90%的可溶性TrxA- His- CTGF- CT融合蛋白,在大腸桿菌成功表達。SDS- PAGE結果顯示目標蛋白表達位于28 kD處,這與融合蛋白TrxA- His- CTGF- CT的理論分子量一致,且大部分為可溶蛋白表達形式。
本實驗中表達的融合蛋白TrxA- His- CTGF- CT的N- 末端連接有His標簽,利用鎳親和層析柱純化融合蛋白,結果顯示融合蛋白純度達90%以上;TrxA- His- CTGF- CT融合蛋白中His- Tag與CTGF- CT間為腸激酶酶切位點,利用腸激酶的識別酶切對融合蛋白進行切割,利用鎳親和層析對酶切反應液再次進行分離純化即可獲得目的蛋白CTGF- CT。從圖4 SDS- PAGE結果中Lane 4、Lane 5和Lane 7可以看出融合蛋白被腸激酶識別切割;酶切下的CTGF- CT不含His- Tag,因此在融合蛋白第2次鎳親和層析純化過程中,可在流穿液中收集即可獲得目的蛋白CTGF- CT,SDS- PAGE分析顯示其純度大于95%。利用上述純化方法可在1 L菌液中獲得毫克級別的重組蛋白。ELISA檢測結果顯示,融合蛋白與Anti- CTGF具有良好的結合活性;去除TrxA、His等氨基酸后CTGF- CT與Anti- CTGF結合未受影,仍具有良好的結合活性。同時Western blotting分析驗證了融合蛋白TrxA- His- CTGF- CT和目的蛋白CTGF- CT。
因此,我們純化得到了理想的CTGF- CT蛋白,可用于后續相關研究工作,同時為進一步研究CTGF- CT的功能奠定了基礎。
[1] PERBAL B.CCN proteins:multifunctional signalling regulators[J].Lancet,2004,363(9402):62- 64.
[2] SHI- WEN X,LEASK A,ABRAHAM D.Regulation and function of connective tissue growth factor/CCN2 in tissue repair,scarring and fibrosis[J].Cytokine Growth Factor Rev,2008,19(2):133- 144.
[3] GAO R,BRIGSTOCK D R.Connective tissue growth factor(CCN2) induces adhesion of rat activated hepatic stellate cells by binding of its C- terminal domain to integrin alpha(v)beta(3) and heparan sulfate proteoglycan[J].J Biol Chem,2004,279(10):8848- 8855.
[4] BLEAU A M,PLANQUE N,LAZAR N,et al.Antiproliferative activity of CCN3:involvement of the C- terminal module and post- translational regulation[J].J Cell Biochem,2007,101(6):1475- 1491.
[5] STEPHENS S,PALMER J,KONSTANTINOVA I,et al.A functional analysis of Wnt inducible signalling pathway protein- 1(WISP- 1/CCN4)[J].J Cell Commun Signal,2015,9(1):63- 72.
[6] RODRIGUES- DIEZ R R,GARCIA- REDONDO A B,OREJUDO M,et al.The C- terminal module Ⅳ of connective tissue growth factor,through EGFR/Nox1 signaling,activates the NF- kappaB pathway and proinflammatory factors in vascular smooth muscle cells[J].Antioxid Redox Signal,2015,22(1):29- 47.
[7] IVKOVIC S,YOON B S,POPOFF S N,et al.Connective tissue growth factor coordinates chondrogenesis and angiogenesis during skeletal development[J].Development,2003,130(12):2779- 2791.
[8] 周曉明,毛幸,吳小濤.Yes相關蛋白在腫瘤中作用的研究進展[J].現代醫學,2016,44(4):561- 564.
[9] AGUIAR D P,de FARIAS G C,de SOUSA E B,et al.New strategy to control cell migration and metastasis regulated by CCN2/CTGF[J].Cancer Cell Int,2014,14:61.
[10] MIYASHITA T,MORIMOTO S,FUJISHIRO M,et al.Inhibition of each module of connective tissue growth factor as a potential therapeutic target for rheumatoid arthritis[J].Autoimmunity,2016,49(2):109- 114.
[11] NOZAWA K,FUJISHIRO M,TAKASAKI Y,et al.Inhibition of rheumatoid arthritis by blocking connective tissue growth factor[J].World J Orthop,2014,5(5):653- 659.
[12] BALL D K,RACHFAL A W,KEMPER S A,et al.The heparin- binding 10 kDa fragment of connective tissue growth factor(CTGF) containing module 4 alone stimulates cell adhesion[J].J Endocrinol,2003,176(2):R1- 7.
[13] HOSHIJIMA M,HATTORI T,INOUE M,et al.CT domain of CCN2/CTGF directly interacts with fibronectin and enhances cell adhesion of chondrocytes through integrin alpha5beta1[J].FEBS Lett,2006,580(5):1376- 1382.
[14] HUANG L,LEONG S S,JIANG R.Soluble fusion expression and characterization of bioactive human beta- defensin 26 and 27[J].Appl Microbiol Biotechnol,2009,84(2):301- 308.
[15] MCCOY J,LAVILLE E.Expression and purification of thioredoxin fusion proteins[M].Massachusetts:John Wiley & Sons,Inc.,2001:16.8.1- 16.8.13.
(本文編輯:周蘭波)
Prokaryotic expression and purification of connective tissue growth factor(CT domain) inE.coli
XUE Xiu- lei1,FAN Xiao- bo1,WU Guo- qiu2
(1.MedicalSchoolofSoutheatUniversity,Nanjing210009,China; 2.ZhongdaHospital,SoutheastUniversity,Nanjing210009,China)
Objective: To construct the recombinant pET32a- TrxA- His- CTGF- CT plasmid and to express and purify CT domain of connective tissue growth factor(CTGF) in order to prepare CTGF- CT polyclonal antibody. Methods: The nucleotide sequence encoding CTGF- CT was chemically synthesized and inserted into the pET- 32a(+) vector. The constructed pET32a- TrxA- His- CTGF- CT plasmid was transformed intoE.colistrain BL21(DE3). And the TrxA- CTGF- CT fusion protein was induced expression by IPTG; Then CTGF- CT was purified by enterokinase cleavage and Ni- NTA purification and was identified by SDS- PAGE and Western blotting. Results: The authenticity of the recombinant pET32a- TrxA- CTGF- CT- His plasmid was verified by DNA sequencing and it was identified containning a 400 bp fragment byNcoI andXhoI double digestion. The molecular weight of TrxA- CTGF- CT was about 28 kD after IPTG induced expression. After enterokinase cleavage and Ni- NTA purification, the CTGF- CT was obtained as expected molecular weight of 14 kD. Western blotting proved that the protein was CTGF- CT. The purity of the recombinant CTGF- CT was about 95%. Conclusion: The construction of pET32a- TrxA- His- CTGF- CT and the expression and purification of CTGF- CT are successfully achieved. That will lay the foundations for preparation of CTGF- CT antibody and the further study on the function of CTGF- CT.
connective tissue growth factor; prokaryotic expression; protein purification
2016- 09- 08
2016- 12- 06
薛秀蕾(1984-),女,山東聊城人,醫學博士。E- mail: xiulei_xue@163.com
吳國球 E- mail: nationball@163.com
薛秀蕾,范小波,吳國球. 結締組織生長因子CT結構域的原核表達及分離純化[J].東南大學學報:醫學版,2017,36(2):230- 234.
R- 33; R393
A
1671- 6264(2017)02- 0230- 05
10.3969/j.issn.1671- 6264.2017.02.020

