內毒素對人牙周膜成纖維細胞增殖及IL-8分泌的影響
付昌盛 劉榮森 羅蕓 歐龍 李穎超 張賢華 王珺 杜巖
內毒素對人牙周膜成纖維細胞增殖及IL-8分泌的影響
付昌盛 劉榮森 羅蕓 歐龍 李穎超 張賢華 王珺 杜巖
目的:觀察不同濃度的內毒素(lipopolysaccharides,LPS)對牙周膜成纖維細胞增殖的影響及IL-8的分泌情況。方法:本實驗共分為七組,牙周膜成纖維細胞(hum an periodon tal ligam ent fibroblasts,hPDLFs)組、PDLFs+10μg/m l堿性成纖維細胞生長因子(Basic Fibroblast Grow th Factor,BFGF)組、1μg/m l LPS組、10μg/m l LPS組、100μg/m l LPS組、200μg/m l LPS組、500μg/m l LPS組。各組細胞進行培養,MTT法觀察細胞增殖變化。取培養24h,96h的細胞上清液進行IL-8 ELISA 檢測。結果:與空白組牙周膜成纖維細胞相比,24h:1μg/m l LPS、10μg/m l LPS、100μg/m l LPS組無統計學差異。200μg/m l LPS、500μg/m l LPS組促進IL-8分泌,有顯著性統計學差異。96h:與牙周膜成纖維細胞相比,1μg/m l LPS、10μg/m l LPS組無統計學差異。100μg/m l LPS、200μg/m l LPS組促進IL-8分泌,100μg/m l LPS、200μg/m l LPS組之間無統計學差異。500μg/m l LPS組抑制IL-8分泌,有顯著性統計學差異。細胞增殖變化:BFGF促進牙周膜成纖維細胞增殖。1μg/m l LPS、100μg/m l LPS組與正常牙周膜成纖維生長增殖無差異。10μg/m l LPS可以促進牙周膜成纖維細胞增殖。200μg/m l LPS、500μg/m l LPS明顯抑制PDLFs增殖。結論:不同濃度的內毒素對牙周膜成纖維細胞增殖、IL-8分泌合成釋放有調節作用。
內毒素;牙周膜成纖維細胞;IL-8
牙周膜成纖維細胞(hum an periodon tal ligam ent fibrob lasts,hPDLFs),作為牙周膜中最主要的細胞成分之一,在牙周病發生發展過程中起著十分重要的作用[1]。在牙周炎各階段,它既有修復作用,又可以影響生成分泌各類炎癥因子[1],是研究牙周炎發病機制的重要細胞之一。白介素-8(IL-8)在牙周炎的免疫反應中起到中樞作用,作為一種能趨化中性多形核白細胞、T淋巴細胞和單核細胞等免疫細胞的細胞因子,它能夠介導局部炎癥反應[2],對于研究內毒素耐受對牙周組織的炎癥和免疫反應的影響具有非常重要的意義。
內毒素即脂多糖(lipopolysaccharides,LPS)對牙周膜成纖維細胞劑效關系及IL-8分泌的研究較少。本實驗旨在觀察牙周膜成纖維細胞在不同濃度內毒素刺激下其細胞增殖以及IL-8分泌合成釋放的研究。對內毒素刺激下PDLFs模型的建立進行探索,為治療控制牙周炎發生發展提供資料。
1.材料和方法
1.1 材料DMEM培養基(GE,美國);10%胎牛血清(FBS)、0.25%胰蛋白酶(thermo,美國);100U/m l青霉素、100U/m l鏈霉素(灝洋,中國);PBS溶液(北京中杉金橋生物技術有限公司);5% MTT溶液(R&D公司,美國);內毒素標準品、堿性成纖維細胞生長因子、Tris溶液、二甲基亞砜(DMSO)(Sigma,美國);I型膠原酶、角蛋白單抗、波形絲蛋白單抗體、SABC免疫組化試劑盒、IL-8 ELISA 試劑盒(博士德生物工程有限公司,中國);針頭濾器0.22μm(m illipore,美國);去離子水。
1.2 牙周膜成纖維細胞培養
1.2.1 納入排除標準選擇解放軍總醫院口腔頜面外科因正畸要求拔除的12-16歲的健康的無齲病、牙髓病、根尖周病、牙周疾病,未進行過治療的前磨牙。所有患者無全身系統性疾病,無吸煙史,半年內未服用過抗生素。所得牙齒均征得患者及家長同意,并簽署知情同意書。該實驗已得到解放軍總醫院倫理委員會批準。(倫理委員會審批批號:倫理第S2015-097-02號)
1.2.2 人牙周膜成纖維細胞培養及鑒定無菌條件下刮除根中1/3牙周膜進行培養,加入0.2%I型膠原酶進行震蕩消化,10%胎牛血清高糖培養基培養后,CO2恒溫箱孵育。每3天換液,直至細胞爬出,培養2-3周,待細胞生長達80%進行傳代。培養3-6代牙周膜成纖維細胞用于實驗。牙周膜成纖維細胞鑒定同本實驗室組[3]。
1.3 溶液配制LPS溶液:按說明用PBS配置成1μg/m l LPS、10μg/m l LPS、100μg/m l LPS、200μg/m l LPS、500μg/m l LPS,針頭濾器過濾,備用。
堿性成纖維細胞生長因子(BFGF):按說明用Tris溶液溶解成10μg/m l的BFGF溶液備用。
1.4 分組本實驗共分為7組,每組6個樣本。第一組PDLFs、第二組PDLFs+10μg/m l BFGF、第三組1μg/m l LPS、第四組10μg/m l LPS、第五組100μg/m l LPS、第六組200μg/m l LPS、第七組500μg/m l LPS、觀察各組牙周膜成纖維細胞在不同濃度的LPS微環境下細胞生長增殖以及IL-8分泌合成釋放情況。
1.5 MTT檢測牙周膜成纖維細胞生長增殖將第5代牙周膜成纖維細胞4×103/m l每孔接種于96孔板,PDLFs接種培養24h,鏡下觀察牙周膜成纖維細胞貼壁、生長狀態良好,于24h、48h、72h、96h時間點檢測其牙周膜成纖維細胞生長增殖。方法:吸凈培養液,PBS溶液漂洗2遍,每孔加MTT溶液20μl。37度培養箱內孵育4h,吸凈MTT液。每孔依次加150μl二甲基亞砜,振蕩10m in,使結晶物能夠充分融解。酶聯免疫監測儀于490nm波長下測定各孔吸光度(OD值),記錄結果,以時間為橫坐標,吸光度值為縱坐標繪制細胞生長曲線。
1.6 IL-8 的檢測將第5代牙周膜成纖維細胞4×103/m l每孔接種于96孔板,PDLFs接種培養24h,鏡下觀察牙周膜成纖維細胞貼壁、生長狀態良好,取24h、96h細胞培養上清液,離心后-80度保存,采用ELISA法檢測IL-8因子的分泌合成釋放情況。ELISA法檢測步驟如下:配置標準品,加入樣品標準品至96孔板,空白組為樣品稀釋液。酶標板封膜后37度反應90m in。甩去酶標板內液體,每孔加抗體工作液,空白孔除外。酶標板封膜后37度反應60m in。一倍洗滌液洗3次,每次浸泡1m in。加入親和素-過氧化物酶復合物工作液(空白孔除外)。酶標板封膜反應30m in。一倍洗滌液洗5次,每次浸泡1-2m in。每孔加入90ul顯色液,37度避光20-25m in。每孔加入100μl終止液,酶標儀在450nm測定吸光度值。
1.7 統計學方法本實驗數據采用SPSS18.0進行統計分析,細胞生長增殖采取重復測量方差分析,IL-8因子的分泌合成釋放采用組間單因素方差分析后與對照組比較。
2.結果
2.1 細胞增殖情況(見表1,圖1-4) BFGF刺激的牙周膜成纖維細胞生長呈線性上升,證明PDLFs與BFGF有著良好的應答關系。與PDLFs組相比,1μg/m l LPS組、100μg/m l LPS組無統計學意義(P>0.05);10μg/m l LPS組促進牙周膜成纖維細胞生長,有顯著性統計學差異(P<0.01);200μg/m l LPS組、500μg/m l LPS組抑制牙周膜成纖維細胞生長,有顯著性統計學差異(P<0.01)。統計學差異(P>0.05)。200μg/m l LPS、500μg/m l LPS組促進IL-8分泌,有顯著性統計學差異(P<0.01)。

圖1 96h,500μg/m l LPS組(×200)

圖2 96h,正常PDLFs組(×200)

圖3 96h,BFGF組(×200)
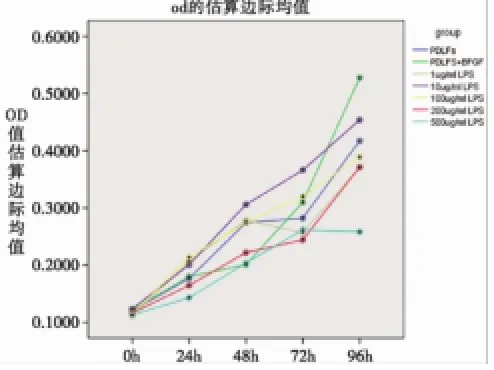
圖4 MTT法檢測各組不同時間點細胞增殖能力

表2 不同濃度LPS刺激細胞后各組IL-8分泌測量OD值(n=6)

表1 MTT法檢測各組不同時間點細胞增殖能力(n=6)
2.2 與牙周膜成纖維細胞相比,IL—8分泌合成釋放情況(見表2,表3,圖5,圖6)
2.2.1 (24h)與正常牙周膜成纖維細胞組相比1μg/m l LPS、10μg/m l LPS、100μg/m l LPS組無
2.2.2 (96h) 與正常牙周膜成纖維細胞組相比1μg/m l LPS、10μg/m l LPS組無統計學差異(P>0.05)。100μg/m l LPS、200μg/m l LPS組促進IL-8分泌,100μg/m l LPS、200μg/m l LPS組之間無統計學差異(P>0.05)。500μg/m l LPS組抑制IL-8分泌,有顯著性統計學差異(P<0.01)。
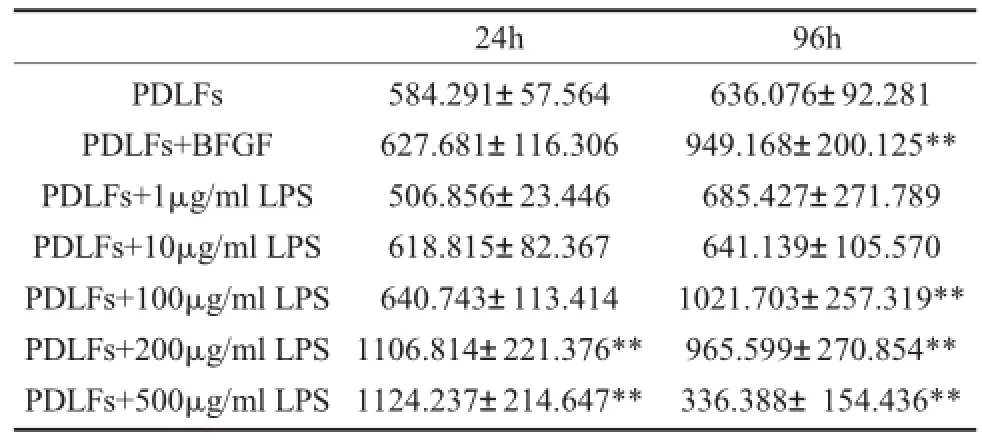
表3 不同濃度LPS刺激細胞后各組IL-8分泌測量(pg/m l)(n=6)
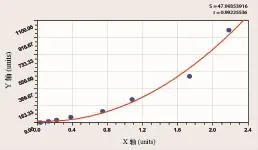
圖5 ELISA IL-8標準曲線
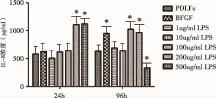
圖6 LPS刺激細胞后各組IL-8分泌量*表示與PDLFs組相比,差異有統計學意義(P<0.01)
3.討論
內毒素是牙周病原菌的重要的毒力因子之一,也是一種潛在的細胞激活因子,對牙周組織有較高的毒性及抗原性,是牙周炎的主要病因之一,它可以直接作用于牙周組織細胞[4,5], 而長期的LPS刺激可能使機體對后續刺激的反應性降低,即產生內毒素耐受[6]。牙周組織處于炎癥狀態下,內毒素耐受可能因機體不能及時有效清除入侵細菌,導致炎癥遷延[7]。牙周膜成纖維細胞在牙周組織健康中承擔著重要的角色[1],內毒素會直接影響牙周膜成纖維細胞的生長與增殖, 并對細胞超微結構有不同程度的損傷[8]。PDLFs 作為牙周膜主要細胞之一具有多種細胞生物學活性[8], 其損傷會給牙周組織的健康帶來嚴重的危害,阻礙牙周組織的再生與修復。在牙周炎的發生發展過程中,內毒素參與牙槽骨、牙齦、牙周韌帶的炎癥破壞和喪失[9]。避免持續LPS刺激導致的過度反應對機體造成的損傷,是宿主防御機制的重要組成部分[10],維持在一定范圍內的內毒素含量,維護牙周組織的健康,避免免疫系統的過度活化產生大量的炎癥因子,引發嚴重的免疫破壞,引起組織損傷,對于牙周炎的治療和預后具有重要的意義[11],值得進一步研究。
在牙周炎發生發展期間,IL-8承擔重要作用,作為免疫調節因子促使破骨細胞分化、成熟、維持骨吸收活性,而作為促炎因子參與牙周組織破壞。內毒素和其他因子刺激下,中性粒細胞以及骨代謝體系中的成骨細胞和破骨細胞都有IL-8的生成[12]。因此,IL-8是參與牙周炎發生發展過程和牙槽骨吸收病理代謝過程之中因子之一。但其表達受到多種牙周致病刺激因素的影響[13]。
本實驗旨在研究不同濃度LPS對hPDLFs生長增殖以及分泌IL-8的影響。牙周膜成纖維細胞會隨時間的生長達到對數平臺期,本實驗在96h時細胞達到最高峰。在IL-8檢測時選取24h細胞貼壁后細胞生長初級階段,96h細胞生長最高峰階段,對比兩階段的各組細胞分泌IL-8的情況。本實驗表明短時間的低劑量的LPS與正常的牙周膜成纖維細胞分泌IL-8并無差異,而短時間高劑量的LPS會促進IL-8的生成。從而促進炎癥的加速進展,破壞牙周組織。而96小時100μg/m l LPS, 200μg/m l LPS會促進IL-8的分泌。1μg/m l LPS、10μg/m l LPS與正常牙周膜成纖維細胞相比無差別。牙周膜作為免疫應答細胞可以修復一定范圍的炎癥,從而達到牙周組織微環境的平衡。長時間的高濃度的LPS刺激下已經超過了PDLFs的調節范圍。從而加速牙周炎的發生發展。使其促進IL-8的分泌從而加速破壞牙周組織,阻礙牙周膜成纖維細胞的自我修復。過高濃度的LPS顯著抑制牙周膜成纖維細胞的生長與增殖。96h時500μg/m l LPS組IL-8分泌合成釋放量明顯下降。可能原因是,高劑量的LPS明顯抑制PDLFs生長增殖,甚至促進PDLFs的凋亡。BFGF明顯促進PDLFs生長增殖,導致IL-8合成釋放也明顯增加,在24h,兩組細胞生長無顯著差異,IL-8亦無統計學差異。96h時兩者細胞生長增殖有顯著差異,IL-8分泌合成釋放也有統計學意義。BFGF組細胞增殖明顯高于對照組、IL-8分泌合成亦高于對照組。故而說明IL-8分泌合成釋放與PDLFs數量有關。500μg/m l LPS顯著抑制PDLFs生長增殖。后期在細胞凋亡時IL-8分泌合成釋放會隨之減少。100μg/m l LPS無明顯促進或抑制牙周膜成纖維細胞的生長和增殖,且會促進牙周膜成纖維細胞分泌IL-8分泌,為較理想的LPS耐受模型的濃度,為后期實驗作為鋪墊。
綜上所述,本實驗結果表明10μg/m l LPS可以促進牙周膜成纖維細胞生長,1μg/m l LPS、100μg/m l LPS與正常牙周膜成纖維細胞增殖無差別。200μg/m l LPS、500μg/m l LPS抑制牙周膜成纖維細胞生長。96h,IL-8分泌合成釋放實驗觀察:100μg/m l LPS刺激合成分泌釋放IL-8量遠遠大于正常PDLFs組。不同濃度的LPS對PDLFs增殖、IL-8分泌具有調節作用。100μg/m l LPS更適合建立內毒素耐受模型,為內毒素作用下對牙周膜成纖維細胞的影響提供資料。
[1] J?nsson D, Nebel D, B ratthall G, et al. The hum an periodon tal ligam ent cell: a fib rob last-like cell acting as an immune cell[J]. J Periodontal Res, 2011, 46(2): 153-157
[2] 孫夢君, 李慧, 孫穎, 等. 內毒素耐受對人牙齦上皮細胞分泌IL-1β、IL-6和IL-8的影響[J]. 口腔醫學研究,2012,28(3): 223-226
[3] 王珺, 歐龍, 羅蕓, 等. 茶多酚對脂多糖誘導人牙周膜成纖維細胞凋亡及炎癥因子的影響[J]. 中華老年口腔醫學雜志,2015, 13(2): 80-84
[4] Tsutsum i T, Takesh i T, Nakash ima K, et al. Involvem ent of adhesion molecule in in vitro plaque-like formation of macrophages stimulated w ith Aggregatibacter actinom ycetemcom itans lipopolysaccharide[J]. J Periodontal Res, 2010, 45(4): 550-556
[5] Johnson GK, Guthm iller JM, Joly S, et al. Interleukin-1 and interleuk in-8 in nicotine- and lipopolysaccharide-exposed ging ival keratinocy te cu ltures[J]. J Periodontal Res, 2010, 45 (4): 583-588
[6] Sun Y, Li H, Yang MF, et al. Effects of aging on endotoxin tolerance induced by lipopolysaccharides derived from Porphy romonas gingivalis and Escherichia coli[J]. PLoS One, 2012, 7(6): e39224
[7] 許雯靜, 李艷芬, 閆福華, 等. IL-10對Pg-LPS刺激下兔枯否氏細胞凋亡的影響[J]. 口腔醫學研究,2012,28(7): 636-639
[8] El-Aw ady AR, Lapp CA, Gam al AY, et al. Human periodontal ligam ent fibroblast responses to compression in ch ron ic periodon titis[J]. J Clin Periodon tol, 2013, 40(7): 661-671
[9] Li X, Kato N, Mezawa M, et al. Transcriptional regulation of bone sialoprotein gene by Porphyromonas gingivalis lipopolysaccharide[J]. J Cell Biochem, 2010, 110(4): 823-833
[10] Gerhold K, Avagyan A, Reichert E, et al. Lipopolysaccharides modulate allergen-specific immune regulation in a m u rine m odel of mucosal tolerance induction. In t A rch A llergy Imm unol, 2008, 147(1): 25-34
[11] 李慧, 孫夢君, 徐艷, 等. IFN-γ對牙齦卟啉單胞菌內毒素誘導的細胞耐受的影響[J]. 口腔醫學研究,2014, 30(2): 100-103
[12] 鄭健, 李海如. 牙周炎患者齦溝液中白細胞介素-8水平的變化[J]. 標記免疫分析與臨床,2011, 18(6): 392-394
[13] 李新月. 脂多糖對牙周膜成纖維細胞IL-8和RANKL基因表達的調節作用[J]. 天津醫科大學學報,2013, 19(6): 452-455
Effectsof lipopolysaccharideson the proliferation and IL-8 secretion of periodontal ligam ent fibroblasts
FUChang-sheng,LIURong-sen,LUO Yun,OU Long,LIYing-chao,ZHANGXian-hua,WANG Jun,DUYan(Departmentof Somatology,Chinese PLAGeneralHospital,Beijing 100853,China)
Objective:To observe the effects of different concentrations of lipopolysaccharides on the proliferation of periodontal ligament fibroblasts and the secretion of IL-8. M ethods:The experiments were divided into seven groups, human periodontal ligament fibroblasts (hPDLFs) group, PDLFs + 10μg/m l basic fibroblast grow th factor (BFGF) group, 1μg/m l LPS group, 10μg/m l LPS group, 100μg/m l LPS group, 200μg/m l LPS group, 500μg/m l LPS group. The cells w ere cultured and MTT assay was used to observe the cell proliferation. The cell supernatant after cultured for 24h and 96h was collected of IL-8 ELISA. Results:Synthesis and release of IL-8: Com pared w ith periodontal ligament fibroblasts group, there were no statistically significant differences in 1μg/m l LPS, 10μg/m l LPS and 100μg/m l LPS groups after cultured for 24h; significant statistical differences were detected in 200μg/m l LPS, 500μg/m l LPS groups. Compared w ith periodontal ligament fibroblasts group, there were no statistically significant differences in 1μg/m l LPS and 10μg/m l LPS group after cultured for 96h; significant statistical differences were detected in 100μg/m l LPS, 200μg/m l LPS, 500μg/m l LPS groups, there was no significant difference between 100μg/m l LPS and 200μg/m l LPS group. Proliferation of human periodontal ligament fibroblasts: there were no statistically significant differences between 1μg/m l LPS, 100μg/m l LPS and controlgroups. The promotion of the proliferation of periodontal ligament fibroblasts was observed in 10μg/m l LPS group. 200μg/m l LPS, 500μg/m l LPS significantly inhibited the proliferation of PDLFs. Conclusion:Different concentrations of lipopolysaccharides can regulate the proliferation of periodontal ligament fibroblasts and the synthesis and release of IL-8. Keywords:lipopolysaccharides; periodontal ligament fibroblasts; IL-8
R781.4
A
1672-2973(2017)02-0082-05
2016-10-09)
付昌盛 解放軍總醫院口腔科碩士生北京100853
劉榮森 通訊作者解放軍總醫院口腔科主任醫師教授北京100853
羅蕓 解放軍總醫院老年病醫學研究所細胞生物研究室副研究員北京100853
歐龍 解放軍總醫院口腔科副主任醫師北京100853
李穎超 解放軍總醫院口腔科副主任醫師北京100853
張賢華 解放軍總醫院口腔科副主任醫師北京100853
王珺 海軍機關門診部口腔科副主任醫師北京100841
杜巖 解放軍總醫院口腔科主治醫師北京100853

